射頻消融應用于四肢骨與軟組織惡性腫瘤治療的效果
胡博,胡勇,徐生林,曹坤,江正,闕玉康
(安徽醫科大學第一附屬醫院骨病骨腫瘤外科,合肥 230022)
四肢骨與軟組織惡性腫瘤常以惡性程度高、生長迅速、預后不佳等為特點[1]。隨著“手術切除+術后輔助放化療”治療模式的廣泛應用,患者的5年生存率提高至60%~70%,保肢率更是達到了80%~90%[2-3]。近十年來,骨腫瘤的治療進入相對平臺期,療效停滯不前,如何改進四肢骨腫瘤的治療方式,提高患者的生存預后已經成為當今的研究熱點[4-5]。射頻消融是一種應用于臨床的腫瘤熱療方法,在骨腫瘤領域,射頻消融的作用被越來越多的專家所關注[6-7]。因此,為尋求更好的療效,我院采用傳統手術合并射頻消融術對82例四肢骨與軟組織惡性腫瘤患者進行治療,現將臨床療效報告如下。
1 對象與方法
1.1 研究對象 選擇2017年12月至2019年6月安徽醫科大學第一附屬醫院骨科收治的四肢骨與軟組織惡性腫瘤患者82例,按隨機數字表法分為兩組:(1)觀察組42例,行常規手術聯合射頻消融技術,其中男性24例,女性18例;年齡范圍20~68歲,年齡(45.3±1.5)歲;其中股骨腫瘤患者17例,脛骨腫瘤患者14例,肱骨腫瘤患者7例,軟組織腫瘤4例;按病理類型分為:骨肉瘤17例,軟骨肉瘤8例,惡性纖維組織細胞瘤2例,尤文肉瘤1例,骨轉移瘤11例,滑膜肉瘤2例,脂肪肉瘤1例。(2)對照組40例,僅行常規手術治療,其中男性21例,女性19例;年齡范圍20~68歲,年齡(44.9±1.3)歲;其中股骨腫瘤患者15例,脛骨腫瘤患者16例,肱骨腫瘤患者5例,軟組織腫瘤4例;按病理類型分為:骨肉瘤14例,軟骨肉瘤10例,惡性纖維組織細胞瘤1例,骨轉移瘤12例,滑膜肉瘤2例,脂肪肉瘤1例。兩組患者在性別、年齡、發病部位及病理分型等方面比較差異均無統計學意義(P值均>0.05),具有可比性。本研究方案經安徽醫科大學倫理委員會批準。
1.2 納入與排除標準 納入標準:(1)經影像學及病理學檢查確診為四肢骨與軟組織惡性腫瘤的單發患者;(2)年齡20~68歲;(3)患者均知情并簽署知情同意書。排除標準:(1)合并嚴重臟器疾病;(2)存在自身免疫系統疾病;(3)臨終期患者及嚴重凝血功能障礙者;(4)合并精神類疾病或有手術禁忌證者;(5)身體條件不能耐受手術者。
1.3 方法 觀察組:患者全身麻醉后貼射頻消融專用負極板。切開皮膚,分離顯露腫瘤部位,根據瘤體形狀和大小,選擇合適電極針,將電極針插入瘤體內合適部位進行射頻消融(若瘤體巨大可分次進行多靶點消融)。射頻消融溫度設置在80~95 ℃范圍,持續消融3 min,刮除消融后腫瘤組織及鄰近部分骨與軟組織,在切除后可在周圍組織中進行2次消融,最后視病變部位、腫瘤分級、骨量多少來決定采用重建方式。射頻消融設備采用上海邁德公司的S-1500射頻消融系統,儀器參數設置為頻率 480 kHz,功率為150 W,電極針規格為19G單針。對照組:僅采用傳統的手術切除加重建術,除未使用射頻消融術外,其余手術方式與觀察組相同。
1.4 觀察指標 (1)患者出院后每個月復查,術后隨訪6~18個月,記錄患者隨訪期間是否有腫瘤復發、轉移及死亡等情況;(2)術中情況:統計兩組手術時間和術中出血量;(3)疼痛評估:分別于術前和術后1月、3月、6月、12月采用疼痛視覺模擬評分(VAS)行疼痛程度評估,分為0~3級[8](0級:0分,無痛;1級:1~4分,輕度疼痛,但在可忍受范圍內,無須應用止痛藥且不影響正常生活;2級:5~6分,中度疼痛,伴有短時劇痛,干擾正常睡眠,需應用止痛藥;3級:7~10分,疼痛明顯或劇烈,夜間睡眠受嚴重干擾,必須使用止痛藥才能緩解)。(4)術后肢體功能評分:根據國際骨與軟組織腫瘤協會MSTS (Musculoskeletal Tumor Society)功能評分系統對其進行功能評分,該評分系統包括疼痛、整體功能活動、心理接受程度、行走時是否需外部支持、行走功能及步態等,各項評分均為0~5分,滿分30分。
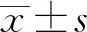
2 結果
2.1 手術時間及術中出血量 射頻消融組的手術時間比傳統手術組長(P<0.05),但術中出血量較傳統手術組明顯減少(P<0.05),差異有統計學意義。見表1。
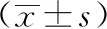
表1 兩組四肢骨與軟組織惡性腫瘤患者手術時間 與術中出血量的比較

表2 兩組四肢骨與軟組織惡性腫瘤患者手術前后VAS評分的比較分)
2.2 VAS評分 術前兩組患者VAS評分差異無統計學意義(P>0.05)。術后1、3、6、12個月,兩組患者VAS評分均顯著低于同組治療前;觀察組手術1、3個月后均顯著低于對照組同期(P<0.05),且隨著時間的延長有不斷降低的趨勢。兩組患者術后6、12個月比較,差異無統計學意義(P>0.05)。見表2。
2.3 MSTS評分 觀察組功能評分(22.72±6.56)分,對照組功能評分(19.53±5.40)分,兩組肢體功能評分差異無統計學意義(t=1.34,P=0.164)。
2.4 隨訪情況 82例患者均接受隨訪,隨訪時間6~18個月,全部進入結果分析。82例患者大部分獲得較好的功能恢復,至2020年6月隨訪期,生存73例,死亡9例;其中觀察組4例復發,34例未復發,復發率約為10.5%。對照組7例復發,1例術后骨折,28例未復發,復發率為20.0%。兩組復發率比較,差異無統計學意義(χ2=1.278,P>0.258)。
3 討論
隨著醫學的不斷發展,四肢惡性腫瘤從以前的截肢到現在的保肢,再到“廣泛性切除和全身放化療”的綜合治療模式,使腫瘤患者的預后得到了很大改善[9]。研究表明,放療和化療對于消滅微小病灶非常有效,并能使患者的無病生存率由以前的不足10%增加到50%~65%[10],但35%~45%患者依然對化療的反應不佳,出現轉移的患者5年生存率仍然不足20%[11],這可能是其對放、化療不敏感和耐藥,為了尋求更有效的治療途徑,射頻消融在骨腫瘤中的作用逐步被大家認識。它通過射頻電流使細胞內的分子互相摩擦產生高熱,從而使組織熱凝固性壞死和變性達到減滅腫瘤的目的,提高療效。
本研究結果顯示:觀察組患者的手術時間較對照組長,是因為術中增加了射頻消融操作的原因,但是合并術中射頻消融的手術出血量明顯減少,因此射頻消融能夠減少手術出血,減少術后并發癥的產生;觀察組術后復發率約為10.5%。對照組為20.0%,這說明經射頻消融,可殺滅更多微小病灶,降低術后復發率;術前兩組患者VAS評分差異無統計學意義(P>0.05)。術后1、3、6、12個月,兩組患者VAS評分均顯著低于同組治療前,說明手術治療能夠明顯改善腫瘤患者疼痛癥狀;觀察組術后1、3月VAS評分均顯著低于對照組同期(P<0.05),且隨著時間的延長有不斷降低的趨勢,表明術中聯合射頻消融能夠有效緩解疼痛癥狀,有利于患者術后功能恢復,提高生活質量。當然,疼痛的減輕意味著更好的術后功能恢復。本研究中雖然兩組肢體功能評分差異無統計學意義,但觀察組術后功能評分數與對照組相比明顯升高,患者在使用傳統治療聯合射頻消融后,更有利于患者功能恢復,提高患者生命質量。
在四肢骨與軟組織惡性腫瘤的手術中,如何最大限度地保留正常組織,使患者關節功能得到最好的恢復,是骨腫瘤醫生研究的重點。射頻消融在手術過程中,能夠均勻地對軟組織進行電離輻射,對腫瘤組織熱凝固的同時也能對手術切除邊緣的微小病灶進行滅活,達到更徹底殺滅惡性腫瘤細胞的目的[12]。手術聯合射頻消融術及術后放化療是治療四肢惡性骨腫瘤的最優方法[13-14]。綜上所述,射頻消融治療四肢骨與軟組織惡性腫瘤可以顯著提高臨床治療效果,減少復發,減輕疼痛,提高術后患者的肢體功能,大幅度提升患者的術后生活質量。

