利用多重PCR和快提DNA結合快速鑒定甜瓜雜種純度
賀玉花 戶克云 趙光偉 孔維虎 張健 徐永陽

摘? ? 要:純度是決定種子質量的重要指標之一。以眾天10號和其父母本為研究材料,將快提DNA法與多重PCR法相結合,成功建立一套三重PCR甜瓜雜種純度快速鑒定體系。采用堿裂解快速提取DNA的方法,可以在5 min內提取96個DNA;采用三重PCR,能有效克服單一PCR在種子純度鑒定中速率慢的缺陷。試驗中SSR分子鑒定眾天10號雜交種純度為100%,與田間鑒定結果一致。為甜瓜乃至作物雜種種子的純度鑒定提供了一套精度更高、速度更快、成本更低的技術體系。
關鍵詞:甜瓜;SSR;多重PCR;快提DNA;純度鑒定
中圖分類號:S652 文獻標志碼:A 文章編號:1673-2871(2021)12-023-05
Abstract: Purity is one of the most important indicators of seed quality. A hybrid Zhongtian No. 10 and their parents were used in this study; and by combining the rapid DNA extraction method with the multiple PCR, a triple PCR purity identification system of hybrid seeds in melon was established. The rapid alkaline lysis method was used to extract the genome DNA, which can extract the genomic DNA of 96 samples in five minutes. The triplex PCR could effectively overcome the shortcomings of the single-PCR with slow speed in seed purity identification. The result of SSR molecular identification was that the purity of the Zhongtian No. 10 hybrid was 100%, and it was no significant difference with field identification. This study provides a technical system with the advantages of high-accuracy, rapid and low-cost for the purity identification of hybrid seeds in melon and other crop.
Key words: Melon; SSR; Multiplex PCR; Rapid DNA extraction; Purity identification
甜瓜(Cucumis melo L.)又名蜜瓜或香瓜,原產于印度、非洲熱帶沙漠地區[1-2],是喜溫、耐熱性較強的一年生蔓生作物。中國甜瓜面積占世界總面積的45%以上,產量占55%以上[3],是我國重要的經濟水果之一。市面上銷售的甜瓜種子大部分為雜交1代,而種子純度是生產和銷售過程中重要的指標之一。目前,種子純度的檢測方法主要采用傳統的田間形態學方法,周期較長且花費較高,受自然環境條件影響大。分子標記鑒定技術具有周期短、準確度高等優點[4]。簡單重復序列(simple sequence repeats,SSR)是目前最常用的純度鑒定標記之一,具有多態性、共顯性和高度重復性等優點,被廣泛應用于許多作物的雜種純度鑒定[4-13]。
在利用SSR分子標記鑒定雜種純度的過程中,DNA提取和PCR擴增是關鍵的步驟。傳統的DNA提取方法試驗操作復雜,費時費力,改良后的堿裂解快提DNA方法可在5 min提取96個DNA,大大縮短鑒定周期[14]。在雜種純度鑒定過程中,一般需要2~3對引物才能準確鑒定出雜種的純度,而傳統的PCR反應一般加入1對引物。多重PCR(multiplex PCR)可以在同一PCR反應體系里加入2對及以上標記,能同時擴增出多個核酸片段,以盡可能少的消耗獲得盡可能多的遺傳信息,被廣泛應用在多種作物雜種純度鑒定中[15-17]。胡倩梅等[15]利用多重PCR對甜瓜雜交1代品種進行純度鑒定,多重PCR相較于單一PCR能夠縮短工作時間,減少試劑消耗,增加鑒定的準確性。目前,快提DNA方法在白菜[18]等作物雜種純度鑒定中得到應用,在甜瓜種子純度的檢測中尚未得到應用,更沒有和多重PCR結合,快提DNA的質量是否滿足多重PCR對于DNA質量的要求,有待進一步研究。
筆者以眾天10號雜交種為材料,利用多重PCR和快提DNA法結合快速鑒定甜瓜雜種純度,結合田間鑒定進行驗證,建立一套快速、準確的純度鑒定體系。此方法不僅提高了純度鑒定的準確性,而且大大縮短了鑒定周期,保障了農民和銷售商的利益。
1 材料與方法
1.1 材料
試驗于2020年9—12月在中國農業科學院鄭州果樹研究所進行。供試材料為雜交甜瓜品種眾天10號及其相對應的親本:母本P1和父本P2,其中P1和P2為中國農業科學院鄭州果樹研究所甜瓜育種課題組選育的高代自交系。
1.2 試驗材料種植
選取籽粒飽滿無傷的種子,眾天10號種子200粒,親本種子各20粒,55 ℃溫湯浸種4 h,播種于事先裝有吸好水的紅色陶土的保鮮盒內,播種后在種子上蓋上一層吸好水的紅色陶土,用保鮮膜將保鮮盒密封保水(留有少量通氣孔),放置于光照培養箱(全日照,溫度30 ℃)中育苗。待種子破土后,揭去保鮮膜,在種子表面適當噴灑水分,保持陶土濕潤即可。待子葉完全展開,進行取樣鑒定。
田間種植純度鑒定:父母本各種植10株作為雜種植株表型性狀對比,每個小區種植雜種1代植株100株,3次重復,在果實充分發育成熟時觀察并統計植株表型性狀、進行純度鑒定。
1.3 DNA提取方法
DNA提取采用改良的堿裂解快提DNA法[14],具體如下:首先將96孔PCR板(板1)放在事先存放在-20 ℃冰箱的冰盒上,并用連打槍加入每孔80 μL的滅菌TE緩沖溶液(0.05 mol·L-1 Tris-HCl(pH=7.0)+0.1 mmol·L-1 EDTA);用鑷子撕取面積約為0.3 mm2的甜瓜子葉葉片組織,放入另一塊放在冰盒上的96孔PCR板(板2)中;將放入葉片的PCR板(板2)中每孔分別加入2個直徑為2 mm的小鋼珠;用連打槍在放有葉片組織的96孔板(板2)中加入100 μL 0.25 mol·L-1的NaOH溶液;用硅膠墊蓋在加入葉片、小鋼珠和NaOH溶液的PCR板上,并放到組織研磨器中將其固定;用組織研磨器在頻率55 Hz、時長60 s的設置下將葉片搗碎,用排槍快速吸取8 μL組織研磨液加入到事先準備好的有80 μL的TE緩沖溶液的PCR板(板1)中,用排槍吸打均勻,并用離心機(2000 r·min-1)離心2 min,放于4 ℃冰箱保存待用。此過程需要注意的是加入NaOH溶液后的操作必須在5 min之內完成。
1.4 SSR分析及多重PCR引物組合的選擇
SSR引物來源于Cucurbit Genomics Database網站(網址:http://www.icugi.org/cgi-bin/ICuGI/index.cgi),由上海生物工程有限公司合成。將覆蓋甜瓜全基因組的326對SSR引物分別在2個親本間進行多態性篩選,根據差異引物產物的片段大小,選擇引物間產物片段大小相差60 bp及以上的引物組合,進行多重PCR擴增[15]。
1.5 PCR程序及電泳檢測
普通PCR反應體系及程序:反應體系(10 μL)包含:Magic Mix×2.0 5 μL,無菌去離子水3 μL,引物(10 μmol·μL-1) 1 μL,DNA模板(50 ng·μL-1) 1 μL。擴增程序:94 ℃變性5 min;94 ℃變性30 s,55 ℃退火45 s,72 ℃延伸1 min,35個循環;72 ℃延伸7 min。4 ℃保存。
多重PCR反應體系及程序:選擇3對SSR標記進行多重PCR擴增,反應體系(10 μL)包含:Magic Mix×2.0 5 μL,無菌去離子水1 μL,3對SSR引物(10 μmol·μL-1) 各1 μL(上游引物和下游引物各0.5 μL)共3 μL,DNA模板(50 ng·μL-1)1 μL。擴增程序:采用Touch-down擴增程序,94 ℃變性5 min;94 ℃變性30 s,65~56 ℃退火45 s,72 ℃延伸1 min,10個循環,每個循環退火溫度降低1 ℃;94 ℃變性30 s,55 ℃退火45 s,72 ℃延伸1 min,27個循環;72 ℃延伸7 min。4 ℃保存。
PCR反應產物加2 μL 6×loading buffer上樣,用8%的聚丙烯酰胺凝膠進行電泳,每個點樣孔上樣量1.5 μL,200 V恒電壓電泳1.5 h。采用快速銀染法進行檢測。
1.6 分子標記的純度鑒定結果與田間純度鑒定結果的比較
分子標記純度鑒定:根據PCR產物的電泳條帶,只具有母本帶型的后代為假雜種,具有父本和母本合并特征帶型的為真雜種,統計真雜種和假雜種的數量,計算雜交種純度。分子標記鑒定品種純度/%=(真雜種數/總檢測數)×100。
田間純度鑒定:根據株型、果實性狀等形態指標進行鑒定,取3個重復數據的平均值為最終的田間鑒定結果。最終將分子標記純度鑒定結果與田間鑒定結果進行比較分析。
2 結果與分析
2.1 親本間SSR引物篩選
將覆蓋甜瓜全基因組的326對SSR引物分別在2個親本間進行多態性篩選,其中,79對引物在親本之間顯示出多態性,多態性比率為24.23%。
2.2 多重PCR組合的建立和擴增條件篩選
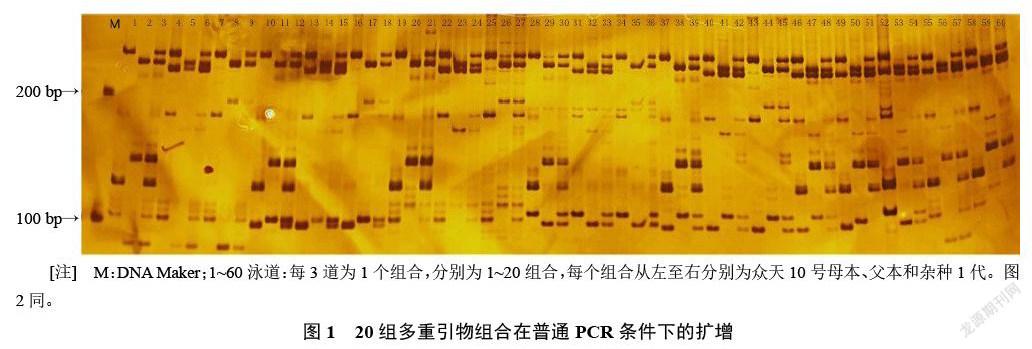
從79對差異引物中,選取擴增條帶清晰、沒有多余雜帶、可以明顯區分開的引物9對(表1)。根據表1中9對SSR引物PCR產物片段長度,選取20組多重PCR組合(表2)進行多重PCR組合和擴增條件的篩選。
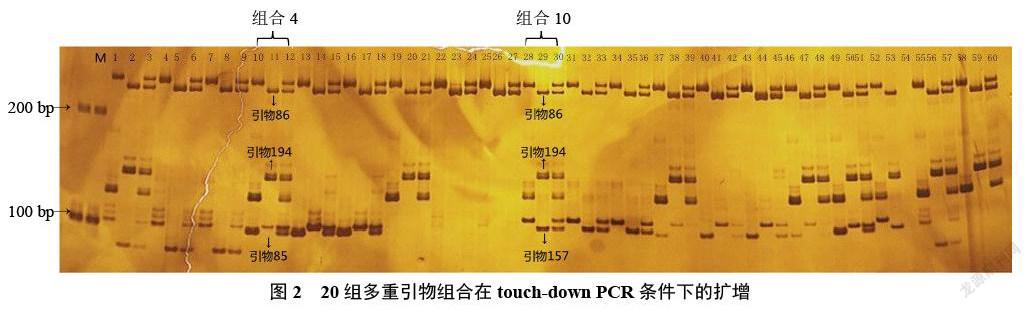
20組多重PCR組合分別利用普通PCR反應條件(圖1)和touch-down PCR反應條件(圖2),在普通PCR條件下,擴增產物中有較多雜帶;在touch-down PCR反應條件下,條帶清晰,雜帶較少。因此,touch-down PCR反應條件比普通PCR條件更適合作為多重PCR反應條件,同時也說明快提DNA的方法可以應用到多重PCR。根據圖2所示,在touch-down PCR反應條件下,引物154、242和284沒有擴增產物,引物20、118條帶都不清晰。所以,在9對引物中,5對引物(20、118、154、242和284)不可以和其他引物進行組合進行多重PCR,4對引物(85、86、157和194)可以重組進行多重PCR。引物85、86、157和194分別組成了組合4(引物85、86和194)和組合10(引物86、157和194),而組合4中引物85在父母本間的條帶接近,影響雜交1代雜交帶讀帶的準確性,而組合10中引物157在雜交F1中條帶清晰。最終,選擇組合10在touch-down PCR反應條件下,對雜交種子進行純度鑒定。
2.3 多重SSR標記純度鑒定與大田純度鑒定的對比
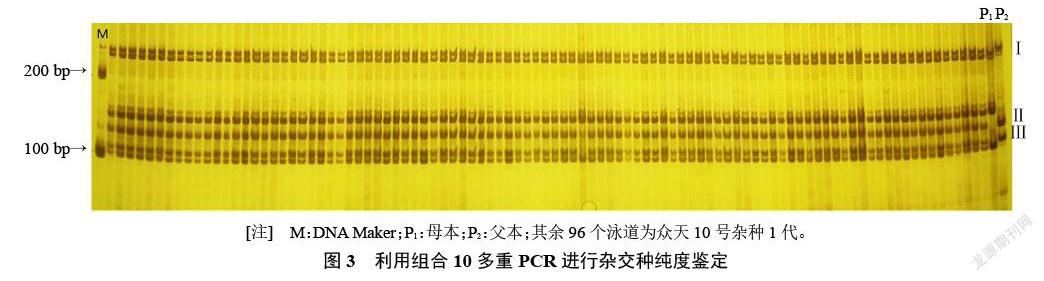
以組合10(引物86、157和194)為三重PCR組合,以touch-down PCR反應條件作為PCR反應條件,對192份眾天10號雜交種進行純度鑒定。圖3顯示,擴增產物可以明顯分為3個區域,第Ⅰ區域為引物86,第Ⅱ區域為引物194,第Ⅲ區域為引物157,均為父母本雜合帶型,為真雜種,由此得出眾天10號甜瓜品種的純度為100%。田間種植中,通過觀察田間性狀和果實性狀等指標,對眾天10號雜交種進行純度鑒定,其田間純度為100%,與多重PCR鑒定結果一致。試驗結果表明,利用多重PCR和堿裂解快提DNA結合可以快速鑒定甜瓜雜種純度。
3 討論與結論
種子純度是種子質量的關鍵因素之一,SSR分子標記純度鑒定技術被廣泛應用于許多作物的雜種純度鑒定中[4-13]。在利用SSR分子標記鑒定雜種純度過程中,DNA提取和PCR擴增是關鍵的步驟。傳統的PCR反應一般加入1對引物,而雜種純度鑒定一般需要2~3對引物才能準確鑒定出雜種的純度,筆者利用多重PCR可以在同一PCR反應體系里加入2對及以上分子標記,能夠縮短工作時間,減少試劑消耗,提高鑒定的準確性。傳統的CTAB提取DNA法整個過程至少需要2 h,且試驗操作復雜,筆者利用改良后的堿裂解快提DNA方法可在5 min內提取96個DNA,且不需要稀釋可以直接應用于PCR擴增,大大縮短鑒定周期。
雜交種子常規SSR純度檢測流程一般包括DNA提取、PCR擴增、電泳、結果分析等4個步驟。筆者從DNA 提取和PCR擴增環節對整個過程進行了優化,而近年來通過優化PCR程序來縮短PCR擴增時間的快速PCR體系也不斷應用于其他作物[17]的純度鑒定中,快速PCR是否能與多重PCR和快提DNA結合應用于甜瓜雜種純度鑒定,有待進一步研究。
筆者以雜交甜瓜品種眾天10號及其對應親本為材料,利用多重PCR和堿裂解快提DNA結合快速鑒定甜瓜雜種純度,建立一套快速、準確的純度鑒定體系,此方法不僅提高了純度鑒定的準確性,且能夠在1個工作日完成整個分子試驗全部流程,大大縮短了鑒定周期,為利用分子標記進行甜瓜雜種純度鑒定的相關研究提供了一定的參考。
參考文獻
[1] 林德佩.中國栽培甜瓜植物的起源、分類及進化[J].中國瓜菜,2010,23(4):34-36.
[2] ZHAO G W, LIAN Q, ZHANG Z H, et al. A comprehensive genome variation map of melon identifies multiple domestication events and loci influencing agronomic traits[J].Nature Genetics,2019,51(11):1607-1615.
[3] 王娟娟.我國瓜菜產業現狀與發展方向[J].中國蔬菜,2017(6):1-6.
[4] 趙光偉,歐點點,賀玉花,等.SSR標記對甜瓜雜交種‘眾天翠雪’純度的鑒定[J].中國農學通報,2017, 33(9):37-40.
[5] 李麗,張萬清,劉玲,等.SSR標記對甜瓜品種純度和真實性的鑒定[J].分子植物育種,2015,13(11):2522-2530.
[6] 賀玉花.甜瓜霜霉病抗性基因的SSR標記[D].北京:中國農業科學院,2014.
[7] 何玉,楊坤.利用SSR技術鑒定西瓜甜瓜種子純度[J].中國瓜菜,2020,33(1):13-17.
[8] 方小雪,姚少林,薄永明.利用SSR分子標記鑒定甜瓜雜交種純度[J].浙江農業科學,2016,57(2):178-181.
[9] 姜陸,盧浩,王賢磊,等.快速檢測甜瓜西州蜜17號種子純度的SSR標記[J].新疆農業科學,2016,53(3):407-410.
[10] 苗素平.SSR標記技術在“紫甘1號”紫甘藍雜交種純度鑒定中的應用[J].信陽農林學院學報,2017,27(2):88-90.
[11] 武婷,郭誠,巫水欽,等.應用SSR標記鑒定甜瓜流星翡翠的種子純度[J].浙江農業科學,2020,61(5):841-842.
[12] 李超,孫玉萍,楊英,等.厚皮甜瓜品種組合種子純度鑒定SSR引物的篩選[J].分子植物育種,2019,17(16):5347-5356.
[13] 武云鵬,李肯,張若緯,等.利用SSR分子標記技術快速鑒定津甜100甜瓜種子純度[J].中國瓜菜,2021,34(3):27-30.
[14] 孫利萍,賈芝琪,胡建斌,等.堿裂解法快速提取番茄DNA的研究[J].河南農業大學學報,2012,46(2):136-138.
[15] 胡倩梅,王躍君,楊世超,等.多重PCR在甜瓜種子純度鑒定中的應用[J].分子植物育種,2019,17(12):4000-4006.
[16] 馬增鳳,韋敏益,黃大輝,等.多重PCR技術可鑒定雜交水稻種子純度[J/OL].分子植物育種,2021:1-15[2021-08-31].http://kns.cnki.net/kcms/detail/46.1068.S.20210223.0829.002.html.
[17] 任星旭,易紅梅,劉豐澤,等.快速多重SSR法在玉米種子純度鑒定中的分析[J/OL].分子植物育種,2021:1-16[2021-08-31].http://kns.cnki.net/kcms/detail/46.1068.S.20210222.1544.008.html.
[18] 徐營莉,華德平,張紅,等.白菜類蔬菜種子純度SSR分子標記鑒定[J].分子植物育種,2020,18(1):187-192.

