水熱法制備參數對MnFe2O4/g-C3N4催化劑催化降解雙酚A的影響
陳梅榮,王金玉
(1.延安職業技術學院 石油和化學工程系,陜西 延安716000; 2.西南石油大學化學化工學院,四川 成都 610500)
目前,雙酚A(BPA)被廣泛應用于眾多工業領域,因此在全球范圍內獲得大量生產,也造成了許多污染問題[1-2]。大部分雙酚A都是在生產過程或制品使用期間流入水體中,嚴重危害水體生物的生存環境并對人類健康造成威脅[4-5]。隨著雙酚A處理工藝的不斷發展,已經形成了機械分離法、生物吸附與氧化處理等多種處理方式[6-9]。但上述各類處理技術在消除雙酚A過程中都面臨著一些不足。其中,機械分離技術無法達到對雙酚A的徹底去除;采用生物處理工藝則需要花費很長的時間,并且降解效率偏低。現階段使用最多的是化學氧化技術,尤其是光催化氧化技術,由于具備高效環保的優勢,在去除雙酚A方面獲得了廣泛使用[10-11]。例如有學者采用石墨相氮化碳(g-C3N4)作為光催化劑對一些難以降解的污染物進行可見光條件下催化分解[12-13]。g-C3N4具有穩定性高,不會造成環境污染等優點,但其無法實現對光生載流子的高效分離,同時對太陽光也不能達到高效利用[14]。為克服上述問題,可以采用適當改性或結合使用更加高效的氧化工藝來促進光催化活性的顯著提升。此外,還有一些學者運用硫酸根自由基來獲得更優的氧化效果,并對相關作用機理進行了分析[15]。本文采用水熱處理工藝制備含有 MnFe2O4納米球的 g-C3N4復合光催化劑,并對催化劑光催化降解雙酚A進行研究。
1 實驗部分
1.1 催化劑制備
通過熱縮聚工藝制備g-C3N4催化劑試樣。首先將 5.00 g 三聚氰胺放入坩堝內;然后利用馬弗爐對其按5 ℃·min-1的速率升溫至550 ℃,保持處理 3 h得到塊體;最后把制得的塊體研磨成粉末狀,待用。
通過水熱處理工藝制備MnFe2O4/g-C3N4復合催化劑。首先取40 mL的乙二醇,加入 1 g的PVP充分攪拌,再添加適量的g-C3N4達到均勻混合狀態;然后在上述混合液內添加 0.42 g的MnSO4·H2O、2.46 g的NaAc和1.35 g的FeCl3· 6H2O,攪拌處理1 h;最后在不銹鋼釜中對溶液進行水熱處理,將其升溫到 200 ℃并保持 12 h,降至室溫用去離子水反復清洗10次,將制得的固體粉末升溫到 60 ℃經過8 h烘干,待用。
1.2 催化劑表征
采用X/Pert PRO 型X射線衍射對催化劑結構進行XRD測試;利用VERTEX 70型傅里葉紅外光譜儀表征催化劑的各官能團參數;通過SU-8020型掃描電鏡與H7500型透射電鏡觀察催化劑的微觀組織結構;利用Hitachi 3010型紫外漫反射光譜儀表征催化劑的光學特性。
1.3 分析方法
配制10 mg · L-1的雙 酚 A 溶液100 mL,稱取所需量的催化劑加至上述溶液中,磁力攪拌下按照固定間隔時間取樣,采用相同質量的甲醇進行淬滅得到 0.2 μm厚的膜層。對其進行乙醇與去離子水清洗后再放入烘箱內 60 ℃下持續烘干5 h。通過Waters2695型高效液相色譜儀對雙酚A的含量進行測試,選擇 C18型色譜柱并使用紫外測試器。
2 結果與討論
2.1 催化劑表征結果
圖1為MnFe2O4、 g-C3N4以及 MnFe2O4/g-C3N4試樣的 XRD圖。
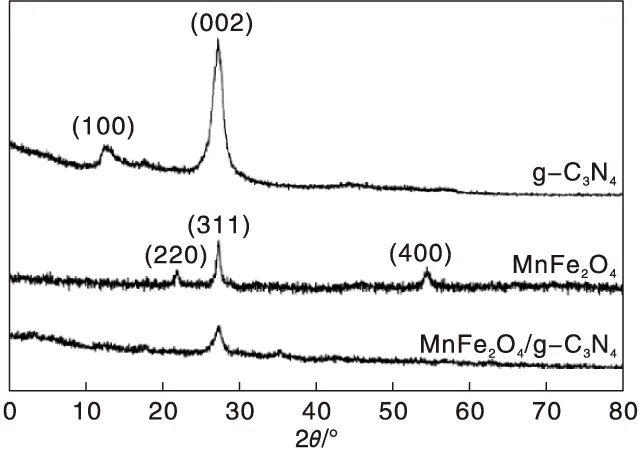
圖1 MnFe2O4、g-C3N4以及 MnFe2O4 /g-C3N4 試樣的XRD圖Figure 1 XRD patterns of MnFe2O4,g-C3N4 and MnFe2O4/g-C3N4 samples
圖1中 MnFe2O4試樣在2θ為 21.8°、28.3°與 54.5°處形成了相應的衍射峰,根據標準卡片可知這些衍射峰都是對應于尖晶石MnFe2O4的衍射峰,表明制得了尖晶石 MnFe2O4顆粒。對 MnFe2O4/g-C3N4的XRD圖進行分析可知,分別形成了 g-C3N4與 MnFe2O4對應的衍射峰,沒有雜質成分對應的衍射峰,表明在復合催化劑中存在 g-C3N4和 MnFe2O4兩種物相成份。
圖2為MnFe2O4/g-C3N4催化劑的SEM和TEM照片。從SEM照片可以看出,在g-C3N4納米片表面形成了球形的 MnFe2O4顆粒。從TEM照片可以發現在層狀 g-C3N4納米片上分布著許多球形小顆粒,可以推斷在g-C3N4表面已經負載上了 MnFe2O4納米顆粒。根據上述分析可知,可以利用水熱工藝制備得到MnFe2O4/g-C3N4復合半導體。由于MnFe2O4納米顆粒已經和 g-C3N4達到緊密結合狀態,這為兩者交界處的光生載流子傳輸提供了大量通道,因此 g-C3N4獲得了更優的光催化性能。

圖2 MnFe2O4/g-C3N4催化劑的 SEM和TEM 照片Figure 2 SEM and TEM images of MnFe2O4/g-C3N4 catalyst
2.2 參數優化
2.2.1 MnFe2O4摻雜量
圖3為不同MnFe2O4摻雜量對MnFe2O4/g-C3N4催化劑催化降解雙酚A性能的影響。從圖3可以看出,摻雜不同含量的MnFe2O4時,MnFe2O4/g-C3N4催化劑對雙酚A的去除率發生了較大變化。隨著MnFe2O4摻雜量提高,雙酚A去除率先升后降,當MnFe2O4摻雜量為30%時,雙酚A去除率最高,達到 96.4%。繼續提高MnFe2O4摻入量至40%,雙酚A去除率下降,變為73%。產生上述現象的原因在于,當在 g-C3N4表面形成更高比例的 MnFe2O4后,可以使g-C3N4表面獲得更多的 PMS活化點,兩者結合后產生異質結,使 g-C3N4可以對光生載流子進行更高效分離,因此獲得更高的雙酚A降解效率。隨著MnFe2O4摻雜量的繼續增加,會影響到雙酚A降解活性,導致雙酚A去除率的下降。選擇MnFe2O4含量為30%進行后續實驗。
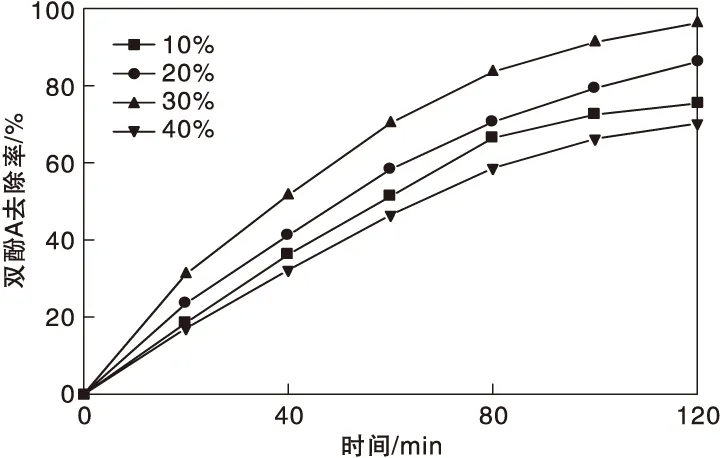
圖3 MnFe2O4摻雜量對雙酚A去除率的影響Figure 3 Effect of MnFe2O4 doping amount on BPA removal rate
2.2.2 催化劑用量
圖4為MnFe2O4/g-C3N4催化劑用量對雙酚A去除率的影響。從圖4可以看出,提高催化劑用量后,雙酚A去除率先上升再下降。這是因為處于低濃度下,當催化劑含量提高后,形成了更多的活性點,此時在體系內形成了大量活性自由基,使 雙酚A發生更快降解。但隨著催化劑加入量進一步增高后,溶液透光率減小,阻礙了 g-C3N4的吸光過程,導致無法發揮良好的光催化性能。選擇MnFe2O4/g-C3N4催化劑用量為1.0 g·L-1進行后續實驗。
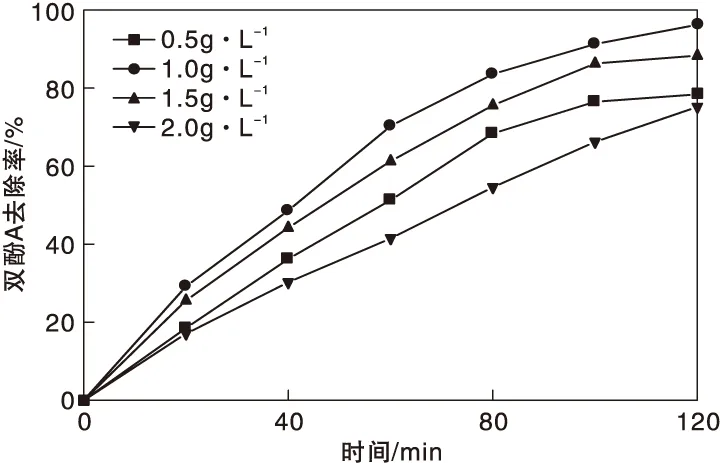
圖4 MnFe2O4/g-C3N4催化劑用量對雙酚A去除率的影響Figure 4 Effect of MnFe2O4/g-C3N4 catalyst dosage on BPA removal rate
2.2.3 反應溶液 pH值
圖5為溶液 pH值對雙酚A 去除率的影響。從圖5可以看出,改變 pH值后,雙酚A基本保持穩定的降解率。pH=9時,雙酚A達到了99%的最大去除率; pH=5 時,雙酚A去除率發生了減小現象,此時雙酚A去除率接近93%。這是因為堿能夠對 PMS起到活化作用,使雙酚A被快速去除。當處于酸性溶液中時,雙酚A 基本都轉變為H2SO5,阻礙了催化劑的催化過程,從而減小了雙酚A的去除率。
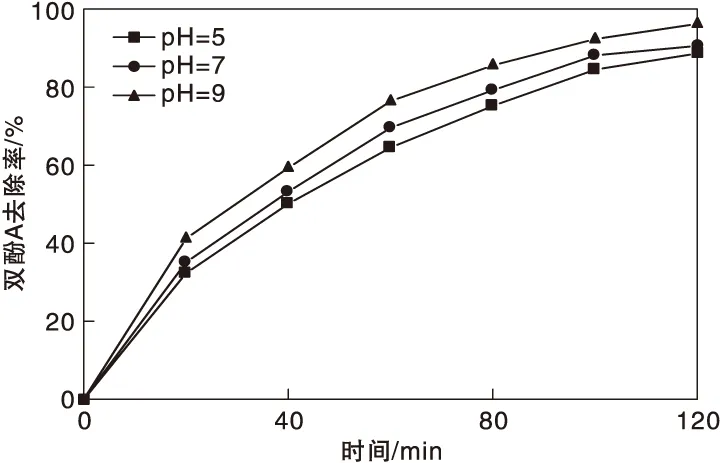
圖5 溶液 pH值對雙酚A 去除率的影響Figure 5 Effect of solution pH value on BPA removal rate
2.3 不同催化劑體系
表1為不同催化劑體系下雙酚A的去除率。根據表1結果可知,處于可見光環境下,各催化體系中都發生了光催化過程。持續光照處理 2 h后,g-C3N4和 MnFe2O4依次使 雙酚A降解了18%和13%,而MnFe2O4/g-C3N4體系中雙酚A去除率達到了85%,由此表明,采用 MnFe2O4對g-C3N4改性處理后能夠達到更高效的催化效果。這主要是因為 MnFe2O4可以對 PMS起到良好的活化效果。

表1 不同催化劑體系下雙酚A 去除率Table 1 Removal rates of 雙酚A under different catalyst systems
3 結 論
(1)MnFe2O4/g-C3N4催化劑XRD分析結果表明,MnFe2O4/g-C3N4形成了 g-C3N4和MnFe2O4對應的衍射峰。在g-C3N4納米片層表面形成了球形的 MnFe2O4顆粒,在層狀g-C3N4納米片上分布著許多球形小顆粒,表明可以利用水熱工藝制備得到MnFe2O4/g-C3N4復合半導體。
(2)隨著MnFeO4摻雜量提高,雙酚A 去除率先上升再下降;提高催化劑用量,雙酚A去除率先上升再下降;改變 pH值后,雙酚A保持基本穩定的去除率,當pH=9時,雙酚A去除率最高,達到99%。采用MnFe2O4對g-C3N4改性處理后能夠達到更高效雙酚A去除效果。

