全視網膜光凝技術聯合康柏西普對新生血管性青光眼的療效
宋婭琴,馬雪英,王篤親,吳 敬
新生血管性青光眼(neovascular glaucoma, NVG)是臨床常見的視網膜血管性疾病的眼部并發癥,由于纖維血管組織向房角增生并覆蓋小梁網組織,導致小梁網阻塞,周邊虹膜前粘連并引起房角進行性關閉,房水無法流出通道,最終發生青光眼[1-2]。全視網膜光凝(panretinal photocoagulation, PRP)是臨床常用的手術方案,且存在的未消退新生血管和持續性高眼壓可引起房角關閉、視神經損害等[3]。術前注射抗血管內皮細胞生長因子(vascular endothelial growth factor, VEGF)藥物可有效抑制血管內皮細胞增生,促進虹膜、房角新生血管的消退,最終有效控制眼壓[4]。劉穎 等[5]研究發現術前于玻璃體腔注射康柏西普后依次行小梁切除術、PRP技術可控制眼壓在有效范圍內。炎癥狀態、血管新生均可增加眼壓,影響視力,其中前者可通過增加血管通透性使得大分子進入組織液,從而增加眼壓,而后者則可導致房角周邊黏連、關閉等[6],該文將以此為評價指標,通過實例進一步探討PRP技術聯合康柏西普的療效。
1 材料與方法
1.1 病例資料選取青海省人民醫院2017年6月—2018年12月收治的112例NVG患者(112只眼為研究組),選取同時段于體檢中心檢查同年齡段的健康者作為健康組(100例),年齡48~71(47.24±4.34)歲,男120例,女92例。所有研究對象入組前均簽署知情同意書,且該研究已獲得倫理委員會批準。
納入標準:① 符合NVG診斷標準[7],患者屈光間質尚清晰,且存在部分視功能;② 局部降壓藥物治療效果欠佳,并且同意接受睫狀體冷凝術、玻璃體腔注射康柏西普聯合PRP治療,同意NVG的相關檢查,且隨訪大于3個月。排除標準:① 有血栓史,合并嚴重系統性疾病,手術治療依從性較差;② 伴隨嚴重白內障者,玻璃體增殖、積血導致無法行手術治療者。
1.2 治療方法聯合組采用玻璃體腔注射康柏西普聯合PRP治療,具體過程如下:于術前3 d開始使用抗生素滴眼液,常規消毒鋪巾,沖洗患者眼結膜囊,鹽酸丙美卡因滴眼液進行麻醉后于角膜后緣3.50 mm處睫狀體平坦部垂直進針,緩慢將0.05 ml康柏西普(成都康弘生物科技有限公司;0.2 ml/支;批號:20170430)注射入玻璃體內,拔出針頭后立即使用棉簽輕按穿刺孔以避免藥液反流。根據眼底情況擇時開展PRP術治療,選用532 nm激光,光斑直徑(250±50) μm,設置曝光時間約0.2 s,每兩個光斑間隔0.5個光斑,功率100~300 mW,3~4次完成,每次間隔1周,每次光凝700~800點。對照組術前開展手術相關檢查后便行傳統的睫狀體冷凝術,取仰臥位,依次行消毒、麻醉、開瞼操作,選用2.5 mm冷凝頭,于角膜緣后1.0 mm處9:00~3:00 180°范圍冷凝,設置溫度為-70 ℃,6~8個/排,共2排,保持每個點的冷凍時間為30~60 s即可。兩組患者治療后均隨訪3個月。
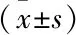
表1 對照組和聯合組一般指標比較

表2 NVG發生的獨立危險因素分析
1.3 觀察指標治療后3個月進行療效評估[7]:分為顯效、有效、無效,其中顯效表明患者眼壓(8~21 mmHg)恢復正常,角膜透明,無眼痛、頭痛等癥狀;有效表明患者眼壓(22~30 mmHg)改善,無眼痛、頭痛等癥狀,角膜基本透明;無效表明眼壓無變化,角膜水腫,存在眼痛、頭痛等癥狀。總有效率=(顯效+有數)/總例數×100%。治療后觀察患者虹膜新生血管消退,記錄新生血管消退時間,并隨訪3個月,統計新生血管復發情況。
2組患者于治療前以及治療后1周、2周、1個月、2個月、3個月采用TX- 20型非接觸型眼壓計(上海斯歐醫療器械有限公司)測定眼壓,并采用國際標準視力表檢測治療前以及治療后1個月、3個月最佳矯正視力(best-corrected visual acuity, BCVA)水平。
于術前、術后1個月清晨空腹抽取肘靜脈血約4 ml,室溫靜置1 h后離心取上清液,采用酶聯免疫吸附法檢測血清血小板源性生長因子-C(platelet derived growth factor-C, PDGF-C)、血管內皮生長因子(vascular endothelial growth factor, VEGF)、腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)、白細胞介素6(interleukin 6, IL-6)。

2 結果
2.1 一般指標比較聯合組患者血清PDGF-C、VEGF、TNF-α、IL-6水平均高于對照組(P<0.05),見表1。
2.2 NVG發生的獨立危險因素分析以患者血清PDGF-C、VEGF、TNF-α、IL-6水平為自變量,logistics回歸分析顯示血清PDGF-C、VEGF、TNF-α、IL-6水平均是NVG發生的獨立危險因素(P<0.05),見表2。
2.3 治療效果比較聯合組患者治療總有效率高于對照組,而消退時間短于對照組(P<0.05),2組患者復發率差異無統計學意義(P>0.05),見表3。

表3 治療效果比較

表4 不同時點眼壓水平變化情況
2.4 不同時點眼壓水平變化情況2組患者眼壓水平組間、各時間點比較差異有統計學意義,經治療后眼壓均降低,其中聯合組治療后2周可恢復至正常水平,而對照組治療后2周~1個月恢復正常水平,且治療后2個月、3個月眼壓仍處于降低趨勢,2組患者治療后眼壓差異有統計學意義(P<0.05),見表4。
2.5 不同時點BCVA變化情況2組患者BCVA組間、各時間點比較有統計學意義,經治療后BCVA均增加,其中聯合組治療后各時間點的BCVA均高于對照組(P<0.05),見表5。
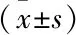
表5 不同時點BCVA變化情況
2.6 炎性、血管新生相關因子水平比較治療后2組患者血清PDGF-C、VEGF、TNF-α、IL-6水平均降低,其中聯合組治療后1個月的各指標水平均低于對照組(P<0.05),見表6。
3 討論
常規青光眼手術以及藥物治療因難以控制眼壓而容易發生愈后不良,嚴重影響生活質量[8]。臨床研究[5]發現若NVG進入晚期則會出現角膜嚴重霧樣水腫、眼壓持續升高等癥狀,同時眼部炎癥充血狀態以及房角虹膜分布密集新生血管則進一步增加手術失敗風險。血管新生以及炎癥相關因子在NVG的發生過程中發揮重要作用,其中血管新生因子如PDGF、VEGF可促使血管新生,進而覆蓋虹膜和前房角,導致房角周邊粘連、關閉等,從而引發青光眼[9],而炎性因子如TNF-α、IL-6可作用于微血管系統,引起中性粒細胞大量聚集以及毛細血管腔狹窄,增加眼壓,同時還可引起局部組織缺血缺氧,誘導眼內組織釋放PDGF、VEGF,刺激血管新生[6]。通過logistics回歸分析進一步證實血清PDGF-C、VEGF、TNF-α、IL-6水平均是NVG發生的獨立危險因素。張鵬 等[10]認為眼內高水平VEGF是增生型糖尿病視網膜病變玻璃體切割手術后發生NVG的危險因素,術前使用抗VEGF藥物可有效降低NVG風險。牛潔[11]研究發現NVG患者房水、血清中的TNF-α、IL-6均處于高水平表達狀態,其中TNF-α可促進 IL-6、VEGF的表達,3者相互作用從而引起視網膜內皮細胞增生,刺激視網膜、虹膜等的血管新生,因此可通過血清因子水平變化反映治療效果。
康柏西普是近年來常用的抗VEGF的蛋白藥物,可抑制VEGF介導的信號傳遞,抑制血管內皮細胞增殖以及病變血管新生等[12]。本研究顯示聯合組采用玻璃體腔注射康柏西普聯合PRP治療后總有效率高于對照組,分析認為玻璃體內注射康柏西普可有效降低房水中VEGF水平,阻斷新生血管的生長,改善血管滲漏狀況,從而降低眼壓,還可清除積血,增加屈光間質清晰度和視網膜的可視度[13],使得聯合組患者治療后3個月BCVA明顯增加,視力、眼壓顯著改善。同時研究顯示經治療后兩組患者血清PDGF-C、VEGF、TNF-α、IL-6水平均顯著降低,其中聯合組治療后1個月的各指標水平均低于對照組(P<0.05),提示玻璃體內注射康柏西普+PRP在抑制血管新生、炎癥反應等方面優勢顯著。眼內注射康柏西普可直接迅速抑制VEGF過度表達以及阻斷血管新生,PRP則是通過激光破壞視網膜外層的高耗氧細胞從而有效降低視網膜需氧量,進而改善缺氧狀態,降低對VEGF的刺激作用,從源頭和過程降低對VEGF的促進作用。Chen et al[14]研究認為房水中VEGF水平與眼壓、新生血管化程度存在相關性,而血清與房水中的VEGF水平同樣處于正相關性。IL-6與VEGF特征類似,可由缺氧狀態刺激表達,還可作為炎性因子加重局部組織缺血缺氧狀態,誘導炎性細胞向局部趨化,刺激活性氧代謝物或TNF-α的生成,引起組織損傷等。經治療后患者高眼壓恢復正常狀態使得眼內局部微環境恢復至穩定狀態,眾多細胞因子構成的網絡平衡再次恢復,故而炎癥介質也逐步降低至正常水平[15]。當然本次實驗納入病例有限,未能對NVG患者的原發病進一步分析,如糖尿病也會引起血清因子的水平的變化,因此需擴大樣本量進一步分析。
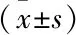
表6 炎性、血管新生相關因子水平比較

