榨菜發酵過程中原核微生物群落結構及其理化因子的動態演替
吳曉紅,高生平,蔣彩云,王清政
1(江蘇經貿職業技術學院,江蘇 南京,211168) 2(南京工業大學 浦江學院,江蘇 南京,211134)
榨菜是我國主要的腌制加工蔬菜,是世界三大醬腌菜之一,通常作為配菜或開胃菜。榨菜的傳統制作工藝用鹽量高,抑制了高品質的乳酸菌活性,同時對產品的風味、營養及安全性等品質產生諸多不良影響[1-2]。而低鹽腌制榨菜不僅可以改善榨菜的品質、安全性及營養價值,同時也符合當今世界蔬菜腌制向營養、天然和綠色方向發展的趨勢[3]。
近年來,分子生物學免培養技術被廣泛用于研究傳統釀造食品的微生物群落組成。LIANG等[4]采用高通量測序技術發現乳酸菌是榨菜發酵過程中最為重要的微生物之一,呈先迅速增加后維持穩定的變化趨勢,且在前期以明串珠菌屬(Leuconostoc)和魏斯氏菌屬(Weissella)為主,中期以乳桿菌屬(Lactobacillus)為主,而后期則以乳桿菌屬和片球菌屬(Pediococcus)為主。此外,張銳等[5]利用單鏈構象多態性技術發現腸膜明串珠菌(Leuconostocmesenteroides)為榨菜發酵初期的優勢茵種,隨著發酵環境條件的變化,乳桿菌屬為榨菜發酵中后期的優勢茵群。乳酸菌可能來源于發酵原料和自然環境,其可將原料中的小分子糖類物質轉化為酸類化合物,從而賦予榨菜柔和的酸感;部分糖類物質可被轉化為醇類化合物,這些醇類物質和酸類代謝物反應形成酯類物質,進而賦予產品具有酯香和醇香的特征[6]。乳酸菌通過蛋白水解系統將發酵基質中的可溶性蛋白分解成短肽和氨基酸等小分子代謝產物,從而賦予產品獨特的鮮味特征[7]。目前,很多乳酸菌,如腸膜明串珠菌、短乳桿菌和植物乳桿菌,已被用作發酵劑,以加快榨菜的發酵過程,提高產品品質[8-10]。
本研究采用16S rRNA高通量測序技術全面解析榨菜發酵過程中原核微生物群落的演替規律,并基于冗余分析探究影響微生物菌群變化的理化因素,以期揭示榨菜發酵過程不同時期原核微生物群落形成原因。
1 材料與方法
1.1 材料與試劑
樣品:取四川省某調味品有限公司2個不同發酵池發酵1、7、14、21、35、50、65和80 d的榨菜發酵液,將每個發酵池的發酵液分為2份,于-20 ℃下貯藏,1份用于理化指標分析,1份用于DNA提取。
試劑:NaOH、酚酞、鄰苯二甲酸氫鉀、鹽酸萘乙二胺等(分析純),國藥集團化學試劑有限公司;乳酸、丙酮酸、檸檬酸、蘋果酸、乙酸、酒石酸、琥珀酸、草酸等(色譜純),上海阿拉丁生化科技股份有限公司;E.Z.N.A.?水樣DNA 提取試劑盒,美國Omega公司。
1.2 儀器與設備
紫外可見分光光度計(UV BlueStar A),北京萊伯泰科儀器股份有限公司;pH計(PB-10),德國Sartorius公司;高速冷凍離心機(TGL-20M),上海盧湘儀離心機儀器有限公司;高效液相色譜儀(1260),美國Agilent公司。
1.3 實驗方法
1.3.1 理化性質分析
用pH計測定酸菜發酵液樣品的pH;使用滴定法測定總酸含量[11];采用菲林試劑滴定法測定還原糖含量[12];采用鹽酸萘乙二胺法測定亞硝酸鹽含量[13]。
采用高效液相色譜儀檢測有機酸含量。取適量酸菜發酵液,加入等體積的硫酸鋅和亞鐵氰化鉀,搖勻,10 000 r/min離心20 min,保留上清液過0.45 μm水系濾膜后待用。色譜條件:進樣量10 μL;流動相為0.02 mol/L的NaH2PO4溶液;柱流速 0.7 mL/min;檢測波長210 nm;柱溫30 ℃[14]。
1.3.2 DNA提取與Illumina高通量測序
使用DNA 提取試劑盒對發酵液樣品進行總DNA提取。使用Qubit 2.0熒光定量儀測定其溶度和純度。將合格的DNA委托南京諾唯贊生物科技有限公司完成建庫及Illumina Miseq 雙端測序。其中16S rDNA擴增子引物對為338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),擴增區域為16S rDNA擴增子的V3~V4區。
1.3.3 測序數據處理與統計學分析
采用FLASH軟件[15]對測序的原始數據進行拼接,利用QIIME軟件[16]對低質量的拼接序列進行過濾,使用UCHIME軟件[17]去除嵌合體,得到優質序列。根據UCLUST軟件[18]在相似性97%的水平上對優質序列進行聚類,得到各可操作分類單元(operational taxonomic unit, OTU),以各OTU中豐度最高的序列作為代表序列。在80%置信水平下,通過Silva 132數據庫[19]對OTU進行分類學注釋,將藍藻門和不能注釋到門水平的OTU刪除。基于OTU得到分析結果,采用隨機抽平的方法,利用QIIME軟件[16]對樣品進行多樣性分析。基于OTU的主坐標分析、樣本聚類分析、Venn圖繪制、熱圖繪制、冗余分析均通過R軟件實現。
2 結果與討論
2.1 榨菜發酵過程中理化因子變化
如圖1所示,隨著發酵的啟動,榨菜發酵液的pH值在發酵1~35 d內迅速降低,從pH 6.31下降至pH 3.78;此后,pH值隨發酵時間的延長而緩慢下降,于發酵80 d穩定在pH 3.61,其結果與杜書等[7]研究結果相似。此外,總酸含量則與pH值的變化呈相反的趨勢,在整個發酵過程中持續上升,于發酵65 d達到穩定,其含量為10.81 g/L。酸性環境不僅會影響不耐酸的微生物生長繁殖,還可促進部分抗酸微生物的繁殖,導致總酸含量持續增加,賦予榨菜具有柔和的酸味[6]。

圖1 榨菜發酵過程中pH、總酸含量、還原糖含量及 亞硝酸鹽含量的動態變化Fig.1 Dynamic changes of pH and the contents of total acid, reducing sugar and nitrite during the fermentation of Zhacai
還原糖是微生物生長繁殖主要的能源物質之一,而榨菜發酵是將原料中的還原糖生成醇、酸和酯等風味物質的過程。由圖1可知,還原糖含量的變化趨勢與pH值的變化相一致,在整個發酵過程中持續下降。發酵1~35 d,還原糖含量快速降低;隨后還原糖含量隨發酵的持續進行而緩慢降低,于發酵65 d達到穩定,維持在0.5 g/L左右。說明較高的還原糖含量可使微生物大量繁殖,將還原糖轉化為酸、醇和酯等風味物質[20]。發酵原料及發酵器具中含有的腸桿菌科、假單胞菌屬和黃桿菌屬等革蘭氏陰性菌會分泌硝酸還原酶,可將植物體內的硝酸鹽轉變為亞硝酸鹽[21]。榨菜發酵液中亞硝酸鹽含量在整個發酵過程中呈先升后降的趨勢,于發酵14 d達到最大值,為53.16 mg/L,50~80 d達到穩定,含量維持在2.31~2.53 mg/L,遠低于國標規定泡菜中的亞硝酸鹽含量為20 mg/kg的限量標準[22]。
有機酸不僅是榨菜發酵主要的呈味物質,也是指示發酵進程的一個重要指標。由圖2可知,在榨菜發酵過程中檢測到8種有機酸,分別為草酸、酒石酸、蘋果酸、乳酸、乙酸、檸檬酸、琥珀酸和丙酮酸,并監測其在整個發酵過程中的動態變化。在發酵1 d時,草酸、乙酸、檸檬酸、琥珀酸和丙酮酸是主要的有機酸,占整個有機酸的97%,但隨著發酵的不斷進行,除丙酮酸外其他 4種有機酸的含量均在逐漸增加,在發酵80 d時可分別達到0.88、0.73、1.31和0.26 g/L。此外,乳酸、蘋果酸和酒石酸的含量在整個發酵過程也呈增加的趨勢,分別從0.006、0.01和0.001 g/L增加至7.25、1.17和0.25 g/L,其中乳酸含量的變化最顯著,增加了12 082倍之多。在發酵80 d時,乳酸含量占整個有機酸比例的60.79%,說明乳酸是影響榨菜口感的主要有機酸,且具有酸味柔和、濃厚等特征。
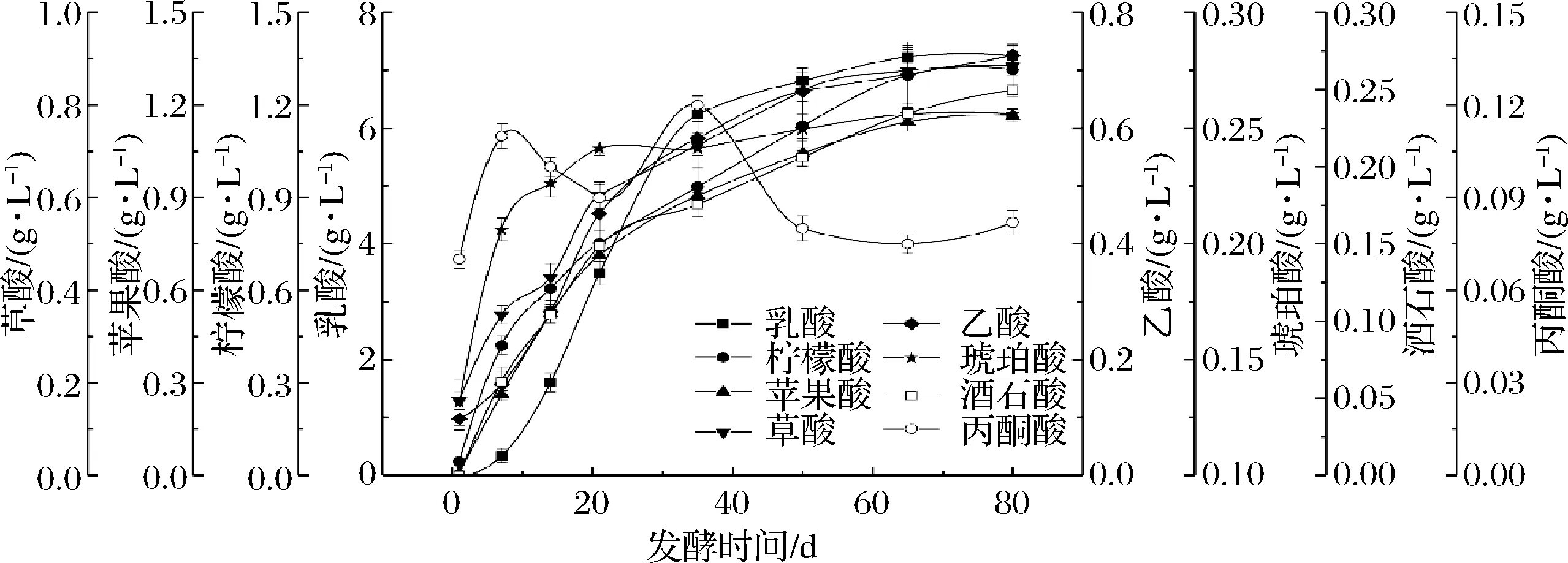
圖2 榨菜發酵過程中有機酸含量的動態變化Fig.2 Dynamic changes of organic acid contents during the fermentation of Zhacai
2.2 榨菜發酵過程中原核微生物群落α多樣性分析
如圖3所示,當測序深度超過10 000條時,稀釋曲線進入平臺期。由于本研究測序深度(≥33 798條)遠大于10 000條且覆蓋率均超過97%(表1),說明本次測序深度足夠覆蓋整個榨菜發酵的群落,從而獲得絕大多數微生物信息。
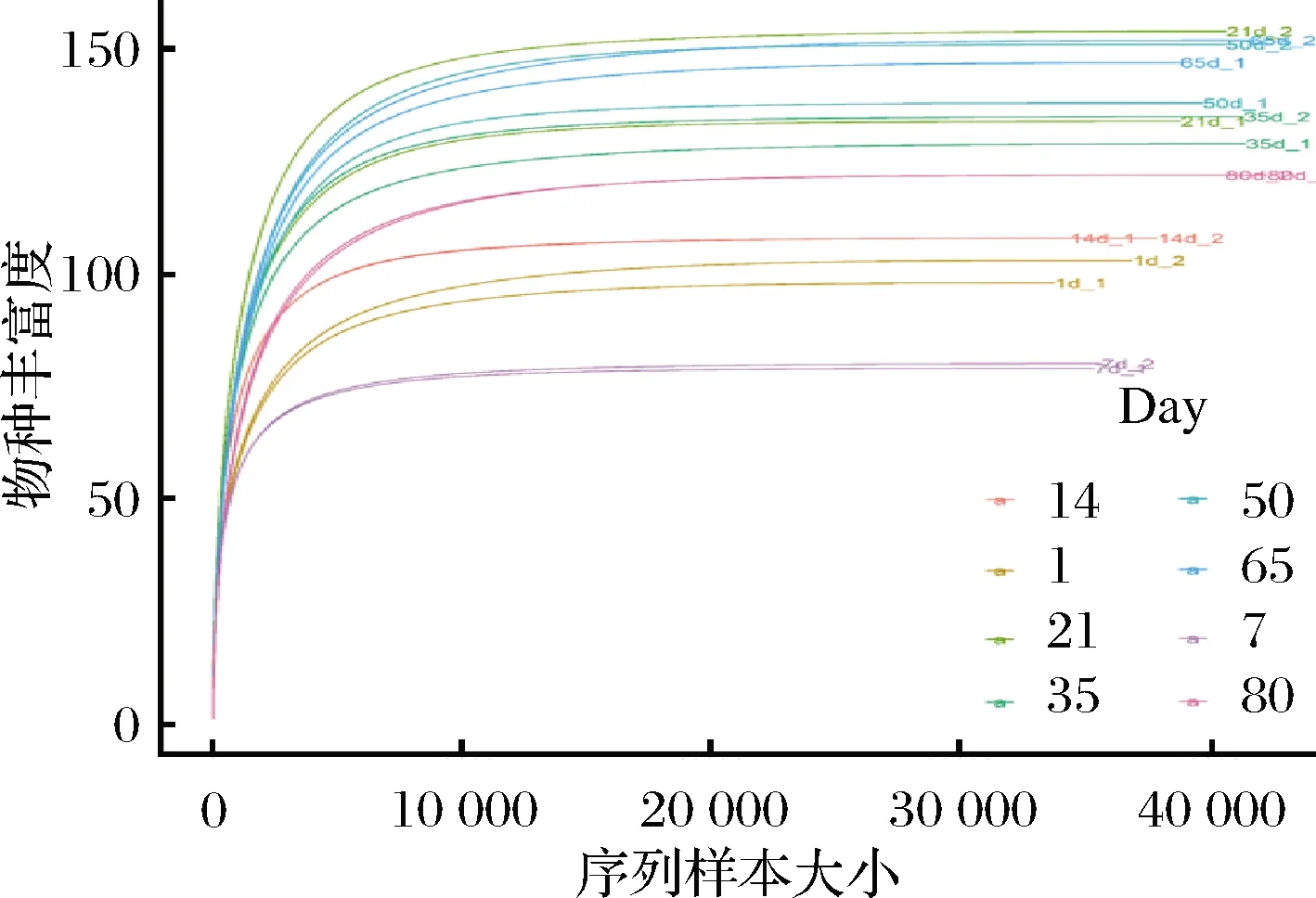
圖3 基于榨菜微生物群落OTUs 觀察的稀釋曲線Fig.3 Rarefaction curves of Zhacai microbial communities based on observed OTUs 注:不同顏色的曲線代表不同的發酵時間;同一顏色的曲線分別代表 兩個不同發酵池的樣品,_1代表發酵池1,_2代表發酵池2(下同)
由表1可知,利用Illumina Miseq高通量測序技術可得到620 685條優質序列,平均33 798~42 358條/樣本。根據樣本的最低序列數對所有樣本進行抽平,并進行后續分析。通過OTU聚類(97%相似度)后可得到364個OTU,OTU平均91~151個/樣本。Shannon指數、Simpson指數和Pielou指數是評價群落多樣性、豐富度和均勻度的常用指數。在整個發酵過程中,樣品中原核微生物群落的Shannon指數、Simpson指數和Pielou指數均呈先增后降的變化趨勢,且都在發酵14 d時達到最大,分別為3.04、0.92和0.65,說明該發酵時間的群落多樣性和均勻度最高。上述結果說明發酵原料、器具及環境中的原核微生物可快速適應低鹽和低酸的發酵環境,從而迅速生長繁殖,搶占有利生態位。隨著發酵的不斷進行,發酵環境逐漸酸化,pH不斷減低,樣品中原核微生物群落的Shannon指數、Simpson指數和Pielou指數均逐漸下降。
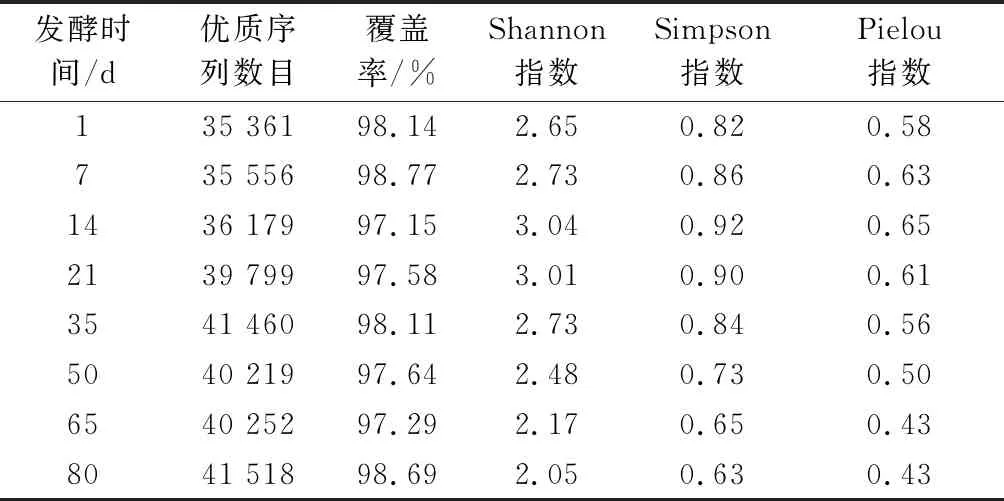
表1 榨菜發酵過程中原核微生物群落序列 數量和α多樣性參數Table 1 Sequence numbers and α-diversity indices of prokaryotic microbial communities during the fermentation of Zhacai
這種現象主要是與榨菜發酵環境有關,由于pH和總酸是影響釀造原核微生物群落α多樣性(Shannon指數、Simpson指數和Pielou指數)的主要因素,pH和總酸會顯著影響微生物群落結構,從而改變群落α多樣性[23]。說明酸性環境會抑制大部分微生物的生長繁殖,但不會影響某些耐酸微生物的生長繁殖,這些耐酸微生物在群落中的比例逐漸增大,從而造成微生物多樣性和均勻度的下降。本研究中的榨菜發酵液的pH從6.31下降至3.61、總酸從0.4 g/L增加至10.81 g/L,這可能是導致不同發酵時間原核微生物群落α多樣性差異的主要原因。
2.3 榨菜發酵過程中原核微生物群落β多樣性分析
基于OTU組成對16個榨菜發酵液樣品進行層次聚類分析。如圖4所示,這些榨菜發酵液樣品被劃為2個簇,發酵1~7 d的樣品單獨聚為1簇(Ⅰ),其他發酵時間的樣品聚為另一簇(Ⅱ);第Ⅱ簇又可以分為兩個亞簇,發酵14~35 d的樣品聚在第ⅰ亞簇,發酵50~80 d的樣品聚在第ⅱ亞簇,故可將整個榨菜發酵分為3個不同的階段,分別為發酵前期、發酵中期和發酵后期。上述結果表明不同發酵時間的發酵液樣品中原核微生物群落呈現出顯著的時間異質性。這可能是由于發酵環境逐漸酸化(圖1),LIU等[24]研究結果表明總酸會顯著影響泡菜發酵過程中微生物群落結構。此外,還發現2個不同發酵池的原核微生物群落變化具有一致性,說明榨菜發酵具備較強的批次穩定性。只有穩定的微生物群落變化才能造就產品口感、品質及功能的穩定。因此,進一步解析不同發酵時間的榨菜發酵液樣品中原核微生物群落組成有助于深入揭示榨菜微生物群落時間異質性的形成原因。
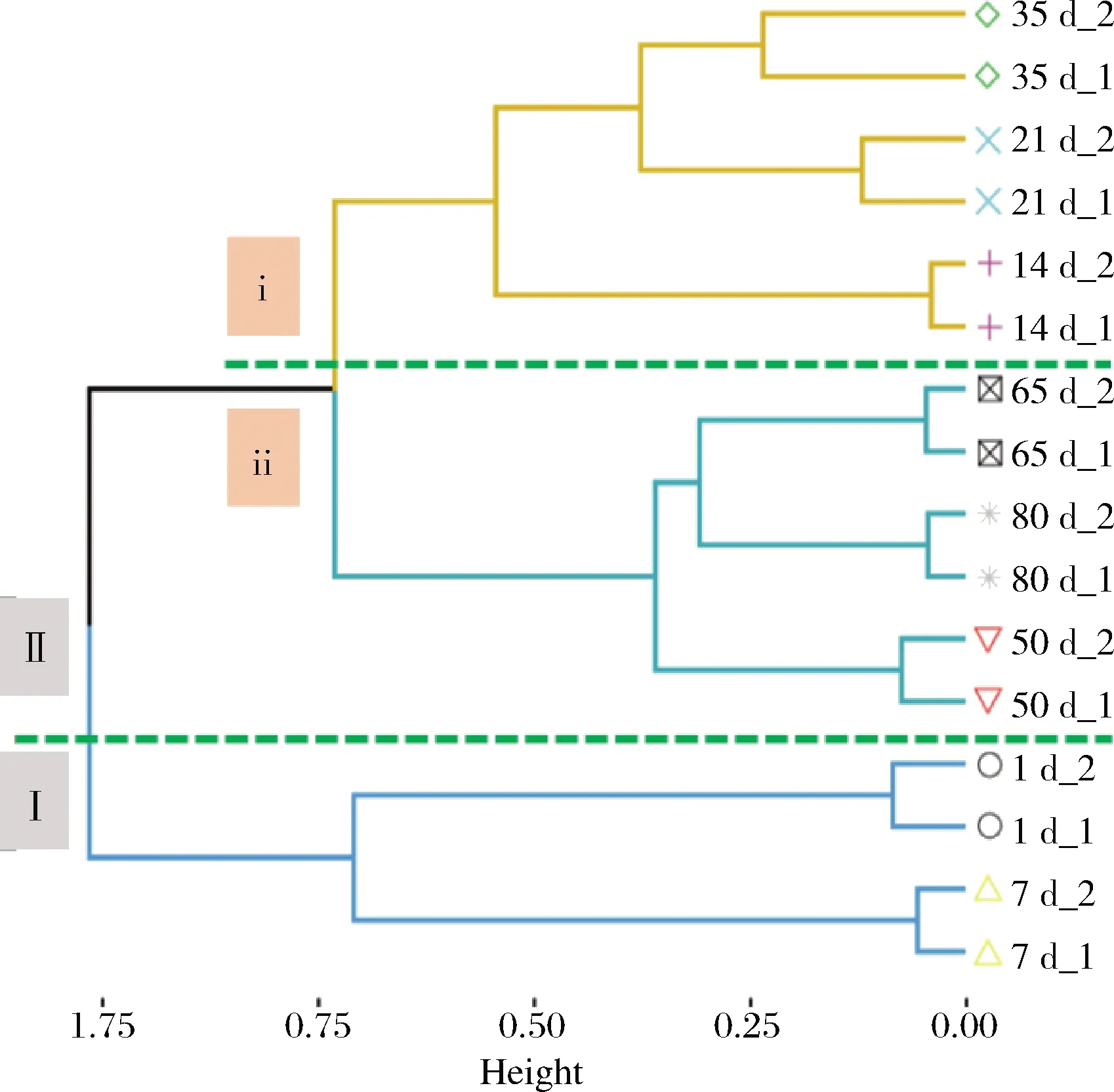
圖4 榨菜發酵過程中不同發酵時間樣品的層次聚類Fig.4 Hierarchical clustering of samples with different fermentation time during the fermentation of Zhacai
2.4 榨菜發酵過程中原核微生物群落結構和演替分析
線經OTU注釋,所有樣品中共檢測到12個可鑒定門。如圖5所示,4個優勢菌門(至少在2個樣品中相對豐度 > 1%的門),占每個樣品總相對豐度的99%以上。在整個發酵過程中,變形菌門(Proteobacteria)和擬桿菌門(Bacteroidetes)的平均相對豐度持續降低,分別從74.49%和4.33%降低至6.01%和0.37%;而厚壁菌門(Firmicutes)的平均相對豐度持續升高,從15.59%升高至92.77%。結果說明厚壁菌門主導了榨菜發酵的成熟。
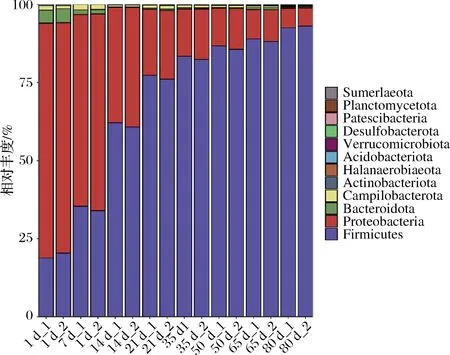
圖5 榨菜發酵過程中原核微生物群落在門水平的演替Fig.5 Succession of prokaryotic microbial communities in samples at phylum level during the fermentation of Zhacai
所有樣品中共檢測到134個屬,其中發酵7 d的樣品屬水平微生物數量最少(28個),發酵50 d的樣品屬水平微生物數量最多(77個)。柱狀圖進一步展示了19個優勢屬在榨菜發酵過程中的動態變化。由圖6可知,檸檬酸桿菌屬(Citrobacter)、Cobetia、腸桿菌屬(Enterobacter)、假單胞菌屬(Pseudomonas)、鞘氨醇桿菌屬(Sphingobacterium)和魏斯氏菌屬(Weissella)主要在發酵1 d樣品中富集,隨著發酵的不斷進行,這些微生物的平均相對豐度逐漸降低。其中假單胞菌屬在發酵1 d的平均相對豐度可達39%之高,而腸桿菌屬的平均相對豐度為1%左右,說明假單胞菌屬和腸桿菌屬存在于新鮮蔬菜和發酵器具中,生存能力強,適應環境范圍廣[25]。正是由于這些具有硝酸還原酶的革蘭氏陰性菌存在,導致榨菜發酵前期亞硝酸鹽含量增加。此外,明串珠菌屬(Leuconostoc)在發酵1 d的平均相對豐度可達3.61%,其在整個發酵過程中呈先增后降的變化趨勢,與張銳等[5]研究結果相一致,說明明串珠菌屬是附著在新鮮榨菜上的主要乳酸菌。在低鹽的環境下,榨菜表面滲出的汁液非常適合明串珠菌屬的生長繁殖,其產生的CO2和酸使pH迅速下降,從而阻止其他有害微生物的生長繁殖[5]。同時,明串珠菌屬可將多余的糖轉化為甘露醇和葡聚糖,而這2種物質非常適合乳酸菌的發酵[26]。明串珠菌屬的生長繁殖可迅速改變發酵環境,更適宜其他乳酸菌按一定的順序生長,從而起到發酵啟動劑的作用[5]。不動桿菌屬(Acinetobacter)、乳球菌屬(Lactococcus)、嗜冷桿菌屬(Psychrobacter)、鹽弧菌屬(Salinivibrio)和弧菌屬(Vibrio)的平均相對豐度的變化趨勢和明串珠菌屬的變化相一致。其中乳球菌屬在發酵35 d的平均相對豐度最高,可達21.43%,說明乳球菌屬可在該發酵環境中迅速生長繁殖,占領足夠多的生態位,且可與明串珠菌屬互利共生。此外,芽孢桿菌屬(Bacillus)、鹽單胞菌屬(Halomonas)、乳桿菌屬(Lactobacillus)、Oceanobacillus、片球菌屬(Pediococcus)和四聯球菌屬(Tetragenococcus)的平均相對豐度在整個發酵過程中持續增加,尤其是乳桿菌屬的平均相對豐度從0.92%增加至74.77%,說明乳桿菌屬對榨菜發酵起著主導作用,且這些微生物均可以和乳桿菌屬互利共生。鹽單胞菌屬和片球菌屬具有耐鹽的特性,能分解葡萄糖,產生多種風味物質,推測具存在與生產泡菜“鹽漬”這一步驟有關[27]。四聯球菌屬廣泛存在與含鹽的腌制類發酵食品中,可參與氨基酸的合成及生成醛、醇、酮和酯等揮發性風味物質,從而提升發酵食品的風味和口感[28]。
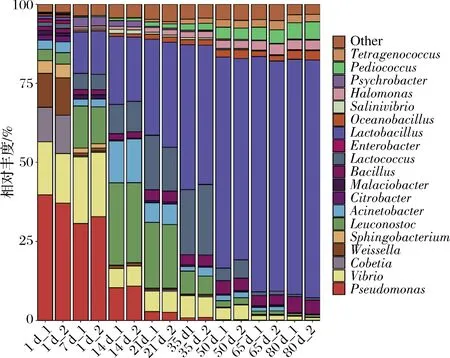
圖6 榨菜發酵過程中原核微生物群落在屬水平的演替Fig.6 Succession of prokaryotic microbial communities in samples at genus level during the fermentation of Zhacai
由圖7可知,整個發酵過程中共有的OTU數為78個,但隨著發酵的不斷進行,不同發酵階段之間的共有微生物和特有微生物的數量逐漸增加,彰顯榨菜發酵過程中微生物群落結構的復雜性和特殊性。上述結果說明有些微生物只能在特定的環境下才能激活其生長繁殖,而在其他環境下處于休眠的狀態。
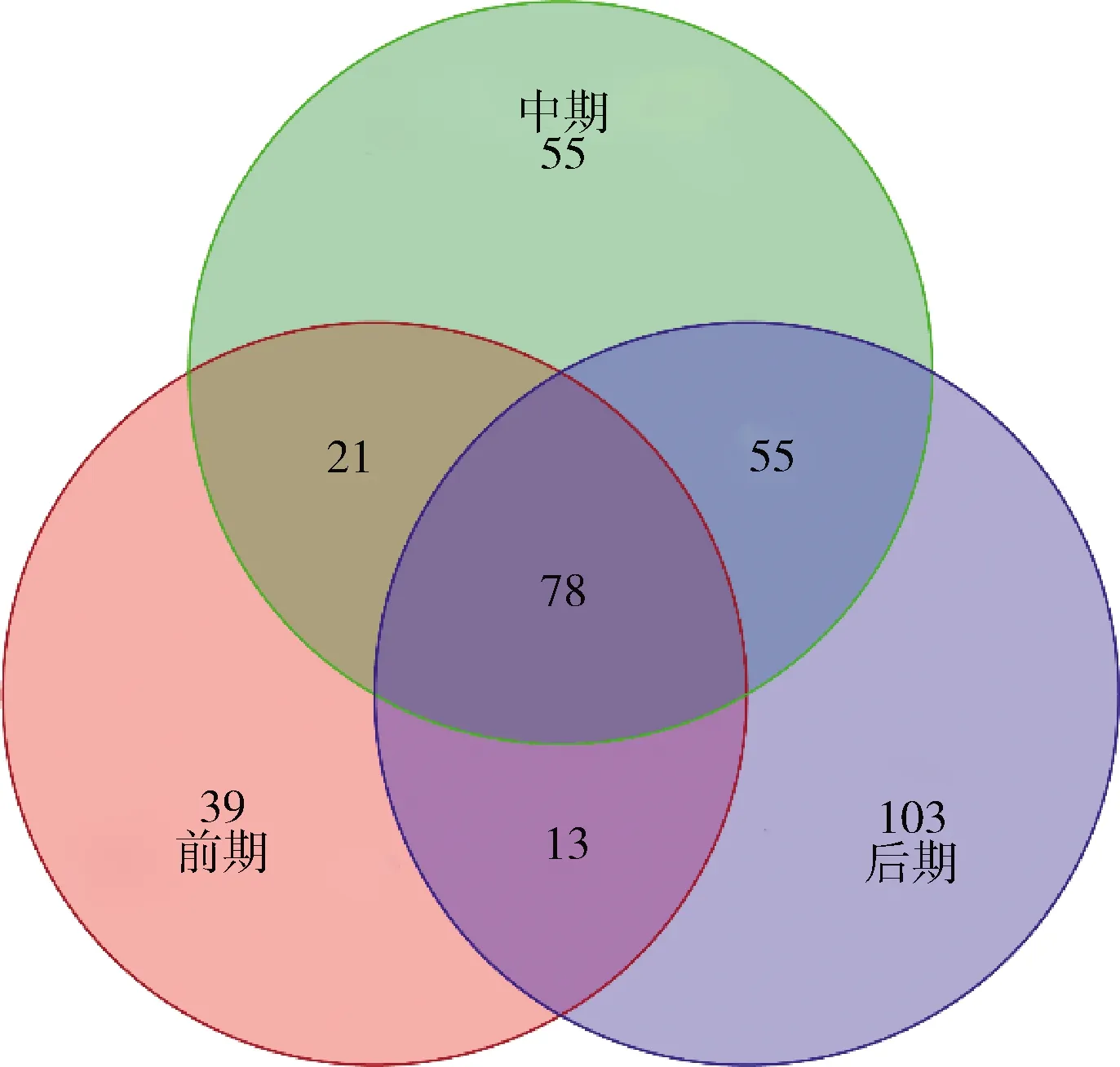
圖7 榨菜發酵過程中不同發酵階段的原核微生物群 落在OTU水平的Venn圖Fig.7 Venn diagram of prokaryotic microbial communities in samples of different fermentation stages at OTU level during the fermentation of Zhacai
2.5 榨菜發酵過程中不同發酵階段標志性微生物分析
線性判別分析效應大小(linear discriminant analysis effect size,LEfSe)是一種用于發現和解釋高維度數據生物標識的分析工具,用于發現不同生物條件或環境下的多組樣本中最能解釋組間差異的物種特征,以及這些特征對組間差異的影響程度。因此,使用LEfSe分析鑒定出不同發酵階段的標志性微生物。由圖8可知,發酵前期的樣品中標志性微生物有5個,分別來自鞘氨醇桿菌屬、魏斯氏菌屬、Cobetia、弧菌屬和假單胞菌屬;發酵中期的樣品中標志性微生物也有5個,分別來自氣微菌屬(Aeromicrobium)、上地桿菌屬(Pedobacter)、明串珠菌屬、乳球菌屬和不動桿菌屬;而發酵后期的樣品中標志性微生物同樣也有5個,分別來自芽孢桿菌屬、四聯球菌屬、乳桿菌屬、片球菌屬和鹽單胞菌屬。這些標志性微生物的鑒定結果與圖6中的變化規律一致。
2.6 榨菜發酵過程中理化因子與原核微生物群落的冗余分析
根據冗余分析可將19個優勢屬大致分為3個類群(圖9-a陰影區域),每個類群對應不同發酵階段的榨菜發酵液樣品(圖9-b)。結合圖6和圖8發現每個類群在其對應發酵階段中的相對豐度最高,如圖9-a中藍色陰影區域的8個屬的相對豐度在發酵前期最高;黃色陰影區域的5個屬的相對豐度則在發酵中期最高;紫色陰影區域的6個屬的相對豐度則在發酵后期最高。榨菜發酵過程中理化因子對優勢屬菌群結構的總解釋貢獻度為91.23%(圖9),其中RDA1軸的貢獻度為72.67%,可將發酵前期和發酵后期這2個階段的樣品較好的區分開;RDA2軸的貢獻度為18.56%,可將發酵中期與其他兩個階段的樣品較好的區分開。根據圖9-b可知,多個理化因子共同影響榨菜發酵過程中原核微生物的群落結構,如發酵前期的微生物群落與pH和還原糖呈正相關,與總酸和其它有機酸呈負相關;發酵中期的微生物群落與亞硝酸鹽、丙酮酸和琥珀酸呈正相關;而發酵后期的微生物群落與總酸和大部分有機酸呈正相關。
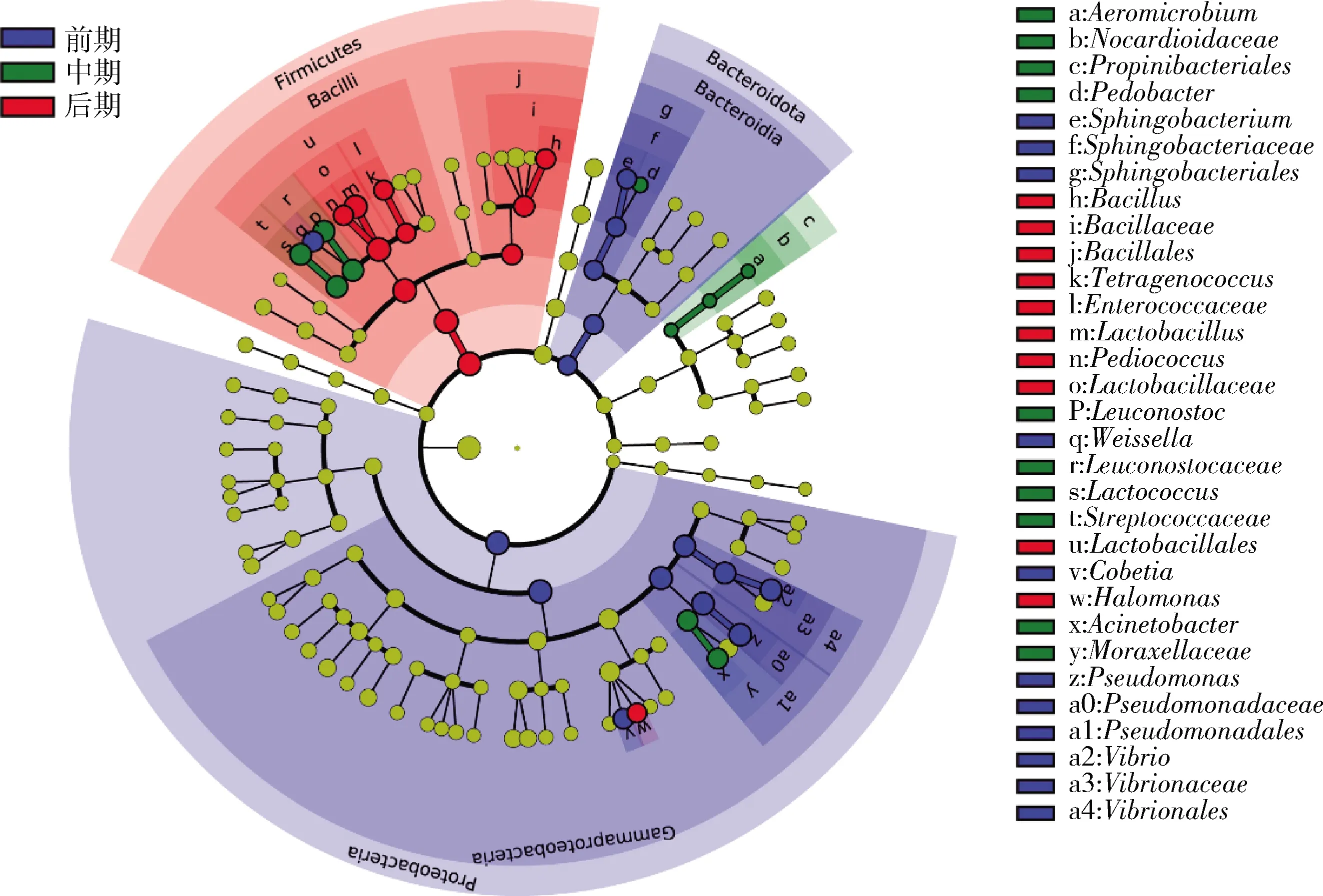
圖8 榨菜發酵過程中不同發酵階段生物標志性微生物的分析Fig.8 Analysis of biomarker microorganism in different fermentation stage during the fermentation of Zhacai
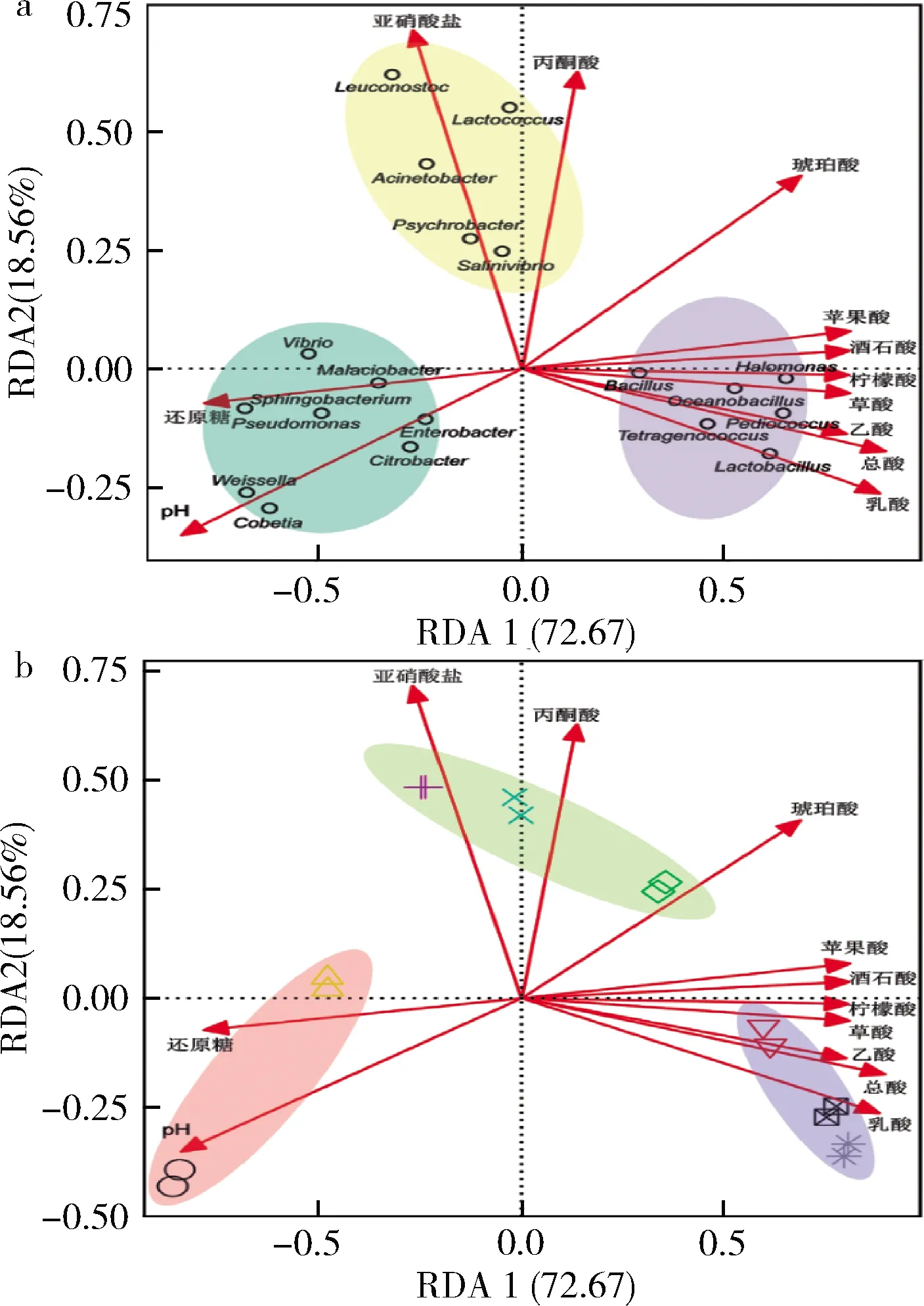
圖9 酸菜發酵過程中理化因子分別與優勢屬及 樣品的RDA關系圖Fig.9 Redundancy analysis between physicochemical factors and dominant genera and samples during the fermentation of Zhacai 注:a-不同顏色的陰影區域代表不同的類群;b-不同顏色的 陰影區域代表不同的發酵階段,與圖7和圖8的顏色標識相一致; 不同類型的符合代表不同發酵時間的樣品,與圖4中的標識相一致
利用條件限制分析揭示每個理化因子對榨菜發酵過程中原核微生物群落結構的影響程度,其中乳酸(9.55%)和pH(9.33%)對菌群的影響較大,其他理化因子均都在6%以上,說明多個理化因子共同決定榨菜發酵微生物群落的變化。此外,相關研究表明乳酸和乙酸與中國辣白菜的微生物群落進行呈顯著正相關[24]。綜上,榨菜發酵過程中原核微生物群落受多種理化因子的共同影響,這些理化因子共同驅動了群落結構的穩定,從而保證榨菜的品質和口感。
3 結論
本研究利用16S rRNA高通量測序技術揭示榨菜發酵過程中原核微生物群落的組成和演替規律,同時分析發酵過程中理化因子的變化。隨發酵的不斷進行,pH和還原糖含量下降,總酸含量上升,而亞硝酸鹽含量呈先增后減的變化趨勢。乳酸是其主要的有機酸,占總有機酸的60%之多。原核微生物群落的多樣性和均勻性均呈先增后降的變化趨勢。根據微生物群落的信息,可將發酵過程分為3個不同的階段,且每個階段的標志性微生物均不同。乳桿菌屬是發酵過程中處于絕對優勢微生物,其相對豐度從0.92%增加至74.77%。此外,冗余分析表明:發酵初期的群落與pH及還原糖含量呈正相關;發酵中期的群落與亞硝酸鹽、丙酮酸和琥珀酸含量呈正相關;而發酵后期的群落與總酸和其他有機酸含量呈正相關。本研究為進一步精確人工調控提供理論依據和篩選特性菌種提供了參考。

