玉米蛋白水解物免疫活性的研究
高健,林巍,劉曉蘭,劉祥,鄭喜群,李冠龍
1(齊齊哈爾大學(xué) 食品與生物工程學(xué)院,黑龍江 齊齊哈爾,161006) 2(黑龍江省玉米深加工理論與技術(shù)重點(diǎn)實(shí)驗(yàn)室,黑龍江 齊齊哈爾,161006) 3(黑龍江八一農(nóng)墾大學(xué) 食品學(xué)院,黑龍江 大慶,163319)
隨著人類對食品功能性認(rèn)識(shí)的不斷深入,“食品”不僅僅是傳統(tǒng)意義上供人類食用或飲用以滿足人類果腹的物品,更承擔(dān)起改善人體亞健康、調(diào)節(jié)人體機(jī)能的作用。研究發(fā)現(xiàn),許多谷物蛋白來源的肽具有良好的免疫活性,不僅可以促進(jìn)淋巴細(xì)胞分化成熟、轉(zhuǎn)移免疫信息、增強(qiáng)機(jī)體免疫機(jī)能,還可以增強(qiáng)巨噬細(xì)胞吞噬能力,進(jìn)而提高機(jī)體抵御外界病原體感染的能力,降低機(jī)體發(fā)病率[1]。劉劍利等[2]研究發(fā)現(xiàn)小米多肽可以刺激小鼠的淋巴細(xì)胞轉(zhuǎn)化,且在灌胃劑量為500和1 000 mg/(kg·d)時(shí),半數(shù)溶血值(half hemolytic concentration,HC50)和巨噬細(xì)胞吞噬能力與對照組有顯著差異(P<0.01),表明小米多肽可以調(diào)節(jié)小鼠免疫能力;代卉等[3]發(fā)現(xiàn)小麥肽可以調(diào)節(jié)環(huán)磷酰胺致免疫抑制小鼠的免疫及抗氧化功能,發(fā)現(xiàn)100 mg/(kg·d)的小麥肽可以緩解免疫抑制小鼠應(yīng)激狀態(tài)所引起的機(jī)體抗氧化體系紊亂及免疫功能的降低,提高抗體生成細(xì)胞含量和腹腔巨噬細(xì)胞吞噬能力;刁靜靜等[4]研究發(fā)現(xiàn),小分子綠豆肽在質(zhì)量濃度為200 mg/mL時(shí)具有促進(jìn)巨噬細(xì)胞的增殖、上調(diào)巨噬細(xì)胞中細(xì)胞因子表達(dá)量等功能,免疫效果良好。
玉米蛋白粉是玉米濕法生產(chǎn)淀粉的副產(chǎn)物,其蛋白質(zhì)含量在60%以上,主要為醇溶蛋白(68%)[5],但水溶性差、氣味特殊等特點(diǎn)限制了其在食品領(lǐng)域的應(yīng)用。玉米蛋白的多肽鏈存在多個(gè)功能區(qū),具有抗氧化[6]、降血壓[7]、抗疲勞[8]、抗腫瘤[9]、促乙醇代謝及護(hù)肝[10]等多種生物活性,但目前關(guān)于玉米蛋白水解物(corn gluten hydrolysate,CGH)的研究主要集中于其抗氧化活性及護(hù)肝作用,其他活性研究尚需開展,尤其是其免疫調(diào)節(jié)活性。玉米蛋白粉含有豐富的疏水性氨基酸,且其水解物具有良好的抗氧化活性[11-13],而目前大量關(guān)于免疫活性的研究發(fā)現(xiàn),免疫活性物質(zhì)通常具有疏水性氨基酸[14],且同時(shí)有著很好的抗氧化活性。朱科學(xué)等[15]研究發(fā)現(xiàn),菠蘿蜜多糖可以提高正常小鼠脾淋巴細(xì)胞的抗氧化及免疫功能,可顯著促進(jìn)脾淋巴細(xì)胞抗腫瘤因子-α(tumor necrosis factor-α,TNF-α)、干擾素-γ(interferon-γ,IFN-γ)和白細(xì)胞介素-1β(interleukin-1β,IL-1β)的分泌;王君巧等[16]研究發(fā)現(xiàn),黑靈芝多糖可以拮抗環(huán)磷酰胺對小鼠免疫功能的抑制作用,提高TNF-α含量和IL-2含量,還可提高免疫抑制小鼠的抗氧化功能,提升脾組織中超氧化物歧化酶(superoxide dismutase,SOD)、過氧化氫酶(catalase,CAT)、總抗氧化能力(total antioxidant capacity,T-AOC)和降低丙二醛(malonic dialdehyde,MDA)含量;包曉瑋等[17]發(fā)現(xiàn)甜菜紅素對正常小鼠體內(nèi)抗氧化能力及免疫功能具有調(diào)節(jié)作用,可以提高小鼠血清中SOD、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)的含量,降低MDA的含量,還可以提高正常小鼠脾淋巴細(xì)胞增值能力、血清溶血素和自然殺傷(natural killer,NK)細(xì)胞活性。
本文以玉米蛋白粉為研究對象,預(yù)處理后通過雙酶分步水解獲得CGH,研究CGH體外脾淋巴細(xì)胞增殖活性,以及其對免疫抑制小鼠免疫調(diào)節(jié)作用的影響,為CGH在食品保健及醫(yī)藥領(lǐng)域的應(yīng)用和玉米蛋白粉的深入開發(fā)提供理論依據(jù)。
1 材料與方法
1.1 材料與試劑
玉米蛋白粉,黑龍江龍鳳玉米開發(fā)有限公司;α-淀粉酶,北京奧博星生物技術(shù)責(zé)任有限公司;復(fù)合蛋白酶、堿性蛋白酶,丹麥諾維信公司;RPMI-1640培養(yǎng)基,Gibico公司;胎牛血清,BI公司;二甲基亞砜(dimethyl sulfoxide DMSO)、紅細(xì)胞裂解液,索萊寶公司;刀豆球蛋白A(concanavalin,Con A),BBI公司;Hank’s液、3-(4,5-二甲基-2噻唑基)-2,5-二苯基四氮唑溴鹽(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT),上海生工生物工程有限公司;清潔級(jí)ICR小鼠(20±2)g,春億斯實(shí)驗(yàn)動(dòng)物技術(shù)有限責(zé)任公司[生產(chǎn)許可證為SCXK(吉)-2019-0004];環(huán)磷酰胺(cyclophosphamide,CTX),江蘇盛迪醫(yī)藥有限公司; SOD、GSH-Px、CAT、MDA、TNF-α、IFN-γ、IL-2和IL-6 ELISA試劑盒,上海江萊生物科技有限公司。
1.2 儀器與設(shè)備
PC/PLC-LD-53冷凍干燥機(jī),美國MILLROCK公司;TCL-16G型臺(tái)式離心機(jī),上海安亭科學(xué)儀器廠;CT15RE型高速冷凍離心機(jī),天美科學(xué)儀器有限公司;DF-1型集熱式磁力加熱攪拌器,江蘇省金壇市榮華儀器制造有限公司;SW-CJ-2FD超凈工作臺(tái),蘇州安泰公司;SX-500高溫蒸汽滅菌鍋,日本TOMY公司;DynamicaV 14R高速離心機(jī),澳大利亞Dynamica公司;EnSpire多功能酶標(biāo)儀,珀金埃爾默股份有限公司。
1.3 CGH制備
參考本課題組前期已經(jīng)確定的方法[18]。稱取一定量的去淀粉預(yù)處理后的玉米蛋白粉,用50 mmol/L pH 7.0的Tris-HCl緩沖液配制成質(zhì)量濃度為100 g/L的玉米蛋白懸浮液,用復(fù)合蛋白酶和堿性蛋白酶分步水解。復(fù)合蛋白酶[酶解條件:加酶量2.5%(質(zhì)量分?jǐn)?shù))、pH 7.0、溫度50 ℃]酶解3 h后用2 mol/L NaOH溶液調(diào)pH至8.5,加入堿性蛋白酶。堿性蛋白酶[酶解條件:加酶量2.5%(質(zhì)量分?jǐn)?shù))、pH 8.5、溫度60 ℃]酶解2.5 h后將酶解液于沸水中滅酶15 min,于3 000 r/min離心20 min,取上清液得到CGH。水解過程中使用1 mol/L NaOH溶液保持2種酶反應(yīng)體系pH的恒定。將得到的CGH進(jìn)行納濾脫鹽,冷凍干燥后備用。
1.4 體外培養(yǎng)脾淋巴細(xì)胞增殖實(shí)驗(yàn)
1.4.1 脾淋巴細(xì)胞懸液的制備
將正常飼喂的小鼠引頸處死后,用體積分?jǐn)?shù)為75%的乙醇浸泡10 min,將小鼠置于平皿中,在超凈臺(tái)上獲取脾臟,剪去脂肪和多余的筋膜,用鑷子將脾在盛有適量無菌Hank,s液的平皿中撕碎研磨,制成脾細(xì)胞懸液。200目篩網(wǎng)過濾后按照紅細(xì)胞裂解液說明書加入裂解液2~3次,每次室溫放置3 min后,1 000 r/min離心5 min去除紅細(xì)胞,得到單細(xì)胞懸液。將此細(xì)胞懸液用磷酸緩沖鹽溶液洗滌3次,每次1 000 r/min離心5 min,重懸于RPMI-1640完全培養(yǎng)基中,置于 37 ℃、5% CO2培養(yǎng)箱中,培養(yǎng)2 h,去除貼壁細(xì)胞后即為脾淋巴細(xì)胞懸液,臺(tái)盼藍(lán)染色計(jì)數(shù),活細(xì)胞數(shù)在95%以上。
1.4.2 體外脾淋巴細(xì)胞增殖的測定
制備密度為5×106個(gè)/mL脾淋巴細(xì)胞懸液,接種于96孔板中。設(shè)置對照孔(100 μL細(xì)胞懸液+100 μL RPMI-1640培養(yǎng)基)、Con A孔(100 μL細(xì)胞懸液+100 μL Con A RPMI-1640溶液,調(diào)整Con A終質(zhì)量濃度為5 μg/mL)、實(shí)驗(yàn)孔(100 μL細(xì)胞懸液+100 μL CGH RPMI-1640溶液,調(diào)整CGH終質(zhì)量濃度為20、40、80、160和320 μg/mL),每組設(shè)6個(gè)復(fù)孔,設(shè)置3個(gè)平行實(shí)驗(yàn)。將上述孔板置于無菌室中,在37 ℃、5% CO2飽和濕度培養(yǎng)箱中培養(yǎng)48 h,培養(yǎng)結(jié)束前4 h每孔加入20 μL 5 mg/mL MTT,繼續(xù)培養(yǎng)4 h。培養(yǎng)結(jié)束后棄去上清液,每孔加入150 μL DMSO溶液溶解 MTT作用活細(xì)胞所產(chǎn)生的甲瓚沉淀,使用微孔板振蕩儀于37 ℃振蕩混勻10 min,待紫色沉淀完全溶解后用酶聯(lián)免疫檢測儀檢測各孔在570 nm波長處的吸光度A570。
1.5 動(dòng)物實(shí)驗(yàn)分組及給藥方法
ICR雌性小鼠60只,適應(yīng)性生長4 d后,隨機(jī)分為5組:正常對照組、CTX模型組、CTX+CGH低劑量組、CTX+CGH中劑量組和CTX+CGH高劑量組。其中,正常對照組和CTX模型組灌胃生理鹽水,CTX+CGH低劑量組、CTX+CGH中劑量組和CTX+CGH高劑量組分別灌胃50、100、200 mg/(kg·d)的CGH溶液,每日定時(shí)灌胃1次,連續(xù)21 d。5組均正常攝食攝水,按1只小鼠4~8 g喂食,且在處死前禁食不禁水12 h。第21 天時(shí),CTX模型組、CTX+CGH低劑量組、CTX+CGH中劑量組和CTX+CGH高劑量組腹腔注射200 mg/(kg·d)的CTX,正常對照組腹腔注射等量生理鹽水,5組均于24 h后處死。
1.6 免疫抑制小鼠血清中細(xì)胞因子水平的測定
各組小鼠分別眼球取血,室溫靜置過夜析出血清,于4 ℃,3 000 r/min離心10 min分離血清,收集血清于2 mL Eppendorf管中,-80 ℃保存?zhèn)溆谩⒏鹘M血清解凍后,嚴(yán)格按照TNF-α、IFN-γ、IL-2和IL-6的ELISA試劑盒說明書進(jìn)行操作,測定免疫抑制小鼠血清中細(xì)胞因子TNF-α、IFN-γ、IL-2和IL-6水平。
1.7 免疫抑制小鼠體內(nèi)抗氧化活性的測定
將各組血清解凍后,嚴(yán)格按SOD、GSH-Px、CAT和MDA的ELISA試劑盒說明書進(jìn)行操作,測定免疫抑制小鼠血清中SOD、GSH-Px、CAT和MDA水平。
1.8 統(tǒng)計(jì)學(xué)處理
實(shí)驗(yàn)數(shù)據(jù)以平均值±標(biāo)準(zhǔn)差表示。采用SPSS 17.0軟件進(jìn)行單因素方差分析,顯著水平為P<0.05。
2 結(jié)果與分析
2.1 CGH對體外脾淋巴細(xì)胞增殖的影響
脾淋巴細(xì)胞體外增殖實(shí)驗(yàn)結(jié)果如圖1所示,結(jié)果表明,脾淋巴細(xì)胞增殖率隨著CGH質(zhì)量濃度的增加而增加,呈劑量依賴性,CGH終質(zhì)量濃度在80~320 μg/mL時(shí),與對照組(終質(zhì)量濃度為0 μg/mL)相比差異顯著(P<0.05),且質(zhì)量濃度在80 μg/mL時(shí),與質(zhì)量濃度為5 μg/mL的Con A無顯著差異(P>0.05),質(zhì)量濃度在320 μg/mL時(shí),脾淋巴細(xì)胞增殖率提高至192.16%,促增殖效果良好。
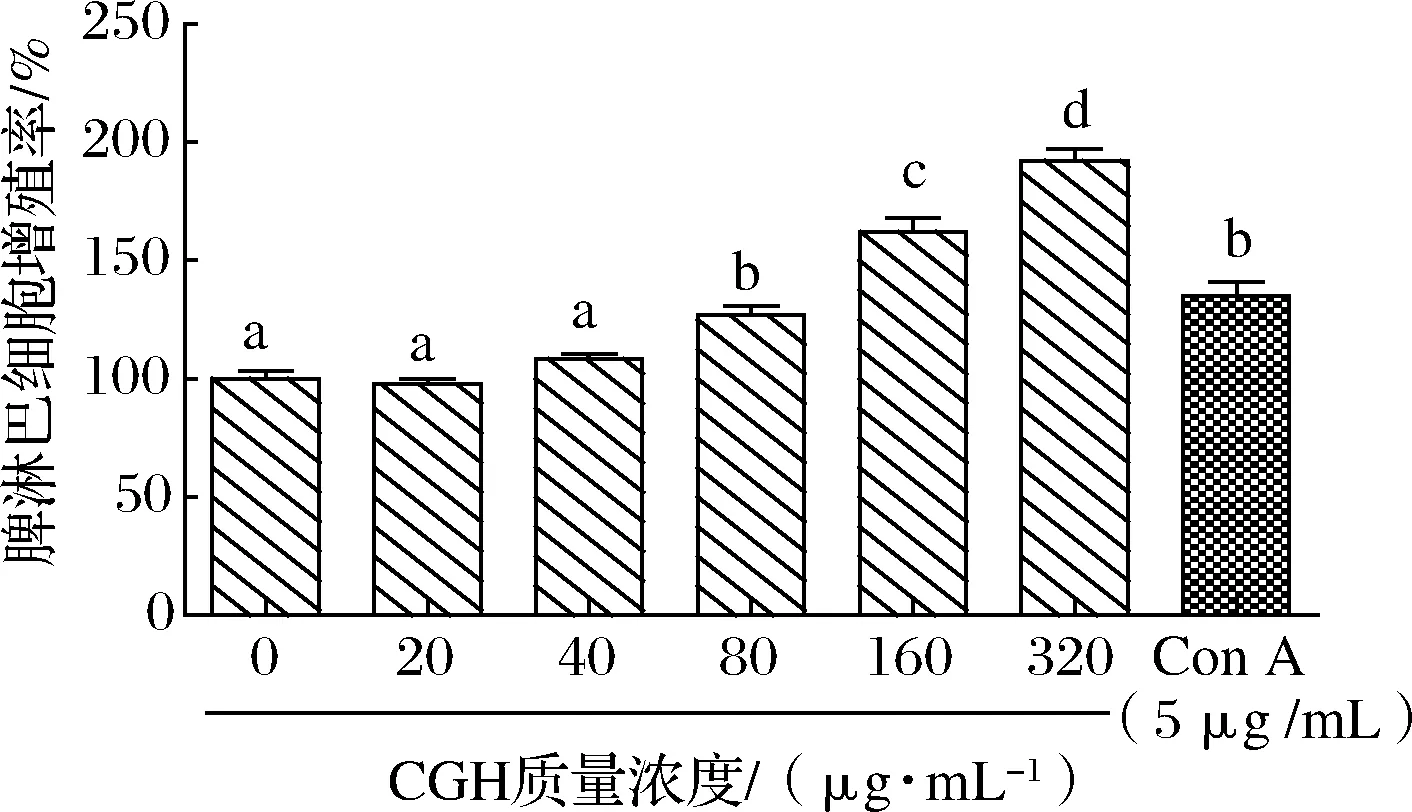
圖1 CGH對體外脾淋巴細(xì)胞增殖的影響Fig.1 Effects of CGH on proliferation of spleen lymphocytes in vitro 注:不同小寫字母表示樣本間差異有統(tǒng)計(jì)學(xué)意義(P<0.05)(下同)
2.2 CGH對免疫抑制小鼠血清中細(xì)胞因子的影響
CGH對免疫抑制小鼠血清中細(xì)胞因子的影響如圖2所示,CTX模型組TNF-α、IFN-γ、IL-2和IL-6含量與正常對照組相比均顯著降低(P<0.05),說明CTX對免疫調(diào)節(jié)網(wǎng)絡(luò)造成破壞,打破小鼠體內(nèi)免疫系統(tǒng)的平衡,各項(xiàng)細(xì)胞因子均大幅下降,小鼠的免疫功能被抑制,建模效果良好。

a-TNF-α;b-IFN-γ;c-IL-2;d-IL-6圖2 CGH對免疫抑制小鼠血清中細(xì)胞因子的影響Fig.2 Effect of CGH on serum cytokines in immunosuppressed mice
CGH對免疫抑制小鼠血清中TNF-α的影響如圖2-a所示,CTX+CGH低、中、高劑量組TNF-α含量與模型組相比顯著提高(P<0.05),且隨著CGH質(zhì)量濃度的增加TNF-α含量增高,其中CTX+CGH高劑量組血清中TNF-α含量較模型組提高1.44倍,為(488.24±77.06)pg/mL。
CGH對免疫抑制小鼠血清中IFN-γ的影響如圖2-b所示,CTX+CGH低、中、高劑量組IFN-γ含量與模型組相比顯著提高(P<0.05),高劑量CGH使免疫抑制小鼠IFN-γ含量由(408.46±65.18)pg/mL提高至(602.01±71.05)pg/mL。
CGH對免疫抑制小鼠血清中IL-2的影響如圖2-c所示,CTX+CGH中、高劑量組IL-2含量與模型組相比顯著提高(P<0.05),由模型組的(186.53±25.72)pg/mL分別提高至(226.50±26.99)、(227.66±30.48)pg/mL,CTX+CGH低劑量組IL-2含量與模型組無顯著性差異(P>0.05)。
CGH對免疫抑制小鼠血清中IL-6的影響如圖2-d所示,CTX+CGH高劑量組IL-6含量與模型組相比顯著提高(P<0.05),提高了1.30倍,而CTX+CGH低劑量組、CTX+CGH中劑量組IL-6含量與模型組無顯著差異(P>0.05)。
2.3 CGH對免疫抑制小鼠體內(nèi)抗氧化活性的影響
機(jī)體的抗氧化能力與免疫功能關(guān)系密切,抗氧化能力的強(qiáng)弱對維持機(jī)體的健康有著重要作用。正常生理狀態(tài)時(shí),自由基不斷產(chǎn)生,并通過SOD和GSH-Px不斷清除,處于動(dòng)態(tài)平衡[19-20],當(dāng)對機(jī)體注射CTX后,CTX可以打破這種平衡,引起機(jī)體的氧化應(yīng)激[21]。在體內(nèi)實(shí)驗(yàn)中,檢測抗氧化關(guān)鍵酶SOD、GSH-Px、CAT和脂質(zhì)過氧化產(chǎn)物MDA可以反映CGH的體內(nèi)抗氧化水平,結(jié)果如圖3所示。
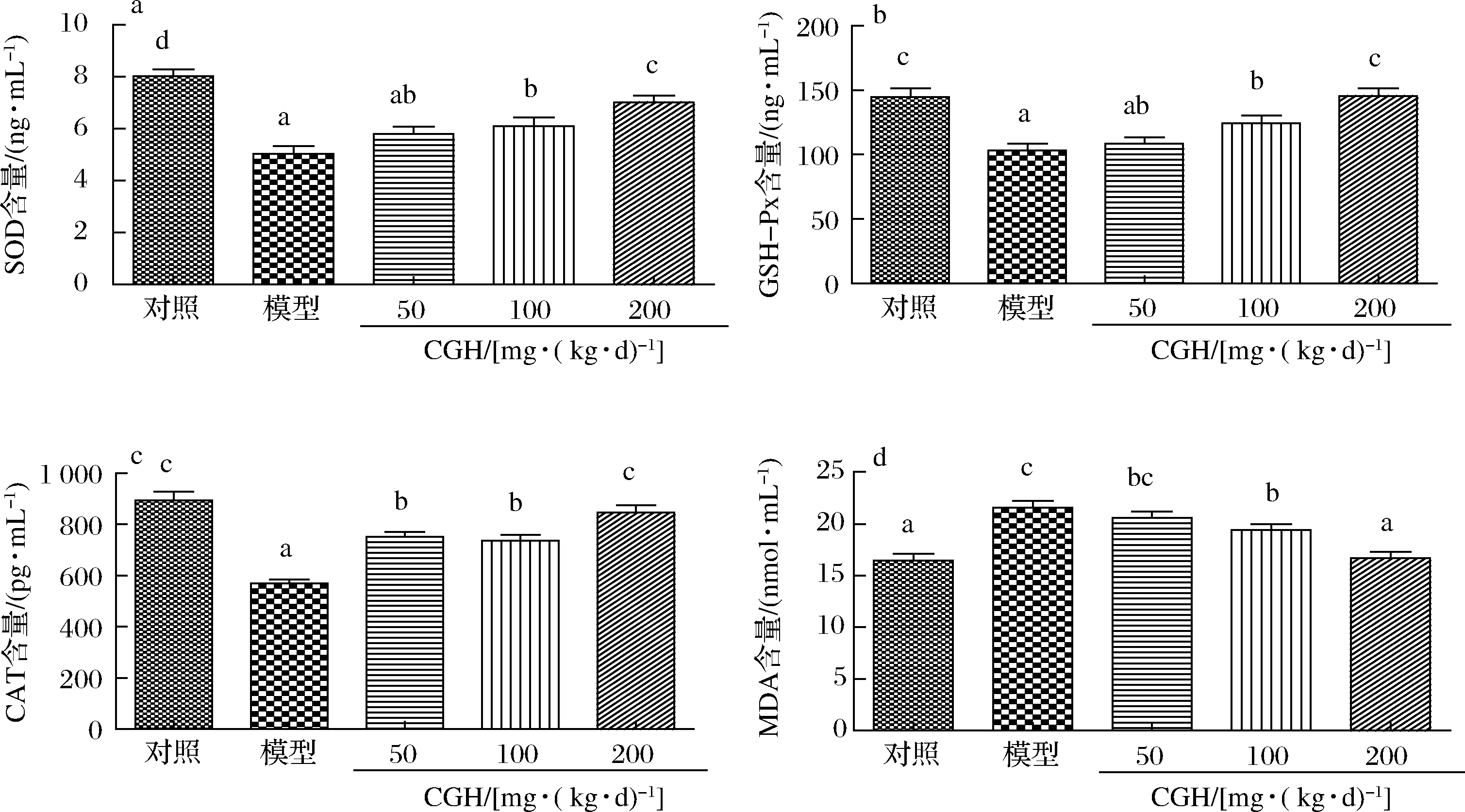
a-SOD;b-GSH-Px;c-CAT;d-MDA圖3 CGH對免疫抑制小鼠體內(nèi)抗氧化活性的影響Fig.3 Effect of CGH on antioxidant activity in immunosuppressed mice
CGH對免疫抑制小鼠血清中SOD的影響如圖3-a所示,CTX模型組血清中SOD含量與正常對照組相比顯著降低(P<0.05),其中CTX模型組血清中SOD含量為(5.04±0.84)ng/mL,較對照組降低1.60倍,SOD含量的顯著降低表明CTX會(huì)引起體內(nèi)超氧自由基富集,說明CTX會(huì)損傷免疫細(xì)胞,影響機(jī)體正常免疫反應(yīng)的進(jìn)行。CTX+CGH中、高劑量組SOD含量與模型組相比顯著提高(P<0.05),CTX+CGH低劑量組的SOD含量與模型組無顯著差異(P>0.05)。
CGH對免疫抑制小鼠血清中GSH-Px的影響如圖3-b所示,CTX模型組血清中GSH-Px含量與正常對照組相比顯著降低(P<0.05),由(147.80±19.49)ng/mL降低至(103.23±15.21)ng/mL,體內(nèi)GSH-Px含量的減少說明CTX會(huì)影響有毒過氧化物的分解,從而對免疫細(xì)胞產(chǎn)生毒副作用,抑制機(jī)體正常的免疫功能。CTX+CGH中、高劑量組GSH-Px含量與模型組相比顯著提高(P<0.05),分別較模型組提高1.21倍和1.41倍,CTX+CGH低劑量組GSH-Px含量與模型組無顯著差異(P>0.05),CTX+CGH高劑量組GSH-Px含量與正常對照組相比無顯著差異(P>0.05)。
CGH對免疫抑制小鼠血清中CAT的影響如圖3-c所示,CTX模型組血清中CAT含量與正常對照組相比顯著降低(P<0.05),腹腔注射CTX后,CAT含量會(huì)迅速下降,由(946.61±69.41)pg/mL降低至(568.86±46.54)pg/mL,使細(xì)胞受到過量H2O2的毒害,同樣對機(jī)體的免疫系統(tǒng)造成損壞。CTX+CGH低、中和高劑量組CAT含量與模型組相比均顯著提高(P<0.05)。
CGH對免疫抑制小鼠血清中MDA的影響如圖3-d所示,CTX模型組血清中MDA含量與正常對照組相比顯著升高(P<0.05),CTX注射后,血清中MDA含量提高1.39倍,這些過量的MDA會(huì)通過多種途徑對細(xì)胞尤其是免疫細(xì)胞造成損傷,還會(huì)對機(jī)體的免疫功能產(chǎn)生抑制作用。CTX+CGH中、高劑量組MDA含量與模型組相比顯著降低(P<0.05),CTX+CGH高劑量組降低至(16.67±1.81)nmol/mL,與正常對照組相比無顯著差異(P>0.05),CTX+CGH低劑量組MDA含量與模型組無顯著差異(P>0.05)。
3 討論
脾臟是機(jī)體內(nèi)形體最大的淋巴器官,脾的內(nèi)部分為白髓和紅髓,表皮則有一層結(jié)締組織形成的被膜,脾淋巴細(xì)胞主要聚集在白髓中,脾淋巴細(xì)胞中含有T淋巴細(xì)胞和B淋巴細(xì)胞,均是機(jī)體的免疫活性細(xì)胞,免疫細(xì)胞的活化是免疫細(xì)胞參與免疫的重要體現(xiàn)[22]。免疫細(xì)胞在活化后有不同的表現(xiàn),T淋巴細(xì)胞活化的重要表現(xiàn)之一就是T淋巴細(xì)胞的分裂增殖及分化,所以T淋巴細(xì)胞的增殖率是反映細(xì)胞免疫最直接的指標(biāo)。本實(shí)驗(yàn)研究結(jié)果表明,與Con A陽性對照組相比,160 μg/mL的CGH能更好的促進(jìn)脾淋巴細(xì)胞體外分裂增殖及分化,推斷CGH可作為淋巴細(xì)胞的有絲分裂原,促進(jìn)淋巴細(xì)胞增殖,進(jìn)而發(fā)揮其免疫增強(qiáng)活性,對增強(qiáng)機(jī)體的免疫功能具有重要的意義。
細(xì)胞因子是一類由多種免疫細(xì)胞和一些非免疫細(xì)胞分泌的,最終作用于細(xì)胞的多肽、小分子蛋白或糖蛋白,能參與并調(diào)節(jié)機(jī)體免疫應(yīng)答、細(xì)胞分化、造血、腫瘤免疫等多種生理及病理過程[23]。本實(shí)驗(yàn)選取淋巴細(xì)胞產(chǎn)生的IFN-γ、IL-2以及單核細(xì)胞或巨噬細(xì)胞產(chǎn)生的TNF-α和IL-6作為研究指標(biāo)。TNF-α是血清中一種能使腫瘤發(fā)生出血性壞死的物質(zhì),主要來源于各種免疫細(xì)胞、內(nèi)皮細(xì)胞、成纖維細(xì)胞,TNF-α在生物學(xué)上應(yīng)用廣泛,不僅有對腫瘤細(xì)胞造成損傷、強(qiáng)化中性粒細(xì)胞的吞噬能力,還可以增加過氧化物陰離子產(chǎn)生,刺激細(xì)胞脫顆粒和分泌髓過氧化物酶、抗感染,并誘導(dǎo)肝細(xì)胞急性期蛋白的合成[24],CGH低中高劑量時(shí)均可顯著提高免疫抑制小鼠的TNF-α含量。IFN-γ為Ⅱ型干擾素,主要由活化的T淋巴細(xì)胞和NK細(xì)胞產(chǎn)生,IFN-γ可通過激活單核吞噬細(xì)胞殺滅微生物及腫瘤細(xì)胞,激活中性粒細(xì)胞和NK細(xì)胞,強(qiáng)化NK細(xì)胞對腫瘤細(xì)胞的殺傷活性,促進(jìn)巨噬細(xì)胞的吞噬功能,抑制自分泌生長因子的形成和活性,抑制宿主向腫瘤細(xì)胞提供重要的營養(yǎng)因子或生長因子,從而造成腫瘤細(xì)胞的凋亡[25],CGH低中高劑量時(shí)均可顯著提高免疫抑制小鼠IFN-γ的含量。IL-2能刺激T輔助細(xì)胞和NK細(xì)胞產(chǎn)生細(xì)胞因子,促進(jìn)細(xì)胞因子的繁殖以及刺激T細(xì)胞在體外生長等功能[26],CGH中高劑量時(shí)均顯著提高免疫抑制小鼠IL-2的含量。IL-6在多種細(xì)胞功能調(diào)節(jié)方面具有重要的作用,包括細(xì)胞分化、增殖、免疫防御、造血功能、神經(jīng)系統(tǒng)等,IL-6與腫瘤細(xì)胞的生長、增殖密切相關(guān),通過對腫瘤細(xì)胞的黏附性、活動(dòng)力、增殖以及特異性抗原的表達(dá),控制腫瘤的發(fā)展[27],CGH高劑量時(shí)可顯著提高免疫抑制小鼠IL-6的含量。結(jié)果表明,CGH高劑量時(shí)可顯著促進(jìn)免疫抑制小鼠血清中TNF-α、IFN-γ、IL-2和IL-6含量的提高,拮抗CTX對小鼠免疫功能的抑制作用。
抗氧化與免疫之間有著密切的聯(lián)系[3,14-16],自由基的過量失控也會(huì)對機(jī)體免疫系統(tǒng)造成損傷。免疫細(xì)胞和免疫器官對氧化應(yīng)激十分敏感[28]。實(shí)驗(yàn)結(jié)果表明,CTX使小鼠血清中脂質(zhì)過氧化物MDA含量增高,此時(shí)小鼠體內(nèi)自由基過量,可損害機(jī)體的免疫組織和免疫細(xì)胞,還可作用于免疫和淋巴系統(tǒng),降低了機(jī)體細(xì)胞免疫和體液免疫,引起機(jī)體免疫功能的損傷[29],而CGH可通過提高小鼠體內(nèi)抗氧化酶的活性緩解CTX對機(jī)體的侵害。CGH體內(nèi)抗氧化活性研究結(jié)果顯示,CGH提高了免疫抑制小鼠體內(nèi)抗氧化酶活性,在劑量為200 [mg/(kg·d)]時(shí),血清中GSH-Px與MDA含量與正常對照組無顯著差異,表現(xiàn)出良好的體內(nèi)抗氧化能力,說明CGH可有效的提高免疫抑制小鼠體內(nèi)抗氧化水平,提高小鼠體內(nèi)抗氧化酶SOD、GSH-Px和CAT的含量,并減少脂質(zhì)過氧化產(chǎn)物MDA的生成量,保護(hù)細(xì)胞免受MDA的毒副作用,緩解CTX對機(jī)體的氧化損傷。
4 結(jié)論
綜上所述,復(fù)合蛋白酶和堿性蛋白酶協(xié)同水解制備的CGH可以促進(jìn)脾淋巴細(xì)胞的體外增殖,質(zhì)量濃度在320 μg/mL時(shí),脾淋巴細(xì)胞增殖率提高至192.16%,緩解了CTX導(dǎo)致的免疫抑制作用,CGH高劑量時(shí)可有效提高免疫抑制小鼠血清中細(xì)胞因子TNF-α、IFN-γ、IL-2和IL-6的含量,提高了免疫抑制小鼠體內(nèi)抗氧化活性,提高了抗氧化酶SOD、GSH-Px和CAT的含量,降低了免疫抑制小鼠體內(nèi)MDA的含量,增強(qiáng)了小鼠免疫調(diào)節(jié)能力,從而保護(hù)機(jī)體健康。除此以外,CGH還具有易制備的優(yōu)點(diǎn),更利于實(shí)際應(yīng)用,因而在玉米深加工領(lǐng)域具有廣闊的應(yīng)用前景。

