體外高頻熱療聯合化療治療晚期肺癌的療效觀察
王道篤 趙其炯 李潔輝 何永越
肺癌是發病率和死亡率增長最快的惡性腫瘤之一,大多數肺癌患者在發現時已處于晚期(Ⅲ期或Ⅳ期)階段,錯過了手術治療時機,難以采用手術切除控制病情。化療作為惡性腫瘤的主要治療手段之一,其通過使用化學藥劑控制癌細胞增殖、轉移[1],對延緩病情有一定的作用,在臨床上已被廣泛認可,但其耐受性相對較差,且在多種藥物聯合使用時限制較多。體外高頻熱療可通過加熱機體組織,改善治療效果,是臨床上一種重要的輔助治療手段。基于此,本研究將體外高頻熱療與化療聯合應用于晚期肺癌的臨床治療中,探究其臨床療效,現報告如下。
1 資料與方法
1.1 一般資料 選取2018 年4 月~2019 年12 月在本院治療的77 例晚期肺癌作為研究對象,所有患者均經病理學明確診斷為非小細胞肺癌,腫瘤分期為Ⅲ期及Ⅳ期,其中合并惡性胸腔積液者14 例,全身多發骨轉移13 例,肝轉移13 例,腎上腺轉移11 例,對側肺門淋巴結轉移12 例,鎖骨上淋巴結轉移14 例。將患者按治療方法不同分為研究組(32 例)和對照組(45 例)。納入標準[2]:①經影像學檢查,病灶雙徑可測量;②年齡18~75 歲;③預測生存期≥3 個月;④近期未進行任何抗腫瘤治療。排除標準:①合并有嚴重器質性疾病;②有嚴重認知功能障礙患者;③對本研究使用藥物過敏患者;④處于妊娠期或哺乳期患者;⑤不愿參加本研究患者。
1.2 方法 所有患者入院后均經影像學進行診斷,明確腫瘤特征。對照組采用體外高頻熱療治療,采用局部深部熱療,使用的熱療設備為HG-2000Ⅲ型體外高頻熱療系統,輸出頻率設置為13.56 MHz,溫度維持在40~42℃,治療時間為40~60 min/次,治療周期為6 d,每個治療周期的第1、3、6 天進行熱療,治療4 個周期。研究組采用體外高頻熱療聯合化療方案進行治療,在化療用藥前1 h 開始熱療,熱療方法同對照組;化療方案根據肺癌的不同病理類型選擇藥物,肺鱗癌患者給予第三代細胞毒藥物聯合鉑類的化療方案,具體方案為:多西他賽聯合順鉑:靜脈滴注 75 mg/m2多西他賽,d1;靜脈滴注25 mg/m2順鉑,d1~3,21 d 為1 個治療周期。對于肺腺癌患者一線優先選擇培美曲塞聯合順鉑:靜脈滴注 500 mg/m2培美曲塞,d1;靜脈滴注 25 mg/m2順鉑,d1~3,21 d 為1 個治療周期。2 個周期化療后評估療效,如腫瘤進展更換二線化療方案。
1.3 觀察指標及判定標準 治療4 個周期后,統計比較兩組患者的臨床療效、局部皮膚損傷情況及不良反應發生情況。臨床療效采用實體瘤療效評價標準(RECIST)進行評價,分為完全緩解(CR)、部分緩解(PR)、無變化或穩定(SD)、進展(PD)。完全緩解率=完全緩解/總例數×100%;客觀緩解率=(完全緩解+部分緩解)/總例數×100%;疾病控制率=(完全緩解+部分緩解+無變化或穩定)/總例數×100%。局部皮膚損傷分為Ⅰ、Ⅱ、Ⅲ、Ⅳ度。不良反應參照WHO 抗癌藥物不良反應評價標準分為5 級,包括胃腸道反應、骨髓抑制、肝腎功能損害及皮膚燒傷。Ⅰ級:輕度;Ⅱ級:中度;Ⅲ級:嚴重;Ⅳ級:威脅生命或喪失能力;Ⅴ級:死亡[3]。
1.4 統計學方法 采用SPSS22.0 統計學軟件進行數據統計分析。計量資料以均數±標準差(±s) 表示,采用t 檢驗;計數資料以率(%)表示,采用χ2檢驗。P<0.05 表示差異具有統計學意義。
2 結果
2.1 兩組治療后臨床療效對比 治療4 個周期后,兩組完全緩解率、客觀緩解率對比差異無統計學意義(P>0.05);研究組疾病控制率高于對照組,差異具有統計學意義(P<0.05)。見表1。
2.2 兩組局部皮膚損傷情況對比 兩組局部皮膚損傷發生率對比,差異無統計學意義(P>0.05)。見表2。

表1 兩組臨床療效對比[n(%),%]
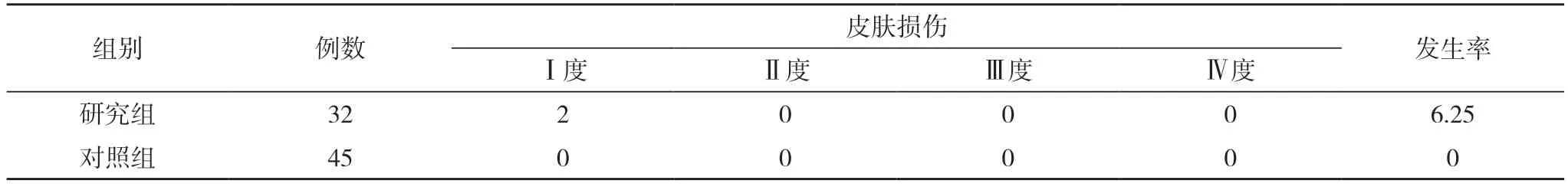
表2 兩組局部皮膚損傷情況對比(n,%)
2.3 兩組不良反應發生情況對比 研究組發生的主要不良反應為胃腸道反應、骨髓抑制和肝腎功能損害,其中Ⅰ度3 例,Ⅱ度2 例,Ⅲ~Ⅳ度0 例,不良反應發生率為15.63%;經過對癥治療后癥狀緩解,未影響療程。對照組發生Ⅰ度皮膚燒傷2 例,不良反應發生率為 4.44%,考慮與熱療持續時間、熱療溫度等因素有關,中斷熱療1 周并對癥治療后均恢復,未影響療程。兩組不良反應發生率對比,差異無統計學意義(P>0.05)。
3 討論
肺癌是人體常見惡性腫瘤,具有發病率高、根治難度大的特點。體外高頻熱療對于失去手術機會的晚期肺癌患者是化療的重要輔助手段,為了探究一種安全、高效、無創傷的治療方法,緩解晚期肺癌患者的病情,延長患者的生存期,本研究采用體外高頻熱療聯合化療對晚期肺癌患者進行治療。體外高頻熱療是利用電磁波穿透機體表層皮膚,對內部組織進行加熱,臨床上常用的熱療溫度為40~42℃,這與組織細胞的耐受性密切相關[4]。聯合化療治療晚期惡性腫瘤的作用機理主要體現在以下幾個方面[5-10]:①腫瘤組織內部散熱條件差,腫瘤細胞的大量增殖導致其內部血管多為畸形,常發育為靜脈瘺、盲端、血竇等,在受熱過程中無法通過血液將熱量帶出,進而產生局部高溫,通常條件下熱療過程中腫瘤內部溫度比周圍正常組織高2~5℃;②腫瘤細胞熱敏性較高,由于腫瘤細胞膜中含膽固醇相對較低,膜的流動性更強,其內部酶的穩定性較差,加之腫瘤細胞在長期缺血的環境中導致其耐溫性較正常組織細胞更差,當溫度升高時膜的穩定性受到破壞,生長環境迅速惡化,然后凋亡;③熱療可以激活機體免疫系統,提高CD4+/CD8+比,增強機體自身免疫能力,抑制腫瘤細胞增殖,控制病情繼續發展;④化療增敏作用。對腫瘤組織進行加熱,可有效提高血液的流動速度,加之受熱后細胞膜的通透性增加,可促進化療藥物進入腫瘤內部,提升藥物滲透距離,改善治療效果。本研究結果顯示,治療4 個周期后,研究組完全緩解率為12.50%,客觀緩解率為34.38%,疾病控制率為62.50%;對照組完全緩解率為6.67%,客觀緩解率為26.67%,疾病控制率為37.78%;兩組完全緩解率、客觀緩解率對比差異無統計學意義(P>0.05);研究組疾病控制率高于對照組,差異具有統計學意義(P<0.05)。由此證實體外高頻熱療聯合化療有效提高了晚期肺癌的治療效果,在治療過程中起到了積極作用。此外,兩組局部皮膚損傷發生率對比,差異無統計學意義(P>0.05)。兩組不良反應發生率對比,差異無統計學意義(P>0.05)。由此說明體外高頻熱療聯合化療具有較高的安全性。
綜上所述,體外高頻熱療聯合化療可有效提高晚期肺癌的整體療效,且具有較好的安全性。由于在本研究中治療時間相對較短,樣本量相對較少,需要進一步累計病例分析總結。

