膠紅酵母分離鑒定及其對凡納濱對蝦幼體存活和變態的影響
寧為民,溫崇慶,黃雪敏,柳敬旺,陳杰世,呂杰偉,梁華芳,薛 明
(廣東海洋大學 水產學院,廣東 湛江 524088 )
凡納濱對蝦(Litopenaeusvannamei)自引進我國以來創造了極大的經濟價值。隨著養殖規模的不斷擴大,優質苗種的供應至關重要。凡納濱對蝦幼體培育期間極少甚至零換水,育苗水體環境相對封閉,加之餌料殘骸、排泄和代謝廢物積聚,易誘導水質惡化和菌群失衡,造成病害暴發和幼體大量死亡[1-2]。近年來利用有益微生物開展對蝦微生態育苗的研究和應用日益增多,并取得了一定成效[3]。但常用水產益生菌如芽孢桿菌、光合細菌、乳酸菌和酵母菌等大多源自陸生環境,對海水的適應能力較差,作用效果短。
海洋紅酵母泛指能適應海水環境并帶粉紅、紅色或橙紅色的酵母菌,大多屬擔子菌門、微球黑粉菌綱、鎖擲酵母目、鎖擲酵母科、紅酵母屬(Rhodotorula)。紅冬孢酵母(Rhodosporidium)、鎖擲孢酵母(Sporidiobolus)和囊擔菌(Cystobasidium)等屬中的某些種與紅酵母屬種類特征相近[4-5],可視為廣義上的紅酵母。海洋紅酵母富含蛋白質、糖原和維生素等營養物質,以及不飽和脂肪酸、類胡蘿卜素和葡聚糖等多種活性成分,懸浮性好,特別適宜作為海產動物幼體的開口餌料和整個幼體期的補充性餌料[6]。海洋紅酵母還具有培養簡單、培養周期短、適應能力強、成本低等優點,是一類較理想的水產益生菌[6-7]。海洋紅酵母作為益生菌提高對蝦生長、存活和免疫等方面的研究已有一些報道[8-13],商品化的海洋紅酵母制劑在對蝦育苗和養成期間也有一定程度的使用。但海洋紅酵母在對蝦幼體培育方面的研究報道較少[14],而投菌量和投菌頻次對對蝦幼體的影響尚未見報道。
筆者在從海產動物腸道分離鑒定紅酵母的基礎上,通過凡納濱對蝦幼體培育試驗篩選最適菌株,進而研究目標菌投菌時間、劑量和頻次對幼體存活和變態的影響,為海洋紅酵母在對蝦幼體培育中的合理應用提供科學依據。
1 材料與方法
1.1 分離用海產動物
凡納濱對蝦、斑節對蝦(Penaeusmonodon)、翡翠貽貝(Pernaviridis)、華貴類櫛孔扇貝(Mimachlamysnobilis)和褐藍子魚(Siganusfuscescens)等,均為湛江地區海鮮市場購買的鮮活海產品。
1.2 海洋紅酵母的分離
將待分離動物體表洗凈并按種類分組,75%酒精體表消毒后無菌操作取出各組動物腸道分別勻漿,各組勻漿液分別劃線或稀釋涂布于含有0.05%氯霉素的YPD培養基(葡萄糖2%,蛋白胨2%,酵母提取物1%,瓊脂粉1.8%,陳海水配制),30 ℃培養5 d,每日觀察,并挑取帶有紅色或橙紅色的酵母單菌落于YPD平板劃線純化,純化后轉接到YPD斜面,4 ℃保存備用。
純化的酵母菌再以YPD平板劃線,30 ℃培養3 d,觀察和記錄菌落特征,期間挑取少量菌體與0.1%堿性美蘭染液混勻,置于顯微鏡下觀測細胞個體形態特征,并通過測微尺對每株菌10個以上細胞測量個體大小,以寬(范圍)×長(范圍)表示酵母菌大小。
1.3 碳源利用
參考文獻[15]的方法,取各酵母菌1 mL新鮮細胞懸液(約107cfu/mL)分別與冷卻至約42 ℃的碳源同化基礎培養基混勻,凝固后用無菌小勺依次加入葡萄糖、乳糖、棉子糖、L-阿拉伯糖、鼠李糖、淀粉、蔗糖和肌醇作為碳源,30 ℃培養4 d。觀察記錄碳源周圍是否出現生長圈。結合碳源利用譜和形態特征對分離酵母菌株進行分型。
1.4 酵母菌的分子鑒定
以酵母基因組DNA提取試劑盒(天根生化,DP307),按操作說明提取代表菌株的基因組DNA。參考Kopsahelis等方法[16],以基因組DNA為模板,使用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATA TGC-3′)擴增5.8S-ITS基因;使用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′- GGTCCGTGTTTCAAGACGG-3′)擴增26S rRNA基因。PCR反應體系:10×PCR buffer 5 μL;dNTPs(2.5 mmol/L)1 μL;正反向引物(20 pmol/μL)各0.5 μL;基因組DNA 5 μL(10~100 ng);Taq DNA聚合酶 0.2 μL(1 U/μL);補充ddH2O至體積為50 μL。PCR擴增程序:95 ℃ 5 min;95 ℃ 40 s,55 ℃ 40 s,72 ℃ 1 min,34個循環;72 ℃ 10 min。
將5.8S-ITS和26S rRNA基因擴增產物委托北京六合華大基因公司分別以ITS 1和NL1引物通過ABI 3730XL測序儀測序。將測得的序列通過美國國立生物技術信息中心(http:∥www.ncbi.nlm.nih.gov/)BLAST程序在GenBank數據庫中進行核酸序列比對分析,進行菌種鑒定。調取代表菌株及其最相似參考菌株與模式菌株序列,通過MEGA 5.0軟件采用鄰接法進行聚類分析并構建系統進化樹。
1.5 篩選試驗
分離純化后的代表菌株(RY1~RY6),分別通過YPD平板劃線,30 ℃培養2 d后用無菌海水從平板上洗下細胞,3000 r/min 離心10 min,棄上清液,再用無菌海水漂洗和離心一次,懸于海水中。通過血球計數板計數酵母菌液含量,并調整各菌株使其母液細胞含量保持一致,即5×108個/mL,4 ℃存放,3 d內使用。
試驗用凡納濱對蝦幼體取自湛江東海島某對蝦種苗場,由同池同批次受精卵孵化無特定病原的無節Ⅲ期幼體。幼體培育試驗用海水為天然海水經砂濾后蓄于同一池,放幼體前加入體積分數20×10-6的甲醛消毒1 d,再曝氣處理1 d。采用16 L塑料桶,每桶加海水(鹽度29.5,pH 7.9)10 L和無節Ⅲ期幼體2000只,共設6個處理組和1個對照組,每組3個平行,處理組根據所加酵母菌設為RY1~RY6組。當幼體從無節Ⅵ期剛開始向溞狀Ⅰ期變態時(90%以上幼體仍為無節Ⅵ期階段),投喂螺旋藻粉(淯暉公司)和蝦片(英聯公司)作為餌料,同時處理組各桶分別加入對應的酵母細胞母液2 mL,即加入水體后的初始酵母菌,密度均為105個/mL,此后每隔12 h補加等密度的酵母細胞,共補加2次,對照組始終不投菌。試驗期間不換水,水溫保持在(31.5±1.0) ℃。各組按同樣方式管理和飼喂,每隔4 h投餌一次。但當處理組補加酵母時,均停止投料,即補加酵母前后間隔8 h再投料,人為對幼體造成一定的間歇饑餓脅迫。定時觀察幼體存活情況,當幼體完全變為溞狀Ⅱ期時,計數存活幼體,統計存活率。
1.6 菌株RY4投菌方式試驗
參照1.5方法,制備菌株RY4細胞母液(109個/mL),每桶加海水(鹽度29.2,pH 8.05)10 L和無節幼體Ⅲ期凡納濱對蝦幼體2400只。試驗共設5個處理組和1個對照組,每組設4個平行,各處理組編號、單次投菌量、投菌次數和投菌時的幼體期見表1。高劑量和低劑量多次投菌組即MH和ML組的兩次投菌間隔時間為24 h。

表1 海洋紅酵母RY4在凡納濱對蝦幼體培育時的投菌方式
參照1.5方法,試驗期間不換水,水溫保持在(31.5±1.0) ℃。幼體從無節Ⅵ期開始向溞狀Ⅰ期變態時,每隔4 h投喂蝦片和藻粉,各組投喂量保持一致。提前單次高劑量組在幼體無節Ⅳ期時就較其他組提前加入菌株RY4。其他處理組在初次投喂餌料(無節Ⅵ期)的同時開始加入菌株RY4。幼體發育至溞狀Ⅰ~Ⅱ期和溞狀Ⅱ~Ⅲ期時,分別從每桶分3次隨機各取250 mL水樣,結合肉眼和解剖鏡觀察計數存活幼體及其發育階段,統計存活率和變態率。溞狀Ⅱ~Ⅲ期后繼續投喂蝦片和藻粉,尚未開始投喂鹵蟲(Artemiasalina)幼體或其他餌料,造成營養受限脅迫。2 d后統計各組存活率,同時從各桶取水樣,分別以水樣原液及其10倍稀釋液0.1 mL涂布于含0.05%氯霉素的YPD平板,每個梯度3個平板,30 ℃培養5 d,計算水體酵母菌含量,并通過Pearson積矩法分析其與幼體存活率的相關性。
1.7 數據分析
試驗數據以平均值±標準差表示,對各組幼體存活和變態率進行反正弦平方根轉換,采用SPSS 17.0軟件進行單因素方差分析,若差異達顯著水平時以Duncan′s多重比較進行不同處理間的顯著性分析,檢驗標準α=0.05或0.01。
2 結果與分析
2.1 海洋紅酵母的分離與形態特征
從不同海產動物腸道中共分離得到19株紅酵母,根據菌落和細胞形態特征并結合碳源利用譜將其劃分為6個類型。各類型菌落特征、細胞大小、分離源及代表菌株見表2,其中類型1、2、6分別只從翡翠貽貝、斑節對蝦和褐藍子魚腸道中分離;而類型3、4、5則從2種或2種以上動物腸道中分離到。6個類型紅酵母在YPD培養基上的菌落均呈圓形,凸起,邊緣整齊,不透明,除類型6菌落直徑較小外,其余類型菌落直徑大小相近;類型2、3、5的菌落表面均為光滑或較光滑,橙紅色;類型4的菌落表面略顯干燥,粉紅色;類型1 和類型6菌落分別呈紅色和淡橙紅色,兩者細胞大小較其他類型相對偏小。

表2 6個類型海洋紅酵母菌分離來源及形態特征
2.2 碳源利用結果
6個類型酵母菌對8種碳源的同化測試結果見表3。所有19株菌均能利用葡萄糖和蔗糖,但對肌醇、鼠李糖、乳糖和淀粉均不能利用。類型2和3菌株碳源譜一致,均能利用棉子糖;類型4和5菌株碳源譜一致,對L-阿拉伯糖也能利用;而類型1和6酵母無法利用所測其他糖類。
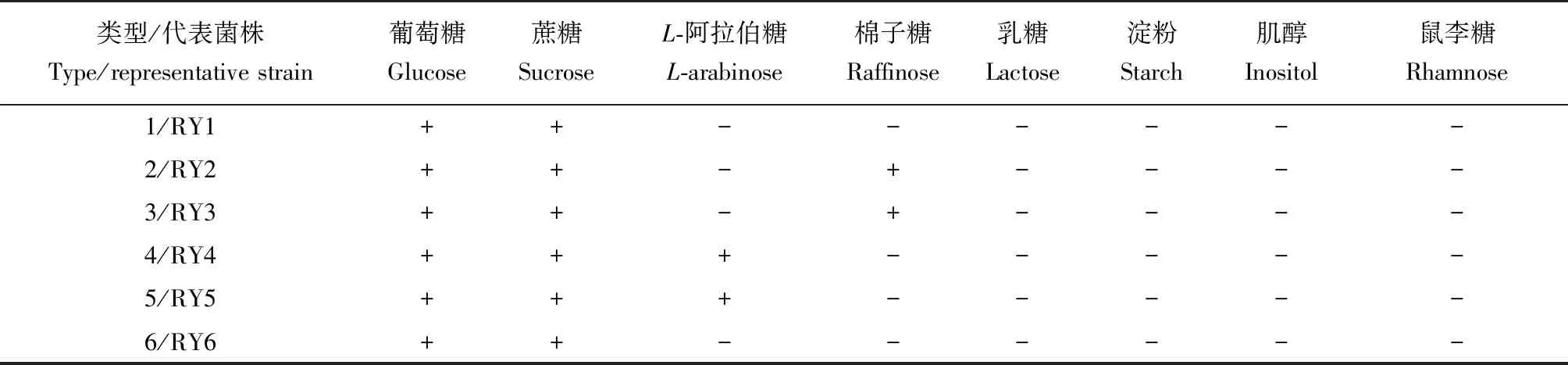
表3 海洋紅酵母分離菌株的碳源譜
2.3 酵母菌分子鑒定
6株代表菌的5.8S-ITS和26S rRNA基因測序后,美國國立生物技術信息中心數據庫比對分析顯示菌株RY2~RY5均與膠紅酵母(R.mucilaginosa)同源性最高,與其模式菌株的ITS和26S rRNA基因序列相似度均超99%。菌株RY1和菌株RY6分別與雙倒卵形紅酵母(R.diobovata)和斯魯菲亞囊擔菌(Cystobasidiumslooffiae)的同源性最高,菌株RY1與雙倒卵形紅酵母模式菌株的ITS和26S rRNA基因序列相似性分別為98.81%和99.65%;菌株RY6與斯魯菲亞囊擔菌模式菌株的ITS和26S rRNA基因序列相似性分別為98.03%和99.66%。6株代表菌與參考菌株的5.8S-ITS和26S rRNA基因系統發育樹分別見圖1、圖2。兩個基因的發育樹均分為3個分支,即RY2~RY5與膠紅酵母歸為一類分支;RY1和RY6分別與雙倒卵形紅酵母和斯魯菲亞囊擔菌聚為一類。因此,菌株RY2~RY5均鑒定為膠紅酵母,RY1和RY6分別鑒定為雙倒卵形紅酵母和斯魯菲亞囊擔菌。

圖1 基于5.8S-ITS基因序列的海洋紅酵母系統發育樹Fig.1 Phylogenetic tree of marine red yeasts based on 5.8S-ITS gene sequences GenBank序列登錄號顯示在括號內;標尺代表10%的序列差異. The sequences accession number in GenBank are shown in parentheses; the bar equals 10% sequence difference.

圖2 基于26S rRNA基因序列的海洋紅酵母系統發育樹Fig.2 Phylogenetic tree of marine red yeasts based on 26S rRNA gene sequences GenBank序列登錄號顯示在括號內;標尺代表2%的序列差異. The sequence accession number in GenBank are shown in parentheses; the bar equals 2% sequence difference.
2.4 6株紅酵母對幼體存活影響
間歇饑餓脅迫條件下,與對照組相比,6株海洋紅酵母均能提高凡納濱對蝦溞狀Ⅱ期幼體存活率(圖3)。除膠紅酵母RY6組存活率與對照組差異不顯著(P>0.05)外,其余5個菌株組存活率均顯著高于對照組(P<0.05)。雙倒卵形紅酵母RY1、膠紅酵母RY2、膠紅酵母RY3和膠紅酵母RY5組間的存活率雖有一定波動,但差異不顯著(P>0.05)。膠紅酵母RY4組平均存活率76.11%,高出對照組約40%,同時也顯著高于其他5個菌株處理組(P<0.05),效果最佳。因此,確定膠紅酵母RY4作為進一步試驗的目標菌。
2.5 膠紅酵母RY4投菌方式對凡納濱對蝦幼體存活和變態影響
不同投菌方式下,膠紅酵母RY4對凡納濱對蝦溞狀Ⅰ~Ⅱ期和溞狀Ⅱ~Ⅲ期幼體存活影響見圖4。溞狀Ⅰ~Ⅱ期,各組平均存活率均超過70%,且組間無顯著差異(P>0.05);溞狀Ⅱ~Ⅲ期,除多次低劑量和提前單次高劑量組存活率顯著高于單次高劑量投菌組(P<0.05)外,各組存活率間仍無顯著差異(P>0.05)。不同投菌方式下膠紅酵母RY4對溞狀幼體的變態影響見圖5。提前單次高劑量、單次高劑量和多次高劑量投菌組溞狀幼體的變態率均普遍高于其他各組。溞狀Ⅰ~Ⅱ期階段同一時間統計時,3個高劑量投菌組溞狀Ⅱ期幼體平均變態率均超過80%,多次高劑量組變態率更是高達95%,極顯著高于對照組(3.5%)(P<0.01);多次低劑量組變態率也顯著高于對照組(P<0.05),但與單次低劑量組間差異不顯著(P>0.05);而單次低劑量組與對照組間變態率差異不顯著(P>0.05)。溞狀Ⅱ~Ⅲ期階段同一時間統計時,提前單次高劑量、多次高劑量和單次高劑量組溞狀Ⅲ期變態率均顯著高于對照組和單次低劑量組(P<0.05),其中多次高劑量組的變態率最高(53%);而單次低劑量、多次低劑量和對照組的變態率分別只有1.56%、4.46%和0,3組間差異不顯著(P>0.05)。多次低劑量組對溞狀幼體變態雖然也表現出一定的促進作用,但效果明顯弱于3個高劑量組。可見,不同投菌方式下膠紅酵母RY4對溞狀幼體存活率總體上無明顯影響,但無論在投餌料前如無節Ⅳ期單次高劑量投菌,還是初次投餌料開始(無節Ⅵ期)時單次高劑量或多次高劑量投菌,均能顯著促進幼體變態。

圖3 6株海洋紅酵母對凡納濱對蝦溞狀Ⅱ期幼體存活影響Fig.3 Effects of six strains of marine red yeast on survival of zoea Ⅱ of Pacific white shrimp L. vannamei CK.對照組; RY1~RY6.海洋紅酵母菌株RY1~RY6處理組編號.柱狀圖上標不同字母表示差異顯著(P<0.05,n=3). CK.control group; strains RY1—RY6.the numbers for treatment groups of marine red strains RY1—RY6. The different letters above the columns indicate significant differences (P<0.05, n=3).

圖4 膠紅酵母RY4對凡納濱對蝦溞狀幼體存活影響Fig.4 Effect of R. mucilaginosa RY4 on survival of zoea larvae of Pacific white shrimp L. vannamei CK.對照組; ML.多次低劑量組; SL.單次低劑量組; SH.單次高劑量組; MH.多次高劑量組; ESH.提前單次高劑量組; 柱狀圖上標不同字母表示差異顯著(P<0.05,n=4); 下同. CK.control group; ML.multiple low-dosage group; SL.single low-dosage group; SH.single high-dosage group; MH.multiple high-dosage group; ESH.early single high-dosage group; the different letters above the column indicate significant differences (P<0.05, n=4); et sequentia.
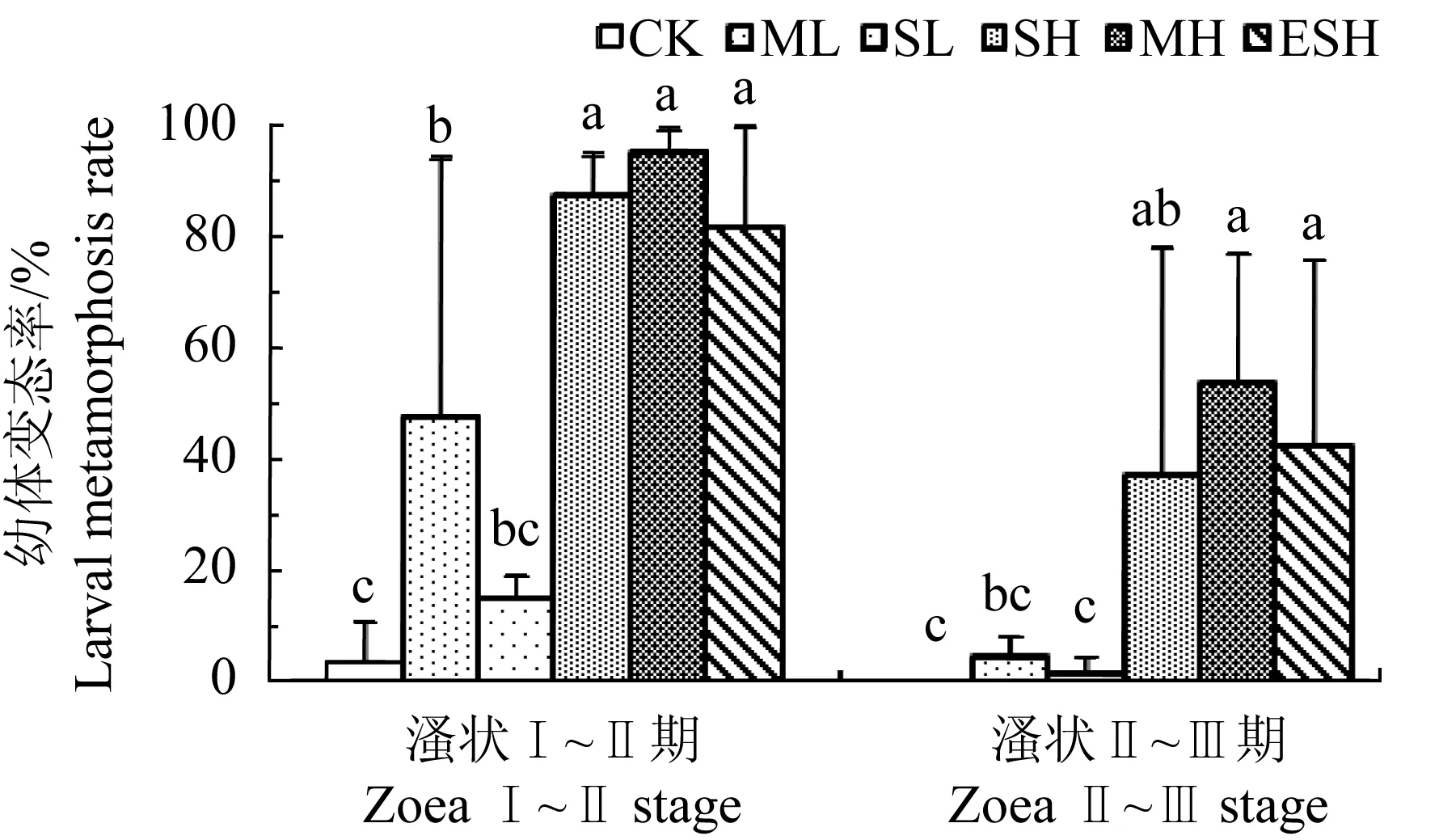
圖5 膠紅酵母RY4對凡納濱對蝦溞狀幼體變態影響Fig.5 Effect of R. mucilaginosa RY4 on metamorphosis of zoea larvae of Pacific white shrimp L. vannamei
溞狀Ⅲ期后,因營養受限脅迫,幼體陸續死亡,2 d后存活幼體均處于糠蝦Ⅰ期,但存活率均明顯下降(圖6)。對照組與單次低劑量組差異不顯著(P>0.05),平均存活率分別只有2.1%和3.8%;多次低劑量、單次高劑量、多次高劑量和提前單次高劑量組存活率均顯著高于對照組(P<0.05),其中多次低劑量組平均存活率最高(16.67%),但4個處理組間差異不顯著(P>0.05)。YPD平板計數糠蝦Ⅰ期各組水體酵母菌含量的結果見表4。多次高劑量組酵母菌含量最高,并顯著高于其他各組(P<0.05);提前單次高劑量和單次高劑量組次之;多次低劑量組含量較少,但仍顯著高于對照組和單次低劑量組(P<0.05);對照組酵母菌含量最低,但與單次低劑量組無顯著差異(P>0.05)。此外,YPD計數平板上,除對照組幾乎全部以及單次低劑量組大多數菌落為乳黃或白色酵母樣菌落外,其他各組平板上的酵母菌落絕大多數為粉紅色如膠紅酵母RY4樣菌落。除單次低劑量組外,其他投菌方式下膠紅酵母RY4均能以較高含量繼續存活于育苗水體。Pearson相關性分析顯示,糠蝦Ⅰ期各組幼體存活率與其水體酵母菌含量間呈現強的正相關性(相關系數0.9023)。可見,在營養受限條件下,糠蝦Ⅰ期幼體存活率主要取決于水體酵母菌尤其膠紅酵母RY4的含量。

圖6 膠紅酵母RY4對凡納濱對蝦糠蝦Ⅰ期幼體存活影響Fig.6 Effect of R. mucilaginosa RY4 on survivial of mysis Ⅰ larvae of Pacific white shrimp L. vannamei

表4 糠蝦Ⅰ期育苗水體酵母菌含量
3 討 論
3.1 對蝦育苗用紅酵母益生菌的鑒定與篩選
腸道微生物對水產動物營養、免疫和抗病起著重要作用[17-18]。自水產動物腸道中分離和篩選益生菌不僅能更好地適應養殖環境,也更容易定殖于宿主腸道[18-19]。紅酵母是海洋酵母的主要類群之一,廣泛分布于不同海洋和海產動物體表及腸道等環境[20-22]。雖然形態和生理生化特征常用于酵母菌的分類,但對其準確鑒定需要借助于核酸序列或脂肪酸圖譜等信息[20]。筆者自湛江地區幾種海產經濟動物腸道分離到19株海洋紅酵母,先根據形態和碳源利用特征將其分為6個類型,再進一步利用5.8S-ITS和26S rRNA 2種基因序列對代表菌株進行鑒定并獲得一致結果。從分型和鑒定結果看,本試驗鑒定的3種海洋紅酵母中,膠紅酵母最為優勢,5種海產動物腸道中都能分離到。齊瓊等[13,21-22]的研究也顯示,從不同海產經濟動物腸道中常分離到膠紅酵母。
膠紅酵母不僅在海產經濟動物腸道中普遍存在,也是水產益生菌中報道較多的海洋紅酵母[11,13,23],但其在對蝦幼體培育中的應用報道很少,且不同菌株間可能存在差異,如本試驗鑒定為膠紅酵母的菌株,根據形態和碳源利用情況可分為4個類型。另外,尚未見雙倒卵形紅酵母和斯魯菲亞囊擔菌用作對蝦益生菌的報道。筆者將4個類型膠紅酵母及雙倒卵形紅酵母和斯魯菲亞囊擔菌代表菌株直接通過對蝦幼體試驗,篩選目標菌株,發現所有被測6株菌均能提高溞狀Ⅱ期幼體存活率,且5株具有顯著效應,其中源自凡納濱對蝦腸道的膠紅酵母RY4表現最好。水產益生菌的篩選通常先根據待測菌的抑菌、胞外酶活性及對胃腸液耐受性等特征進行體外測試,再進一步通過飼養試驗選擇和評價目標菌株的益生效果[24],這種方式適合對大量菌株進行初篩。本試驗則以溞狀Ⅱ期幼體存活率作為指標,主要基于:(1)凡納濱對蝦溞狀Ⅱ期幼體容易出問題而大量死亡,如經常發生的溞Ⅱ綜合征[1,25];(2)體外測試結果用于體內試驗時常未表現出相應效果,還可能遺漏真正有效的菌株,如有研究發現,蠟樣芽孢桿菌(Bacilluscereus)在體外測試時雖不能拮抗病原弧菌,卻能有效促進對蝦幼體變態和存活[26-27];(3)尚未見海洋紅酵母對對蝦致病性的報道,通過對分離菌株分型去重后,筆者用于篩選的菌株只有6株。因此筆者直接以溞狀Ⅱ期幼體存活效果為篩選依據,能更有效選出目標菌株。
3.2 投菌方式對膠紅酵母RY4作用效果影響
水產益生菌的投菌方式與其作用效果密切相關,特別是投菌劑量頗受關注[28]。投菌量不足,密度不夠,難以發揮作用,但盲目過量添加不僅增加使用成本,也可能適得其反,對水產動物造成負面影響[28-29]。因此研究和優化水產益生菌使用時的添加劑量、頻率以及投菌時間等至關重要。筆者設置高劑量、低劑量,多次、單次和不同幼體期的組合投菌方式來評估膠紅酵母RY4對凡納濱對蝦幼體影響。結果表明,投菌劑量直接關乎膠紅酵母RY4在水體中的有效含量,最為關鍵的是,3個高劑量組均顯著促進溞狀幼體變態和營養受限時糠蝦Ⅰ期幼體存活,多次低劑量組也能顯著提高糠蝦Ⅰ期幼體存活率,但其對幼體變態效應明顯弱于高劑量組。其次是投菌時間,在即將開口攝食前(無節Ⅳ期)提前單次高劑量投菌組與無節Ⅵ期開始的多次高劑量投菌組效果相當。可見,適宜階段投菌不僅可減少投菌頻次,也可能有助于益生菌在水體和腸道中的定殖,特別是對蝦幼體在無節后期由內源性營養供給轉變為外源性營養攝入,開口時幼體腸道處于原生態狀態,更易被加入的益生菌定殖,繼而對幼體后期的生長發育發揮影響。
4 結 論
筆者自湛江地區海產經濟動物腸道分離鑒定了3種海洋紅酵母,其中膠紅酵母最為優勢;饑餓脅迫下膠紅酵母RY2~RY5和雙倒卵形紅酵母RY1均能顯著提高凡納濱對蝦幼體存活,其中膠紅酵母RY4又明顯優于其他菌株;應用膠紅酵母RY4培育凡納濱對蝦幼體時,在早期幼體如無節Ⅳ期單次加入高劑量(5×105個/mL),或首次投餌料開始多次加入高劑量,可有效促進幼體變態與營養受限時的存活。
致 謝
感謝湛江市科壹水產養殖有限公司吳勇先生對本次幼體試驗提供的幫助;感謝廣東海洋大學水產學院劉嘉俊、譚勇賓、余瑋旭和陳賜觥等同學對本試驗前期工作的協助。

