基于不同顏色山楂花MYB家族的挖掘與比較分析
李戌彥 楊忠義 紀 薇 楊明霞
(1山西農業大學園藝學院,山西 太谷 030801;2山西農業大學果樹研究所,山西 太谷 030801;3農業部黃土高原作物基因資源與種質創制重點實驗室,山西太原 030031;4果樹種質創制和利用山西省重點實驗室,山西太原 030031)
山楂(Crataegusspp.)屬于薔薇科山楂屬落葉果樹,其果實含有大量的有機酸、黃酮類、甾體、有機胺及低聚黃烷類物質,營養價值極高[1]。山楂主要分布于東亞、歐洲、北美洲等北溫帶地區[2],由于我國地形氣候變化多樣,山楂種質資源也較為豐富,現存的主要歐亞種山楂均與我國山楂有著直接或間接的聯系。花色是植物花器官分類最重要的性狀之一[3],也是植物花器官發育階段界定的主要性狀之一。山楂的花色主要為純白色或紅色,差異極明顯[4]。經前期調查和研究,在開放白色花朵的山楂樹上發現了芽變產生的粉紅色花朵,該花在完全開放后顏色會轉為粉色,通過轉錄組測序、基因注釋、花青素含量測定等研究,發現一些基因的表達可能對花青苷的含量產生影響,其中包括一個MYB轉錄家族基因[5]。
MYB類轉錄因子,作為綠色植物中影響最大的轉錄因子家族之一,可以響應外界環境變化、調節細胞周期、影響物質代謝,參與多種生理生化過程,是目前基因家族研究的重點之一[6]。MYB類轉錄因子家族均含一個或多個保守度較高的MYB結構域,即MYB DNA-binding結構域,每個結構域包含1~3個串聯且不重復的、由51~53個氨基酸組成的R基序[7]。在R基序中,每間隔18個氨基酸存在一個起疏水核心作用的色氨酸殘基,每個R基序中含有3個色氨酸殘基,其對維持螺旋-轉角-螺旋結構具有重要意義[8],可以使得形成的高級結構特異性結合DNA大溝[9]。MYB轉錄因子蛋白參與多種生理生化反應。目前,MYB轉錄因子已在芒果[10]、白樺[11]、黑果枸杞[12]、青蒿[13]等植物中進行了克隆表達。楊捷等[14]研究發現Lhsor MYB12轉錄因子可能對花器官的分化具有調節作用。趙佳等[15]研究發現R2R3-MYB的表達影響了月季花青苷的合成;Shang等[16]研究發現MYB轉錄因子與bHLH轉錄因子的表達影響了金魚草花色苷的含量,從而導致金魚草脈序和花色的不同。陳哲等[6]發現菠蘿中的MYB基因可能受到外界乙烯利的調控,并影響菠蘿的生長發育。
植物中調控花青素生物合成的轉錄因子主要有MYB、bHLH和WD40基因家族成員[17]。本研究以前期獲得的不同時期和顏色的山楂花轉錄組數據為基礎,利用生物信息學手段,基于山楂轉錄組數據進行篩選、鑒定,從而對MYB轉錄因子進行深入挖掘,以期為研究山楂MYB轉錄因子對植物花青苷含量的影響及后期相關基因功能的研究奠定基礎。
1 材料與方法
1.1 山楂轉錄組數據的獲取
試驗材料采自山西省太谷縣山西農業科學院果樹研究所(112.58°E,37.43°N,833 m±4 m),品種為大金星山楂。根據前期研究,選擇花色苷含量具有顯著差異的時期進行采樣,常規大金星品種花朵開放初始階段(BB-1)和花朵完全開放后(BB-2)均為白色;大金星芽變品種花朵開放初始階段(BF-1)為白色,花朵完全開放后(BF-2)為粉色[5]。采集后的樣品在液氮環境中運回實驗室進行RNA提取,并送至北京百邁客生物科技有限公司進行轉錄組測序和組裝。
1.2 山楂MYB蛋白序列的獲取
從Pfam(http://pfam.xfam.org/)數據庫中下載MYB保守結構域的隱馬爾科夫模型文件PF00249,并利用Hmmer軟件在轉錄組蛋白質數據中進行檢索。利用本地BLAST軟件(ncbi-blast-2.10.0+-win64)將檢索結果構建成本地山楂轉錄組MYB蛋白二級數據庫,并從Plant Transcription Factor Database(http://planttfdb.cbi.pku.edu.cn/)下載擬南芥168條MYB轉錄因子序列進行本地BLAST搜索,將BLAST結果建成山楂轉錄組MYB蛋白三級數據庫。利用NCBI(https://www.ncbi.nlm.nih.gov/)網站的Conserved Domain Search功能依次對結構域種類及數量進行預測,排除假陽性。
1.3 山楂MYB蛋白理化信息分析及motif結構預測
利用ExPASy-ProtParam tool(https://web.expasy.org/protparam/)對山楂MYB蛋白序列的氨基酸數、理論等電點(protein isoelectric,pI)、分子量、親水性、不穩定性進行預測。利用WoLF PSORT(https://wolfpsort.hgc.jp/)對MYB基因編碼的蛋白進行亞細胞定位預測。利用MEME(http://meme.nbcr.net/meme/cgi-bin/meme.cgi)分別對篩選出的不同種類的山楂MYB蛋白序列進行motif結構預測。
1.4 山楂MYB蛋白序統進化樹分析
利用MEGA X對篩選出的2R-MYB序列及125個已有研究基礎的擬南芥2R-MYB序列進行多序列比對,并采用鄰接法(neighbor-joining)進行系統進化樹的構建。1R-MYB系統進化樹僅利用篩選出的山楂1R-MYB進行構建。
1.5 山楂MYB轉錄家族基因表達量分析
根據轉錄組測序結果,將各個基因片段的表達量利用RPKM(reads per kilobasc per million mapped reads)法進行計算,得到表達量的RPKM值,利用R對不同品種、時期MYB蛋白序列的表達量繪制熱圖進行分析。
2 結果與分析
2.1 山楂MYB基因家族蛋白篩選結果
轉錄組測序后共得到34.28 Gb有效數據,經過計算、處理后共得到18 313條蛋白質序列。利用隱馬爾科夫模型文件PF00249進行搜索,并將所得序列建立本地BLAST數據庫,進一步利用擬南芥MYB蛋白序列作為查詢文件進行本地BLAST,共得到80條序列。利用NCBI進行結構域預測后手動篩選,共得到73條山楂MYB家族蛋白序列,其中共含有MYB結構域113個。根據Dubos等[7]和Stracke等[18]的分類規則對其進行分類,最終獲得35條1R-MYB蛋白、36條2R-MYB蛋白、2條3R-MYB蛋白(圖1)。由于3RMYB蛋白數量較少,因此本試驗主要研究1R-MYB蛋白和2R-MYB蛋白。
2.2 山楂MYB基因家族蛋白理化性質分析
由表1可知,1R-MYB蛋白序列平均長度為303.03個氨基酸,且主要分布在50~350個氨基酸之間,長度大于700個氨基酸的僅2個,最大為786個氨基酸(CpMYB61),最小為50個氨基酸(CpMYB53)。而2R-MYB蛋白序列平均長度為328.14個氨基酸,長度主要分布在188~388個氨基酸之間,長度小于200個氨基酸的僅有3條,最大為979個氨基酸(CpMYB36),最小為88個氨基酸(CpMYB12)。相較長度而言,山楂2R-MYB蛋白長度較1R-MYB蛋白長。相對分子質量的變化情況與氨基酸長度變化情況相似。山楂1R-MYB蛋白中有16個蛋白pI值大于7.5,15個蛋白pI值小于6.5,4個蛋白pI值介于6.5~7.5之間;而2R-MYB蛋白中有16個蛋白pI值大于7.5,16個蛋白p I值小于6.5,4個蛋白p I值介于6.5~7.5之間。2R-MYB蛋白中僅CpMYB21(不穩定性指數為38.91)不穩定性指數小于40,屬于穩定蛋白,1R-MYB蛋白中只有CpMYB40(28.59)、CpMYB62(34.51)2個為穩定蛋白,其余蛋白均為不穩定蛋白。
根據亞細胞定位預測的結果,篩選出的所有2RMYB蛋白都分布于細胞核中,1R-MYB蛋白除CpMYB41、CpMYB55、CpMYB62、CpMYB70、CpMYB71主要分布于葉綠體中,CpMYB66主要分布在線粒體中,其余都分布在細胞核中(表1)。
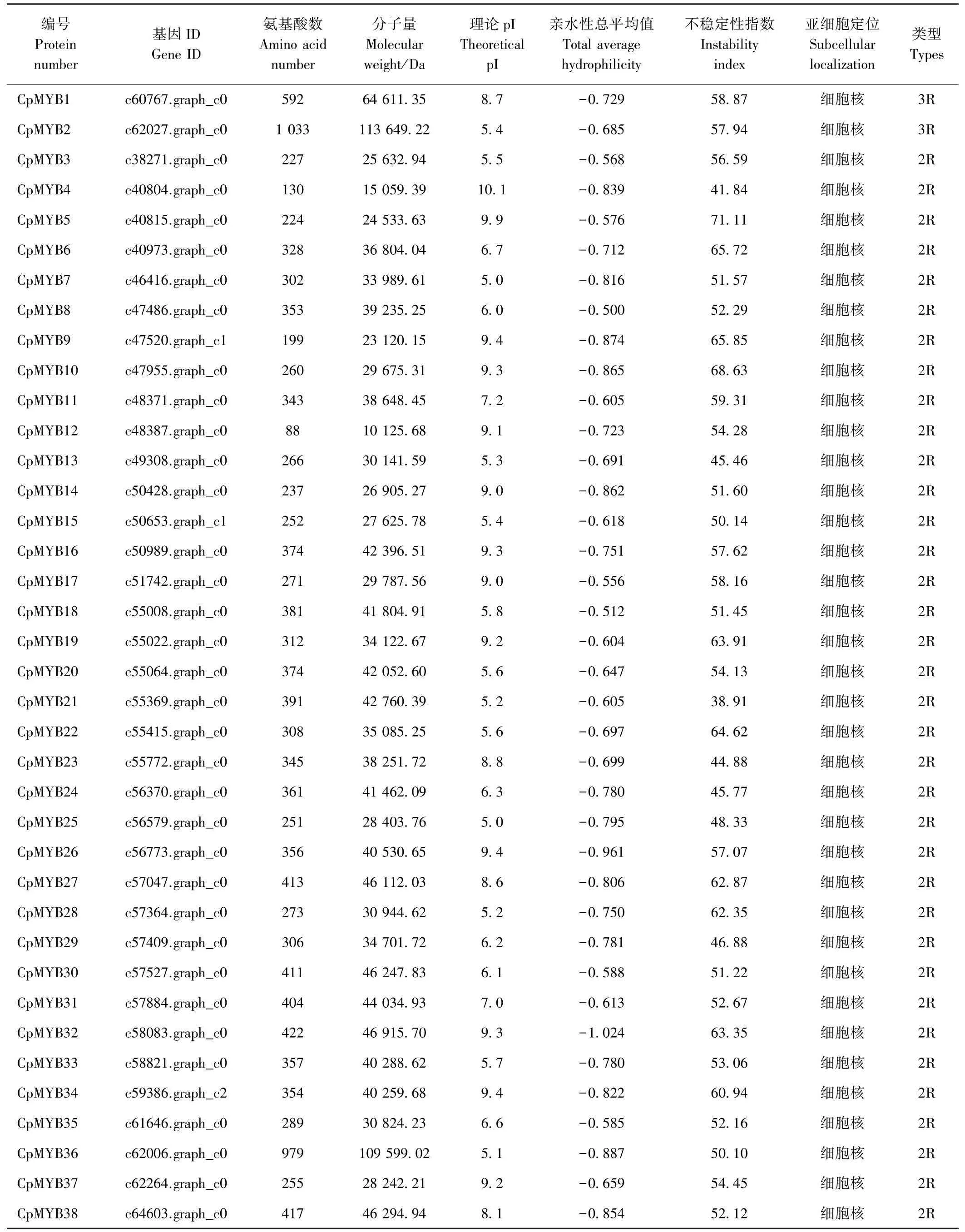
表1 山楂MYB蛋白理化性質及類型Table1 Physicochemical properties and types of MYB protein in haw thorn
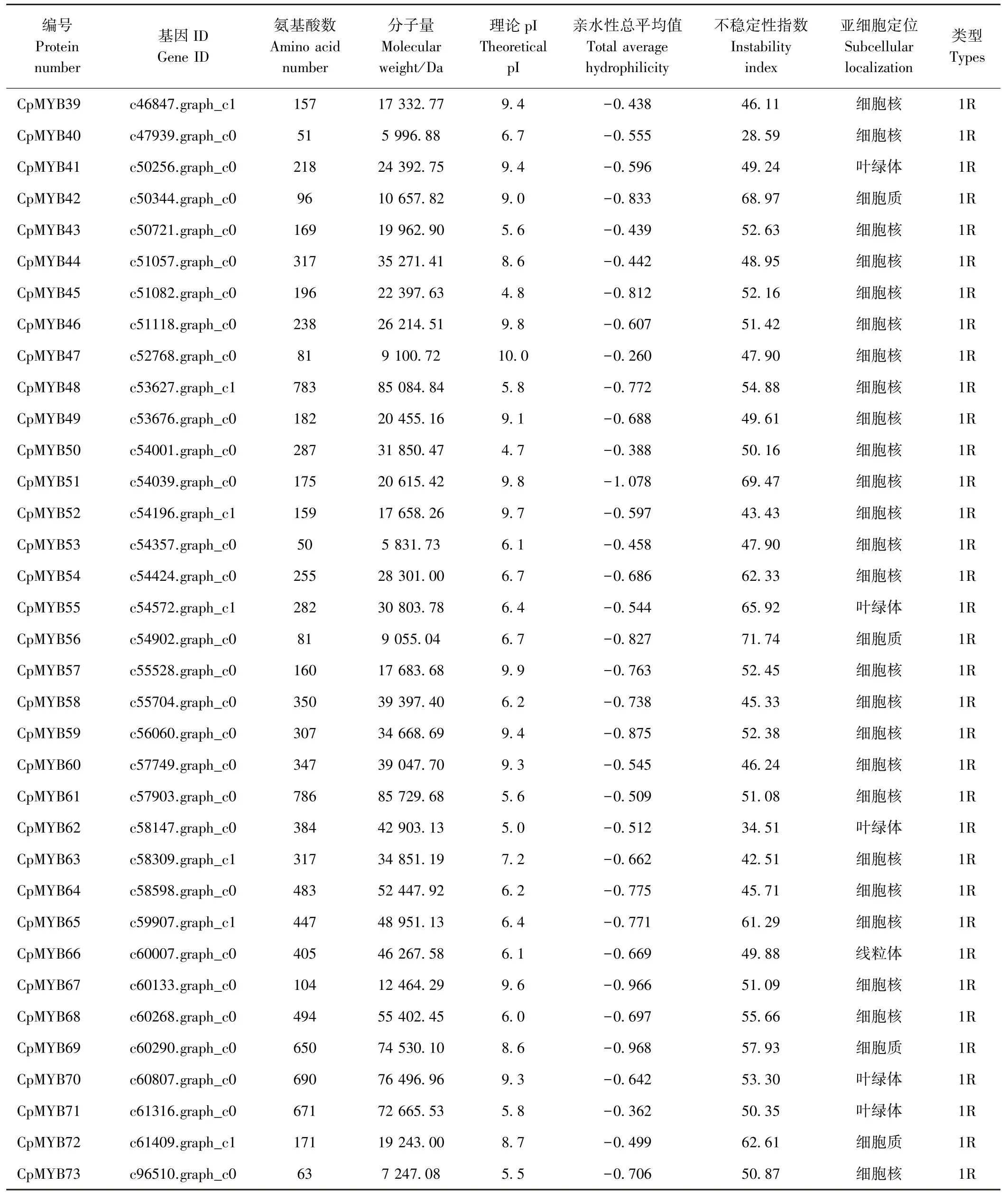
表1(續)
3R-MYB蛋白僅篩選出2個,氨基酸數量分別為592(CpMYB1)和1 033(CpMYB2),3R-MYB蛋白數量較少,無法與1R-MYB、2R-MYB進行比較,1 033個氨基酸長度是本研究中最長的蛋白。3R-MYB蛋白不穩定性指數均大于40,為不穩定蛋白。
2.3 山楂MYB基因家族蛋白motif結構分析
圖2分別為1R-MYB與2R-MYB的motif結構,且2R-MYB得到的序列長度相對較長。SMATR進一步分析表明,2R motif 4為AT hook結構,2R motif 1、2R motif 2、2R motif 3、2R motif 4、2R motif 5、1R motif 1、1R motif 2、1R motif 3均含有SANT結構,其中2R motif 5和1R motif 3同時具有MYB DNA-binding結構。
2.4 山楂MYB基因家族蛋白系統進化樹分析
利用125個擬南芥2R-MYB轉錄因子蛋白與篩選的36個2R-MYB轉錄因子共同構建系統進化樹(圖3)。根據Dubos等[7]針對擬南芥2R-MYB轉錄因子家族的系統進化樹分析結果對研究已相對明確的亞組進行編號,共找到23組,其中,共有19個山楂2RMYB轉錄因子匹配到了14個亞組中。同時,根據系統進化樹,發現7個山楂2R-MYB轉錄因子系統進化關系較遠,且具有一定的聚集性,根據距離遠近,將其分為3個新的亞組,分別為NS1(CpMYB16、CpMYB34、AtMYB91)、NS2(CpMYB29、CpMYB32、CpMYB35、CpMYB36)和NS3(CpMYB5),其中NS1包含一個擬南芥MYB轉錄因子蛋白AtMYB91。
由圖4可知,山楂1R-MYB轉錄因子可分為6個亞組,其中R1S5亞組包含的蛋白數量最少,僅有2條;R1S6亞組包含的轉錄因子數量最多,包含13條。
2.5 山楂MYB基因家族表達分析
根據山楂轉錄組數據分析(圖5),發現CpMYB73只在BF-1中表達,其余轉錄因子在2種花完全開放前后均有表達。在白色花分組BB-1 vs BB-2中,有42個轉錄因子在BB-2時期的表達量高于BB-1時期,30個轉錄因子表達量低于BB-1時期。在花色芽變分組BF-1 vs BF-2中,共有34個轉錄因子在BF-2時期表達量高于BF-1時期,39個轉錄因子表達量低于BF-1時期。在山楂花完全開放前的分組BB-1 vs BF-1中,有36個轉錄因子在BF-1時期的表達量高于BB-1時期,37個轉錄因子表達量低于BB-1時期。在山楂花完全開放后的BB-2 vs BF-2中,有28個轉錄因子在BF-2時期的表達量高于BB-2時期,45個轉錄因子表達量低于BB-2時期。
將山楂轉錄組數據按不同分組進行差異表達分析,共找到16個具有表達差異的MYB轉錄因子(圖6)。4個分組中,BB-1 vs BB-2中具有10個差異表達的轉錄因子,在4個分組中最多;BF-1 vs BF-2中只有4個具有差異表達的轉錄因子。僅CpMYB5在4個分組中都具有差異表達,且在BB-1 vs BB-2和BB-1 vs BF-1兩組中均上調表達,在BF-1 vs BF-2和BB-2 vs BF-2兩組中均下調表達。只在BB-2 vs BF-2中出現的差異表達基因數為3個,分別為CpMYB6、CpMYB41、CpMYB45,且 均 上 調 表 達。CpMYB42和CpMYB58只在BB-2 vs BF-2和BF-1 vs BF-2中出現,且這2個基因均在BF-2中上調表達。
3 討論
研究表明,MYB轉錄因子可以調控植物花青苷的生物合成,影響植物花、果、葉等多種器官的顏色[19]。曹雨薇等[20]研究發現LhMYB12和LhMYB6基因可以調控百合花被片花青素苷的含量,從而使百合花被片呈現不同的顏色。Liu等[21]發現在光誘導基因的調節下,蘋果MdMYB16和MdMYB308啟動子活性被抑制,調節了蘋果中的花色苷積累。本研究前期也發現,MYB家族的表達可以調控花青苷的積累[5],但未對MYB家族成員進行深度挖掘。本研究通過對轉錄組數據的深度挖掘,共發掘出73個MYB基因家族成員,其中35個1R-MYB,占比47.95%;36個2R-MYB,占比49.32%;2個3R-MYB,占比2.74%。其中1R-MYB占比明顯高于前人對亞洲百合[22]、小蘭嶼蝴蝶蘭[23]的研究結果,且在具有差異表達的MYB轉錄因子中也以1R-MYB為主,因此推測這些1R-MYB轉錄因子可能在花青苷的生物合成中具有一定的調控作用。
目前,擬南芥MYB轉錄因子功能的研究較為明晰。為了探究山楂2R-MYB轉錄因子的生物學功能,以擬南芥2R-MYB轉錄因子蛋白為參考進行研究,系統進化樹分析發現,36個2R-MYB蛋白中僅有19個進入了擬南芥中已被確定功能的14個亞組。一些亞組的主要作用是利于植物響應外界生物與非生物脅迫,如CpMYB23所在的S1可以響應脫落酸信號調控,并激活細胞程序化死亡[24];CpMYB24、CpMYB30所在的S11可以應對昆蟲咬傷,在傷后防止脫水[25];CpMYB22所在的S20可以調節細胞的電解質平衡;CpMYB19、CpMYB15所在的S22可在脫落酸的調節下影響氣孔的關閉[26]。還有一些亞組主要用于調控細胞的生長和發育,如CpMYB37所在的S9和CpMYB17所屬的S14,可以控制花瓣、花序以及種子的發育[27];CpMYB12所屬的S4,CpMYB20、CpMYB27所屬的S13,以及CpMYB26、CpMYB31、CpMYB38所在的S21,都具有調節木質素或纖維素生物合成的功能,影響植物細胞壁的發育[28-30]。還有諸如CpMYB13所屬的S2、CpMYB3所屬的S5以及CpMYB4所屬的S7具有影響植物原花青素、多酚及類黃酮物質生物合成的功能,協助調控植物的次生代謝[31-33]。同時,本研究還發現了3個與其他亞組關系較遠,且進化相對保守的新亞組。新亞組NS1中包含一個擬南芥MYB轉錄因子AtMYB91與兩個山楂MYB轉錄因子,根據Liu等[34]的研究,AtMYB91對細胞中KNOX表達具有負調節作用,因此NS1亞組的功能可能與其相關。關于MYB轉錄因子的研究目前主要集中于2R-MYB轉錄因子上,對1R-MYB的研究相對較少。本研究發現山楂花朵內1R-MYB轉錄因子蛋白占所有MYB轉錄因子蛋白的比例較高,且在菠蘿[6]、馬纓杜鵑[35]等物種中也存在類似現象,因此將1R-MYB轉錄因子蛋白單獨進行系統進化分析。本研究發現,35個山楂1RMYB轉錄因子蛋白可分為6個亞組,其中數量最少的亞組(R1S5)與數量最多的亞組(R1S6)可能具有相同的來源,但R1S6內進化程度更為復雜,因而推測R1S6內的MYB轉錄因子具有更豐富的生物功能。
本研究中,山楂轉錄組數據的差異表達分析表明,達到差異表達水平的轉錄因子共有16個,其中有1個3R-MYB轉錄因子,7個2R-MYB轉錄因子,8個1RMYB轉錄因子。CpMYB2和CpMYB4僅在BB-1 vs BB-2組中差異表達,BB-1與BB-2為白色花的不同時期,且均在第二時期上調表達,因而考慮其主要功能可能是調控白色花的表達或控制花的發育。進一步研究發現,CpMYB4屬于2R-MYB轉錄因子,而與其系統進化關系較近的AtMYB11[36]、AtMYB12[37]均可以調控擬南芥類黃酮生物合成,影響黃酮醇積累的作用,因此推測CpMYB4轉錄因子具有相同的生物學功能,促進了白色花的表達。CpMYB6、CpMYB41、CpMYB45三個轉錄因子只單獨出現在BB-2 vs BF-2組中,且上調表達,由于該分組為芽變品種花朵完全開放前后兩個時期的對比,且在完全開放前后花朵顏色發生了變化,因此這三個轉錄因子極有可能在山楂花色表達過程中起到調控作用。通過前人研究,AtMYB26、AtMYB103在花藥發育、細胞壁合成和分解、木質素生物合成等方面具有調控作用[38-39],而CpMYB6在系統進化關系上與其相近,因而推測CpMYB6與其具有類似的生物功能。研究發現,CpMYB56僅在BB-1 vs BF-1組中具有表達差異,該組為正常山楂和芽變山楂花朵開放初始階段,雖然并無明顯顏色變化,但其可能參與花朵顏色變化前期的生理過程,調控機制還需要進一步研究確認。本研究未發現單獨在BF-1 vs BF-2組中差異表達的轉錄因子,但是發現了2個只在BB-2 vs BF-2組和BF-1 vs BF-2組的交集中差異表達的轉錄因子,分別是CpMYB42、CpMYB58,且均在BF-2中上調表達,因此CpMYB42和CpMYB58也極有可能調控山楂花色的形成。CpMYB29僅在BB-1 vs BB-2組和BF-1 vs BF-2組中差異表達,由于這兩組均能體現山楂花開放的過程,因而猜測該轉錄因子可能與花的生長發育相關。CpMYB22、CpMYB48、CpMYB64均在BB-1 vs BB-2組中下調表達,在BB-2 vs BF-2組中上調表達,與CpMYB22系統進化關系交近的AtMYB2主要可以增強植物細胞的分裂與分化[40],因此推測CpMYB22可能也具有相同的生物學功能。CpMYB11、CpMYB12和CpMYB65均在BB-1 vs BB-2組與BB-1 vs BF-1組中下調表達,由于CpMYB12與AtMYB4系統進化關系較近,而AtMYB4可能參與抑制木質素合成,調控黃酮類化合物合成的功能[41],因而CpMYB12可能也具有相同的生物學功能,而CpMYB11的功能還有待進一步深入研究。
4 結論
本研究利用生物信息學方法深度挖掘了山楂轉錄組數據中的MYB基因家族成員,共篩選出73個MYB轉錄因子,其中35個為1R-MYB成員,36個為2RMYB成員,2個為3R-MYB成員。通過進一步分析,將篩選出的2R-MYB轉錄因子按照擬南芥已有的研究基礎進行分類,其中有19個山楂2R-MYB蛋白被匹配到14個在擬南芥已具有一定研究基礎的亞組中,同時還利用系統進化樹分析的手段,將篩選出的1R-MYB轉錄因子分為了6個亞組。根據轉錄組數據進行差異表達分析,發現CpMYB4、CpMYB6、CpMYB12、CpMYB41、CpMYB42、CpMYB45、CpMYB56、CpMYB58等8個轉錄因子可能具有調控山楂花色的功能。本研究為進一步研究影響山楂花色的MYB轉錄因子提供了參考。

