黃秋葵實時熒光定量PCR內參基因的克隆與篩選評價
李永平 葉新如 王 彬 陳敏氡 劉建汀 朱海生 溫慶放
(福建省蔬菜遺傳育種重點實驗室/福建省農業科學院作物研究所/福建省農業科學院蔬菜研究中心/福建省蔬菜工程技術研究中心,福建 福州 350013)
黃秋葵(HibiscusesculentusL.)屬于秋葵屬,其嫩果可食用,含有豐富的蛋白質、維生素及礦物鹽、多糖聚合體等營養物質,是一種具有較高營養價值、保健功能的新型蔬菜[1-2],已成為許多國家運動員的首選蔬菜[3]。
實時熒光定量PCR(quantitative real-time PCR,RT-qPCR)能夠精確定量復雜混合物中特定核酸,是定量分析各種目的基因和基因表達量的重要技術手段[4]。影響RT-qPCR分析結果準確性的因素包括RNA質量、內參基因及引物特異性等[5],其中內參基因的穩定性對其結果影響最大。因此,有必要選擇表達穩定的內參基因對目標基因表達量進行校正和標準化[6]。然而,內參基因在不同試驗要求下表達可能出現差異[7-8],因此根據不同物種和不同試驗要求篩選能穩定表達的內參基因對基因定量分析具有重要的意義。
肌動蛋白基因(actin,ACT)、18S核糖體RNA基因(18S ribosomal RNA,18SrRNA)、真核生物延伸因子(elongation factor 1 alpha,EF-1α)、甘油醛-3-磷酸-脫氫酶基因(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、α-微管蛋白基因(α-tubulin,TUA)和β-微管蛋白基因(β-tubulin,TUB)等看家基因常被作為內參基因[9-11]。目前,國內外關于黃秋葵內參基因的篩選及表達分析鮮有報道,僅王旭等[12]發現,研究黃秋葵查爾酮合成酶基因(chalcone synthase,AeCHS)表達時應選用陸地棉β-actin(FJ560483.1)為內參基因。因此,本研究根據黃秋葵RNA-seq數據庫,篩選并驗證獲得18SrRNA、ACT、EF-1α、TUA、TUB、GAPDH等基因開放閱讀框(open reading frame,ORF)序列;以綠白1號的不同組織、不同發育時期果實、葉片及不同脅迫條件下的葉片為材料,利用RT-qPCR測定基因表達量,結合GeNorm、NormFinder和BestKeeper軟件評價6個內參基因表達的穩定性,旨在篩選適合的黃秋葵內參基因,為黃秋葵相關基因表達研究奠定基礎。
1 材料與方法
1.1 試驗材料
1.1.1 植物材料 黃秋葵,為福建省農業科學院作物研究所選育的綠白1號,種植于福建省農業科學院作物研究所蔬菜科研基地。待幼苗長至三葉一心時移入培養箱進行脅迫處理。
脅迫處理試驗分為3組,分別為低溫(A組)、高溫(B組)和干旱處理組(C組);正常栽培條件下,分別采集盛果期不同組織(D組)、葉不同發育時期(E組)和果實不同發育時期(F組)的樣品,分析脅迫處理組和正常栽培條件下黃秋葵18SrRNA、TUB、ACT、GAPDH、EF-1α和TUA基因的表達情況。采樣后液氮冷凍,-80℃保存。試驗處理及樣品見表1。

表1 黃秋葵試驗處理樣品Table1 Test sample and treatments of Hibiscus esculentus L.
1.1.2 主要試劑與數據分析來源 通用植物總RNA提取試劑盒購自北京百泰克生物技術有限公司;RNA反轉錄試劑盒(PrimeScriptTM 1st Strand cDNA)、Taq DNA Polymerase、dNTPs、pMD18-T simple,購自寶生物工程(大連)有限公司;膠回收試劑盒、質粒提取試劑盒購自瑞士Omega公司;引物合成和測序由尚亞生物技術(福州)有限公司完成。
黃秋葵RNA-seq數據庫由廣州基迪奧生物科技有限公司采用Illumina HiSeq TM 2500 PE125系統對福建省農業科學院作物研究所黃秋葵種質資源庫中的綠色黃秋葵資源(全株及嫩果均為綠色,果實六棱至八棱,以六棱為主)進行轉錄組測序獲得。
1.2 方法
1.2.1 引物設計 對黃秋葵RNA-seq所得數據進行過濾、拼接和組裝,并在NCBI中進行功能注釋(E值<10-5)[13-14]。根據黃秋葵RNA-seq數據庫的功能注釋,在NCBI上比對含有完整ORF,且與其他作物的同源性高,篩選得到18SrRNA、ACT、EF-1α、TUA、TUB和GAPDH基因全長序列,應用Primer Express 3.0軟件分別設計其基因ORF擴增引物、熒光定量特異引物(表2)。

表2 6個內參基因ORF擴增及定量表達引物序列Table2 ORF amplification and quantitative expression primer sequence of six internal reference genes
1.2.2 黃秋葵基因的ORF擴增 應用反轉錄試劑盒將黃秋葵各處理材料的總RNA反轉錄形成cDNA第一鏈。PCR反應體系(25μL):50 ng·μL-1cDNA 2μL、正反引物(10μmol·L-1)各1μL、10 mmol·L-1dNTP 0.5μL、5 U Taq酶0.3μL、1.5mmol·L-1MgCl2的10×PCR緩沖液2.5μL,超純水補足至25μL。PCR反應程序見表3。PCR擴增產物采用0.8%瓊脂糖電泳檢測,回收目的片段,轉化并測序。
1.2.3 常規PCR檢測定量引物 以反轉錄的黃秋葵cDNA為模板,用1.2.1中設計的熒光定量PCR引物進行常規PCR檢測。PCR反應體系同1.2.2,PCR反應程序見表3第2個程序。PCR擴增產物采用1.8%瓊脂糖電泳檢測。
1.2.4 實時熒光定量PCR檢測定量引物 定量檢測使用SYBR?Premix Ex TaqTM熒光定量PCR試劑盒(TakaRa公司,大連)。反應體系(20μL):10μL Power SYBR?Green PCR Master Mix、2μL cDNA、正、反向引物各0.5μL(濃度為10μmol·L-1),用蒸餾水補足至20 μL。3個重復,反應程序見表3第3個程序。
1.2.5 基因表達穩定性分析 利用熒光定量PCR分析基因表達穩定性。以陸地棉β-actin(FJ560483.1)為內參基因,將試驗的29個黃秋葵樣品cDNA采用SYBR Green染料法進行實時熒光定量PCR分析,反應體系同1.2.4,反應程序見表3第4個程序。每個反應設3個重復,采用2-ΔΔCt法計算目的基因的相對表達情況。
1.3 數據分析
采用GeNorm、NormFinder和BestKeeper軟件分析6個內參基因表達的穩定性。GeNorm軟件中,內參基因平均表達穩定值(M)越小穩定性越高;ⅤN/ⅤN+1值確定最適內參基因數量,若ⅤN/ⅤN+1值<0.15,則最適內參基因的數量是N個,當ⅤN/ⅤN+1值>0.15時,最適內參基因的數量為N+1個[15]。NormFinder軟件對基因穩定性評定是根據基因表達穩定值(S),S值越小基因穩定性越好[16]。BestKeeper軟件中,標準偏差(standard deviation,SD)>1時,該內參基因表達不穩定;SD<1時,變異系數(coefficient of variation,CV)越小,內參基因穩定性越高[17]。
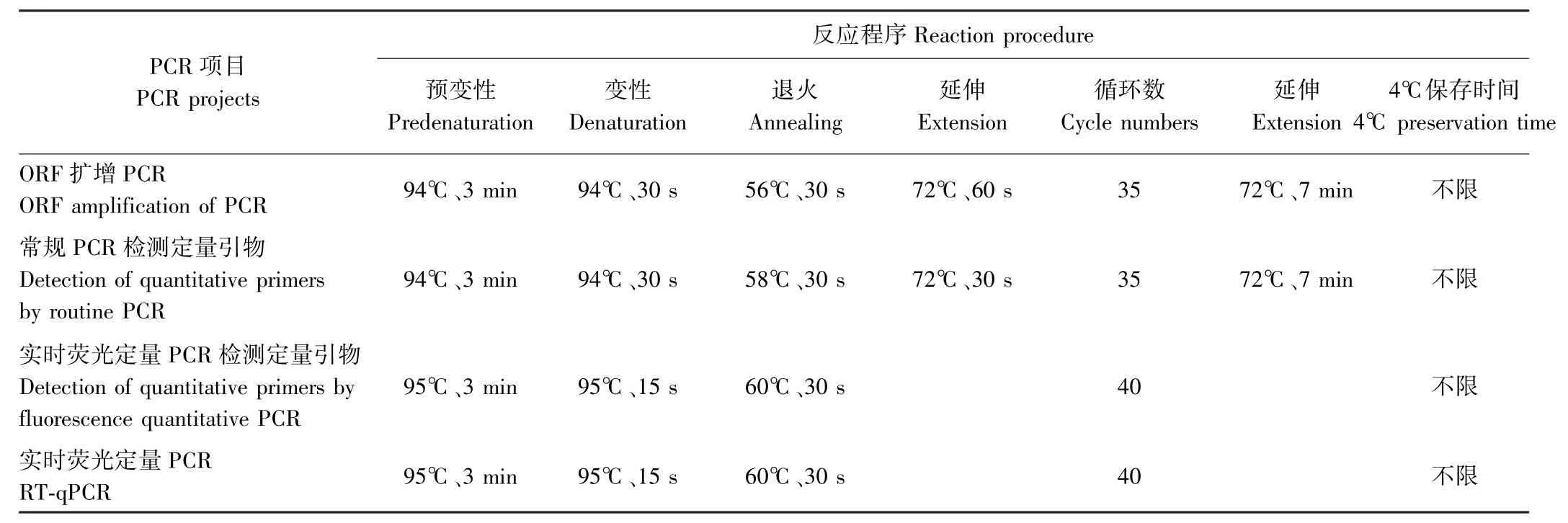
表3 PCR反應程序Table3 PCR reaction procedure
2 結果與分析
2.1 黃秋葵內參基因擴增結果
從黃秋葵果實轉錄組測序的RNA-seq數據庫中篩選得到ACT、TUB、18SrRNA、TUA、EF-1α、GAPDH基因全長序列,設計各基因ORF引物進行驗證(圖1)。經回收、連結、轉化、測序,結果表明,ACT、TUB、18SrRNA、TUA、EF-1α、GAPDH基因的ORF大小分別為1 134、1 338、1 464、1 353、1 407、1 455 bp。
2.2 基因引物設計及常規PCR檢測
依據ACT、TUB、18SrRNA、TUA、EF-1α和GAPDH基因ORF序列,各基因設計出一對熒光定量特異引物,用PCR檢測引物特異性,結果表明(圖2),6個內參基因擴增產出大小與預期相符的單一條帶,表明所設計引物無二聚體、特異性強,可用于RT-qPCR研究。
2.3 實時熒光定量PCR檢測引物
以黃秋葵嫩葉cDNA為模板,6對引物RT-qPCR擴增結果顯示,3次重復的RT-qPCR擴增曲線較一致(圖3)。各基因的融解曲線(圖4)顯示3次重復的平均溶解溫度(melting temperature,Tm)基本一致,都只有一個特異峰,無引物二聚體,無非特異性擴增,表明試驗設計的引物特異性優、重復性好,可作為黃秋葵RT-qPCR的引物。
2.4 基因表達穩定性分析
由圖5可知,各處理組黃秋葵樣品中18SrRNA、ACT、EF-1α、TUA基因的相對表達量無顯著差異,而在高溫處理下GAPDH基因的相對表達量有差異,在黃秋葵各組織、果莢發育不同時期、低溫處理、干旱處理下TUB基因的相對表達量均差異較大,表明18SrRNA、ACT、EF-1α、TUA基因在黃秋葵不同組織、果莢發育、葉發育,以及各種脅迫下均能較穩定地表達。
2.5 內參基因CT值分析
6個基因CT(cycle threshold)值在14.02~32.12之間,表達豐度分布范圍廣,其中18SrRNA的低于其他內參基因CT值,且數值集中;EF-1α、ACT、GAPDH、TUA的CT值在16.20~23.83之間,表達豐度居中,除GAPDH外數值較集中;TUB的CT值最大且變化較大,表達量最低(圖6)。從各基因在不同處理下CT值分布來看,在黃秋葵不同組織中EF-1α、18SrRNA、ACT的CT值比較穩定,TUA、GAPDH的CT值略有變化,TUB的CT值變化較大(圖7-A);果莢發育過程中除TUB的CT值有較大變化外,其他5個基因的CT值都相對穩定(圖7-B);葉發育過程中,6個基因的CT值都相對穩定(圖7-C);低溫處理和干旱處理時GAPDH、TUB的CT值變化較大(圖7-D、F);干旱處理時GAPDH的CT值變化較大(圖7-E)。由此可初步判斷,18SrRNA、EF-1α、ACT和TUA表達較為穩定,GAPDH和TUB表達差異較大。
2.6 黃秋葵內參基因的篩選
GeNorm軟件的配對差異值(ⅤN/ⅤN+1)用于確認所需內參基因的最適數目,以降低單一內參基因引起的偏差和波動。由圖8可知,在盛果期不同組織、果實不同發育時期、葉不同發育時期、低溫脅迫和高溫脅迫、干旱脅迫下,均有Ⅴ2/Ⅴ3值小于0.15,因此,各試驗組的最適內參基因數均為2個。
2.6.1 盛果期不同組織、果莢發育、葉發育時期黃秋葵內參基因表達的篩選 由表4可知,經GeNorm程序分析,在黃秋葵盛果期各組織中6個內參基因表達穩定值(M)排序為EF-1α=18SrRNA<TUA<ACT<GAPDH<TUB;果莢不同發育時期M值排序為EF-1α=ACT<TUA<GAPDH<TUB;葉不同發育時期M值排序為18SrRNA=ACT<EF-1α<GAPDH<TUA<TUB。經NormFinder軟件分析,黃秋葵盛果期不同組織中6個內參基因S值排序為18SrRNA<EF-1α<ACT<TUA<GAPDH<TUB;果莢不同發育時期6個內參基因S值排序為EF-1α<ACT<18SrRNA<TUA<GAPDH<TUB;葉不同發育時期6個內參基因穩定值(S)排序為EF-1α<18SrRNA=ACT<GAPDH<TUA<TUB。經BestKeeper軟件分析,黃秋葵盛果期不同組織中表達穩定性18SrRNA>EF-1α>ACT>TUA>GAPDH>TUB,其中GAPDH和TUB穩定性差,不可用;果莢不同發育時期EF-1α>ACT>18SrRNA>TUA>GAPDH>TUB,其中TUB穩定性差,不可用;葉不同發育時期18SrRNA>ACT>EF-1α>GAPDH>TUA>TUB。
2.6.2 不同脅迫處理下黃秋葵內參基因的篩選 由表5可知,經GeNorm程序分析,黃秋葵低溫脅迫不同時段的M值排序為EF-1α=18SrRNA<ACT<TUA<GAPDH<TUB;高溫脅迫不同時段M值排序為EF-1α=TUA<18SrRNA<ACT<TUB<GAPDH;干旱脅迫不同時段M值排序為EF-1α=18SrRNA<TUA<ACT<GAPDH<TUB。根據NormFinder軟件分析結果可知,在4℃低溫脅迫條件下6個內參基因S值排序為ACT<18SrRNA<EF-1α<TUA<GAPDH<TUB;42℃高溫脅迫條件下6個內參基因S值排序為EF-1α<TUA=18SrRNA<ACT<TUB<GAPDH;干旱脅迫條件下6個內參基因S值排序為18SrRNA<EF-1α<TUA<ACT<GAPDH<TUB。BestKeeper軟件直接利用CT值進行數據分析,結果表明,在低溫脅迫條件下穩定性ACT>18SrRNA>EF-1α>TUA>GAPDH>TUB,TUB穩定性差,不可用;高溫脅迫條件下穩定性EF-1α>TUA>18SrRNA>ACT>TUB>GAPDH,GAPDH穩定性差;干旱脅迫條件下穩定性18SrRNA>EF-1α>TUA>ACT>GAPDH>TUB,TUB穩定性較差。
采用GeNorm、NormFinder和BestKeeper軟件分析全部29個黃秋葵樣品,結果顯示,18SrRNA、EF-1α、ACT均排名前三,且數值較低,適合作為黃秋葵熒光定量分析的內參基因;TUA居第四名,穩定性尚好,亦可選用;GAPDH和TUB居末位,穩定性較差,不宜選用。
3 討論
目前,RT-qPCR是基因表達分析主要工具,是明確植物基因功能和調控機制的重要途徑。然而,樣品自身差異、RNA質量等會導致分析結果出現誤差。為提高結果可靠性,引入內參基因校正表達數據。內參基因穩定性直接嚴重影響RT-qPCR分析結果準確度[18]。研究表明,內參基因在不同脅迫和不同組織表達會出現變化[19-20]。因此,應根據試驗要求選擇最適宜的內參基因或組合。本研究利用GeNorm、NormFinder和BestKeeper軟件分析黃秋葵6個看家內參基因在低溫、高溫、干旱脅迫處理不同時間和正常處理盛果期不同組織、果實不同發育時期、葉不同發育時期表達的穩定性結果不同處理和發育時期表達最穩定的基因不盡相同。

表4 不同軟件分析6個內參基因在黃秋葵盛果期不同組織、果莢不同發育時期、葉不同發育時期表達穩定性Table4 Expression stability of the 6 reference genes under different different tissues during the fruit period,fruit developmen and leaf development conditions by software analysis
前人對非生物脅迫條件下植物中內參基因已有研究報道。葉新如等[21]研究表明,冬瓜(Benincasa hispidaCogn.)高溫、干旱脅迫的內參基因是TUA,而EF-1α適合于低溫脅迫;肖翠等[22]研究發現柑橘(CitrusL.)在干旱脅迫下GAPDH、18SrRNA表達最穩定,而在低溫脅迫下ACT、18SrRNA表達穩定;Lovdal等[23]研究表明,番茄(LycopersiconesculentumMill.)在低溫脅迫下EF-1α和RPLA表達穩定,GAPDH穩定性最差;龐強強等[24]發現茄子(SolanummelongenaL.)在高溫脅迫下表達穩定性最好的是SmEF1a;杜輝輝[25]發現Ha18SrRNA、HaTUA5及HaUBQ10是梭梭(Haloxylonammodendron)干旱脅迫下最適內參基因;EF-1α是茅蒼術(RhizomaAreactylodisLanceae)在干旱脅迫下最佳內參基因[26]。本研究結果表明,黃秋葵在高溫脅迫下EF-1α表達穩定性最好,這與龐強強等[24]在茄子上的研究結果一致;干旱脅迫下黃秋葵18SrRNA表現最為穩定,杜輝輝[25]在梭梭上也得到此結果;低溫脅迫下黃秋葵ACT表達穩定與柑橘[22]、花椰菜(BrassicaoleraceaL.)[27]的研究結果一致。

表5 不同軟件分析不同脅迫條件下黃秋葵6個內參基因的表達穩定性Table5 Expression stability of the 6 reference genes under different stress conditions by software analysis
本研究中,黃秋葵根、莖、葉等不同組織最適內參基因為EF-1α和18SrRNA,與鐵皮石斛(Dendrobiumofficinale)的相關研究一致[28],冬瓜不同組織中EF-1α表達穩定性最好[21],核桃(Juglans regia)EF-1α和GAPDH在不同組織和發育時期中表達最穩定[29];在印度南瓜不同組織中EF-1α表達穩定[30]。EF-1α在黃秋葵果實不同發育時期的表達最穩定,而獼猴桃果實不同發育時期18SrRNA表達最穩定[31],這可能與試驗材料的物種、內參基因篩選范圍不同有關。
內參基因穩定性分析與篩選,是得到準確基因表達分析結果的必要前提。基因穩定性分析常用GeNorm、NormFinder和BestKeeper軟件。GeNorm原則是2個穩定內參基因的表達水平在試驗樣品中一致,根據ⅤN/ⅤN+1值確定最適內參基因個數,并選出最優組合,以校正系統偏差,從而獲得更可靠的表達分析結果,對于研究基因表達的細微變化具有極其重要的意義[32]。NormFinder可分析內參基因表達的穩定性,還能比較目標基因的表達水平。本試驗利用GeNorm、NormFinder和BestKeeper軟件分析黃秋葵6個內參基因的穩定性及表達水平,分析結果略有不同,這種不一致性可能是由于計算機軟件的統計學算法不同及試驗數據的誤差引起的。
4 結論
本研究克隆獲得黃秋葵18SrRNA、ACT、EF-1α、TUA、TUB、GAPDH基因全長序列,分析了這6個基因在黃秋葵盛果期不同組織、果實不同發育時期、葉不同發育時期,以及不同脅迫下的表達水平,結合GeNorm、NormFinder和BestKeeper軟件評價其表達穩定性,結果表明,各處理中18SrRNA、EF-1α、ACT表達均較為穩定,GAPDH表達穩定性較差,TUB的表達穩定性最低。本研究結果對于黃秋葵的基因表達等相關分子生物學研究具有借鑒意義。

