miR-140靶向PD-L1在小鼠膿毒癥免疫抑制中的作用*
周超 溫天明 胥麗 劉杰 鄔昊 李釗
(1.成都市第一人民醫院急診科,四川 成都 610094;2.重慶醫科大學附屬第二醫院肝膽外科,重慶 400010)
膿毒癥(sepsis)是由感染引起的全身炎癥反應綜合征(systemic inflammatory response syndrome,SIRS),是重癥加強護理病房患者常見的并發癥之一,具有很高的致死率[1-2]。當膿毒癥發作時,患者體內首先發生了過度的炎癥反應,致多器官衰竭以及內皮功能紊亂,進而導致患者死亡[3-4]。過去數十年的研究主要集中在通過抗炎治療控制過度炎癥反應造成的損害,然而當患者渡過了初期的過度炎癥反應,隨后進入持久性的免疫抑制階段,無法抵御原發感染或二次感染,造成了患者在該階段的死亡[5-7]。對膿毒癥誘導免疫機制的研究發展做出了激發患者免疫功能恢復的全新治療理論[8],程序性死亡受體1/配體1(programmed cell death protein 1/programmed cell death ligand 1,PD-1/PD-L1)通路在宿主和病原作用的免疫調節中起著相當重要的作用,同時PD-L1也是膿毒癥免疫抑制的關鍵基因[9-10]。miR-140是一種microRNA,可靶向作用與目標基因3′UTR區域調控基因表達,一些癌癥方面的研究表明miR-140和PD-L1存在靶向作用關系[11-12],而miR-140是否通過靶向作用PD-L1還未見報道。本研究通過盲腸結扎穿孔法(cecal ligation and puncture,CLP)建立小鼠膿毒癥模型,探討miR-140靶向PD-L1在小鼠膿毒癥免疫抑制中的作用,現將結果報告如下。
1 材料與方法
1.1 實驗材料 腫瘤壞死因子α(tumor necrosis factor α,TNF-α)、白細胞介素2(interleukin-2,IL-2)ELISA試劑盒、PD-L1-APC抗體、CD4-FITC/CD8-PE抗體(美國eBioscience公司);miR-140 agomir、miR-140 mimic、mimic NC(上海吉瑪制藥技術有限公司);實驗所用引物由北京擎科生物科技有限公司提供,Trizol提取液、RIPA裂解液、ECL顯色液(北京索萊寶生物技術有限公司);反轉錄和SsoFastTMEva-Green?Supermix試劑盒(美國Bio-rad公司);PD-L1一抗、辣根過氧化物酶標記二抗(美國Santa Cruz公司)。
1.2 實驗動物 7~8周齡SPF級C57BL/6J雄性小鼠,體質量20~25 g,由成都達碩實驗動物有限公司提供。實驗前于20~22 ℃環境下適應性喂養一周,期間食物和水自由攝取。
1.3 方法
1.3.1 動物分組及模型建立 取90只小鼠隨機分成對照組(Control組)、膿毒癥模型組(CLP組)和CLP+miR-140組,每組各30只。1%~3%異氟烷吸入麻醉小鼠,下腹部酒精消毒,其中CLP組和CLP+miR-140組使用手術刀沿腹部正中縱切約2 cm的切口,于腹腔中取出盲腸進行低位結扎,使用23號針對腸系膜側向對側進行穿孔,擠出少量糞便,盲腸放回原位后關腹,皮下注射1 mL生理鹽水補充體液流失,在加熱墊上保持溫度支持小鼠蘇醒;Control組切開腹部后即行縫合處理。即日起CLP+miR-140組小鼠腹腔注射給予80 μg miR-140 agomir,連續5周,每周2次,每組各取20只小鼠于30 d內每天對小鼠死亡事件進行統計,另外10只處死做檢測。
1.3.2 ELISA檢測血清炎癥細胞因子水平 各組小鼠于1、7、14 d時分別進行尾靜脈取血,按照ELISA試劑盒提供的操作說明檢測血液中TNF-α、IL-2濃度。
1.3.3 流式細胞術檢測PD-L1細胞及CD4+和CD8+T細胞 將14 d時的血液樣品收集在無菌的含EDTA的血管中,然后在黑暗中于4 ℃下用0.5 μg所需的熒光團結合的Ab或同種型對照染色30 min,然后用流式細胞儀洗滌兩次緩沖液并固定在1%多聚甲醛中。流式細胞儀分析獲取熒光數據。
1.3.4 RT-PCR檢測基因表達 用Trizol試劑盒提取各組細胞的總RNA,反轉錄合成cDNA,根據SsoFastTMEva-Green?Supermix試劑盒提供的方法進行PCR,反應條件設置為95℃ 30 s,95 ℃ 15 s和60 ℃ 1 min 40個循環,2-ΔΔCt法計算相對表達水平。
1.3.5 Western blot檢測蛋白表達 用RIPA試劑提取各組細胞的總蛋白,并用BCA試劑盒定量,樣品量為每孔20 μg,樣品通過10%SDS-PAGE分離并轉至PVDF膜上,5%脫脂牛奶封閉2 h,加入一抗在4 ℃孵育過夜,添加適量二抗,于第二天孵育2 h,添加ECL顯色液進行曝光顯影,凝膠成像儀拍照分析條帶灰度進行相對定量。
1.3.6 熒光素酶報告實驗檢測miR-140和PD-L1靶向作用關系 分別構建PD-L1 pGL3熒光素酶啟動子野生型(WT)和突變型(MUT)載體和miR-140 mimic、mimic NC分別共轉染細胞,轉染48 h后進行熒光素酶活性檢測。
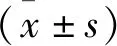
2 結果
2.1 膿毒癥免疫抑制對炎癥細胞因子水平的影響 與Control組比較,CLP組小鼠1 d血清炎癥細胞因子TNF-α、IL-2水平均升高,差異有統計學意義(P<0.01);與CLP組1 d比較,CLP組小鼠14、21、28 d血清炎癥細胞因子TNF-α、IL-2水平均降低,差異有統計學意義(P<0.01),見表1。
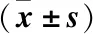
表1 CLP小鼠炎癥細胞因子TNF-α和IL-2水平Table 1 Levels of inflammatory cytokines TNF-α and IL-2 in CLP mice
2.2 miR-140對CLP小鼠炎癥細胞因子的影響 與Control組比較,CLP組小鼠血清TNF-α和IL-2水平升高,差異均有統計學意義(P<0.01);與CLP組比較,CLP+miR-140組小鼠血清TNF-α和IL-2差異均無統計學意義(P>0.05),見表2。
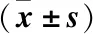
表2 miR-140對CLP小鼠炎癥細胞因子TNF-α和IL-2的影響Tab.2 Effect of miR-140 on inflammatory cytokines TNF-α and IL-2 in CLP mice
2.3 miR-140改善CLP小鼠生存率 造模24 h后,CLP組及CLP+miR-140組小鼠出現精神萎靡不振,行動遲緩,對外界刺激反應減弱、顫栗、腹瀉等膿毒癥表現,而對照組無此類表現。選取20只小鼠行生存率統計。與Control組比較,CLP小鼠30天生存率降低,差異有統計學意義(P<0.01);與CLP組比較,CLP+miR-140組小鼠生存率升高,差異有統計學意義(P<0.01),見圖1。

圖1 miR-140改善CLP小鼠30天生存率(n=20)Figure 1 miR-140 improved 30-day survival of CLP mice注:與Control組比較,①P<0.01;與CLP組比較,②P<0.01
2.4 miR-140提高CD4+和CD8+T淋巴細胞水平 與Control組比較,CLP組小鼠外周血CD4+和CD8+T淋巴細胞水平升高,差異有統計學意義(P<0.01);與CLP組比較,CLP+miR-140組小鼠CD4+和CD8+T淋巴細胞水平進一步升高,差異有統計學意義(P<0.01),見圖2。

圖2 miR-140提高CLP小鼠CD4+和CD8+ T淋巴細胞比率(n=10)Figure 2 miR-140 increased the ratio of CD4+ &CD8+ T lymphocytes in CLP mice注:與Control組比較,①P<0.01;與CLP組比較,②P<0.01
2.5 miR-140抑制CLP小鼠腹膜PD-L1陽性巨噬細胞水平 與Control組比較,CLP組小鼠腹膜巨噬細胞PD-L1陽性細胞率升高,差異有統計學意義(P<0.01);與CLP組比較,CLP+miR-140組小鼠腹膜巨噬細胞PD-L1陽性細胞率降低,差異有統計學意義(P<0.01),見圖3。

圖3 miR-140對PD-L1陽性巨噬細胞百分率的抑制作用(n=3)Figure 3 Inhibition of miR-140 on the percentage of PD-L1 positive macrophages注:與Control組比較,①P<0.01;與CLP組比較,②P<0.01
2.6 miR-140抑制CLP小鼠腹膜巨噬細胞PD-L1基因表達 通過RT-qPCR對各組小鼠腹膜巨噬細胞miR-140和PD-L1基因表達水平進行檢測結果表明,與Control組比較,CLP組小鼠腹膜巨噬細胞中miR-140表達水平降低,PD-L1表達水平升高,差異均有統計學意義(P<0.01);與CLP組比較,CLP+miR-140組小鼠腹膜巨噬細胞miR-140表達水平升高,PD-L1表達水平降低,差異均有統計學意義(P<0.01),見圖4。

圖4 miR-140對CLP小鼠腹膜巨噬細胞PD-L1基因表達的抑制作用(n=3)Figure 4 Inhibition of miR-140 on PD-L1 gene expression in peritoneal macrophages of CLP mice注:與Control組比較,①P<0.01;與CLP組比較,②P<0.01
2.7 miR-140抑制CLP小鼠腹膜巨噬細胞PD-L1蛋白表達 與Control組比較,CLP組小鼠腹膜巨噬細胞中PD-L1蛋白水平升高,差異有統計學意義(P<0.01);與CLP組比較,CLP+miR-140組小鼠腹膜巨噬細胞中PD-L1蛋白水平降低,差異有統計學意義(P<0.01),見圖5。

圖5 miR-140對CLP小鼠腹膜巨噬細胞PD-L1蛋白表達的抑制作用(n=3)Figure 5 Inhibition of miR-140 on PD-L1 protein expression in peritoneal macrophages of CLP mice注:與Control組比較,①P<0.01;與CLP組比較,②P<0.01
2.8 熒光素酶報告實驗驗證miR-140和PD-L1靶向作用關系 與PD-L1 WT+mimic NC比較,PD-L1 WT+miR-140細胞熒光素酶活性降低,差異有統計學意義(P<0.01);PD-L1 MUT+mimic NC和PD-L1 MUT+miR-140細胞相比熒光素酶活性無顯著差異(P>0.05),見圖6。

圖6 熒光素酶報告實驗驗證miR-140和PD-L1靶向作用關系(n=3)Figure 6 Luciferase reporting assay verified the targeting relationship between miR-140 and PD-L1注:與PD-L1 WT+mimic NC比較,①P<0.01
3 討論
程序性死亡受體1(PD-1),是一種重要的免疫抑制分子,主要存在于CD4和CD8 T細胞表面,程序性死亡配體1(PD-L1)和程序性死亡配體2(PD-L2)是PD1的天然配體。當PD1和配體結合時,會對T細胞的活化發揮抑制作用[13-14]。PD-L1在諸如巨噬細胞、DC細胞、中性粒細胞以及癌細胞中均有表達,有研究表明PD-L1參與了膿毒癥免疫抑制的機制[15-16]。Zhang等[17]研究表明PD-L1阻滯可減少膿毒癥小鼠淋巴細胞凋亡和單核細胞功能失調而提高其生存率;Wang等[18]研究表明PD-L1在膿毒癥小鼠中性粒細胞中上調引起免疫抑制。因此,基于阻滯PD-L1的促進患者免疫功能恢復治療成為膿毒癥一種全新的治療思路。miR-140是一種小分子非編碼RNA,在Dong等[12]的研究中發現了miR-140在宮頸癌中同PD-L1靶向作用關系,而在Xie等[11]的研究中同樣發現miR-140靶向PD-L1對非小細胞肺癌增殖產生影響。過去已有研究報道了miR-140與膿毒癥存在聯系[19],本研究為探究miR-140靶向PD-L1對膿毒癥免疫抑制的影響,建立CLP小鼠膿毒癥模型進行試驗,并延長觀察時間以確保免疫抑制狀態的發生[20]。本研究首先檢測了炎癥細胞因子TNF-α和IL-2在1、7、14 d時的水平變化,發現CLP模型小鼠的TNF-α和IL-2水平升高,而隨著時間的推移,TNF-α和IL-2逐步減少,TNF-α和IL-2分別是由巨噬細胞和活化T細胞產生的促炎細胞因子,在免疫應答和炎癥反應中有著重要作用,可反映炎癥的水平[21]。本研究以14 d作為后續實驗的觀察時間點。進一步研究發現,經過miR-140 agomir處理后,相比于未經miR-140 agomir處理的模型小鼠,盡管TNF-α和IL-2水平變化差別不大,但模型小鼠的生存率明顯改善,CD4+和CD8+T淋巴細胞百分率升高,結果表明miR-140激發了CLP小鼠免疫功能恢復,改善了生存率。
巨噬細胞除參與了吞噬、抗原呈遞及T、B細胞活化等功能外,也參與了對炎癥反應的調控[22-23]。適當的炎癥反應是殺死入侵的微生物的有效方式,巨噬細胞通過免疫抑制作用控制炎癥反應的強度[24]。而在膿毒癥動態反應過程中,細胞功能紊亂導致在初始的炎癥免疫反應之后,進入持續的免疫抑制狀態,其中巨噬細胞功能障礙是膿毒癥性免疫抑制的重要原因之一[25]。PD-L1參與了巨噬細胞免疫抑制的調控作用[26]。本研究通過提取CLP模型小鼠腹膜巨噬細胞,考查miR-140和PD-L1在CLP小鼠巨噬細胞中的作用關系。發現經過miR-140 agomir處理可扭轉膿毒癥引起的小鼠PD-L1陽性巨噬細胞率的升高,并且在基因和蛋白水平上也表現出同樣的趨勢。進一步通過熒光素酶報告實驗,證實了miR-140和PD-L1的靶向關系。結果表明miR-140通過靶向作用于PD-L1基因,降低PD-L1在巨噬細胞的表達,從而解除巨噬細胞的免疫抑制作用。
4 結論與展望
miR-140可激發CLP小鼠免疫功能恢復,提高CD4+、CD8+T淋巴細胞比率,改善小鼠生存率,這一作用與miR-140靶向沉默PD-L1,解除巨噬細胞的免疫抑制作用有關。本研究為臨床膿毒癥基于PD-1/PD-L1通路的免疫治療提供新的理論依據和生物學基礎,但僅從miR-140對巨噬細胞功能的調控角度解釋了miR-140對CLP小鼠免疫功能恢復的機制,尚存在其他靶細胞的可能性,有待在后續研究中進一步闡明。

