CRISPR/Cas9系統在基因編輯和疾病治療中的應用
張思桐,黃妙惠
(福建師范大學南方生物醫學研究中心 福建省天然免疫生物學重點實驗室,福建 福州 350117)
CRISPR/Cas9技術是一種新型基因編輯工具,是以RNA導向的DNA識別系統,可在不同生物體中高效和特異性地進行基因編輯和調控。CRISPR技術以其易于操作,可多重編輯,能夠進行高通量篩選,更強的可擴展性等成為生物醫學研究革命性的新工具。
1987年,Ishino等率先在大腸桿菌中發現29nt串聯間隔重復序列,2002年Ruud等人首次使用CRISPR(clustered regulatory interspaced short palindromic repeat)來描述該間隔重復序列。隨后,在2005年三個研究小組發現CRISPR中的間隔序列與感染細菌和古細菌的病毒高度同源,2007年Barrangou等提供了Ⅱ型CRISPR/Cas9系統介導的適應性免疫的第一個實驗性證據。2012年Martin等發表了與反式激活的crRNA(tracr RNA)配對的crRNA,形成了2個RNA結構并介導Cas9將DNA雙鏈斷裂(double strand break,DSB)引入靶DNA中。2013年Cong和Mali等人同時發表的開創性研究表明CRISPR系統首次完成對哺乳動物細胞的基因編輯。2016年,研究人員在CRISPR/Cas9活體細胞目標識別和利用CRISPR/Cas9引起癌癥突變的失活方面取得了重大突破[1]。2017年,張峰等人證明CRISPR/Cas13可以靶向哺乳動物細胞中的RNA和功能,并可以作為研究哺乳動物細胞中RNA和促進治療發展的靈活平臺[2]。2018年,首次啟動CRISP/Cas9臨床試驗。2020年,首例患者接受了直接將CRISPR注射人體內的基因編輯療法[3];同年,諾貝爾化學獎頒發給Emmanuelle Charpentier和Jennifer Doudna以表彰他們對CRISPR/Cas9基因編輯技術的貢獻(CRISPR/Cas9系統發展時間線見圖1)。 CRISPR/Cas9技術以其具有較強的特異性和高效率,并能準確、快速地篩選全基因組的能力,使它在基因突變、改造、特定疾病模型建立、癌癥治療等方面成為可能,為疾病治療提供新的手段。
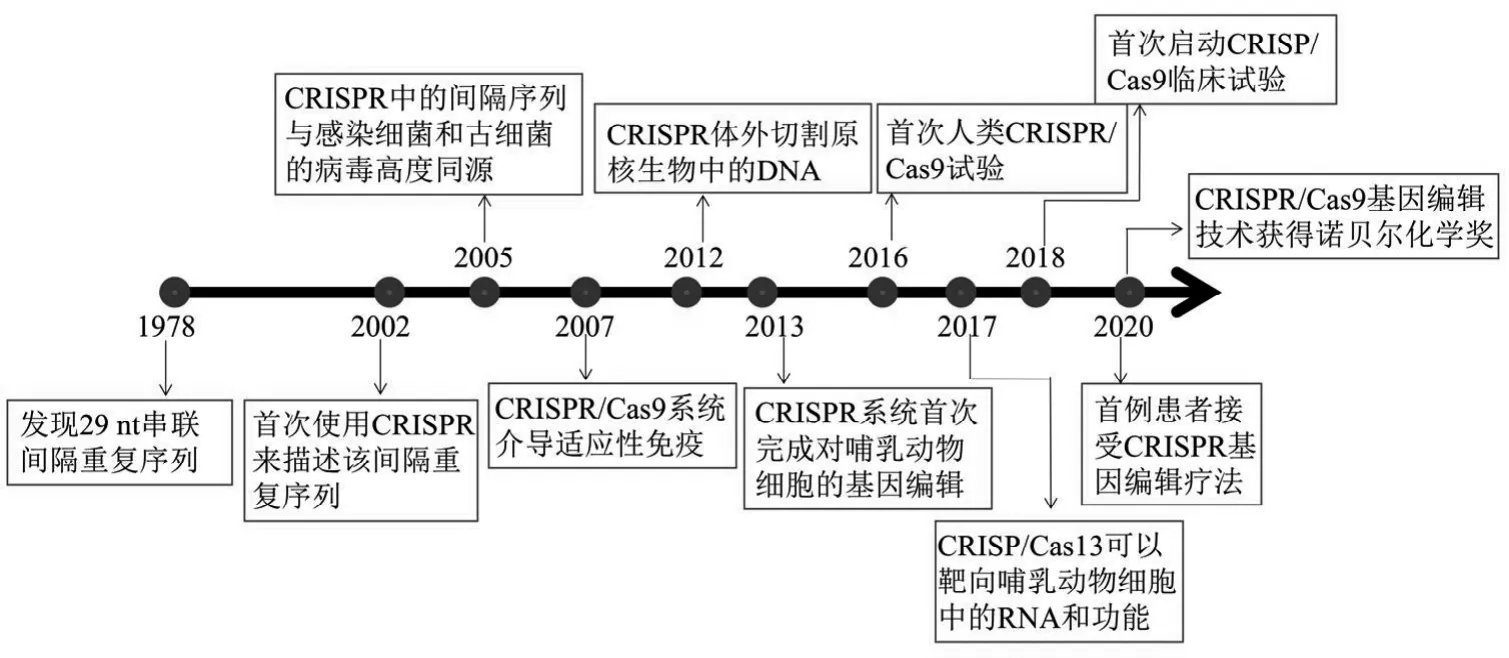
圖1 CRISPR/Cas9系統發展時間線
1 CRISPR:細菌和古細菌的適應性免疫機制
CRISPR/Cas系統是細菌和古細菌體內的獲得性免疫系統[3],可對抗侵略細菌的外源DNA、質粒和噬菌體。含有CRISPR的生物從侵入物(噬菌體或質粒)中獲得DNA片段,將其轉錄到CRISPR RNA(crRNA)中以指導切割侵入的RNA或DNA[4],這種CRISPR免疫系統通過許多不同的Cas蛋白協作完成。根據其組件和作用機制的差異,CRISPR系統分為2大類:Class 1(包含Ⅰ、Ⅲ和Ⅳ型)和Class 2(包含Ⅱ、Ⅴ和VI型)[5]。其中,Ⅰ型系統是RNA引導目的基因的切割,這類系統需要幾個較大的復合體作為效應蛋白;但在Ⅱ型系統中,只需要一種RNA引導的內切核酸酶(例如,類型Ⅱ中的Cas9和Cpf1)來介導侵入物遺傳物質的切割[6]。
系統分三個階段對侵入的外源DNA進行全面的免疫應答[7]。第一階段,即獲取階段,入侵質粒或噬菌體的DNA片段被整合到宿主的CRISPR位點作為crRNA重復序列之間的間隔物。在第二階段,Cas蛋白被表達,包含獲得間隔區的CRISPR陣列被轉錄成pre-crRNA,pre-crRNA被Cas蛋白和宿主其它因子切割并加工為成熟的crRNA。成熟crRNA起到引導作用,crRNA 5'端區域能夠與侵入物基因組互補配對,而其3'端能夠與非編碼反式激活CRISPR RNA(tracr RN)及Cas9 蛋白形成復合物。在Ⅱ型CRISPR系統中tracr RNA與crRNA重復序列的雜交,對于crRNA加工、Cas9結合和Cas9介導的靶向切割至關重要。第三階段,Cas蛋白在crRNA指導下識別特定靶向序列,并介導入侵基因組的切割,從而保護宿主細胞免受感染。大部分CRISPR系統依賴存在于侵入基因組中與crRNA靶位點相鄰,特異性的PAM 序列[8]。由于宿主基因組中CRISPR位點不存在這種PAM序列,從而幫助其避免Ⅰ型和Ⅱ型CRISPR系統自我剪切[9]。
2 CRISPR/Cas9系統在哺乳動物細胞中的作用機制
CRISPR/Cas9是細菌防止外來DNA分子入侵的適應性免疫系統,科學家將該系統作為一種靶向基因編輯技術。目前應用于哺乳動物細胞的CRISPR/Cas9系統主要由Cas9蛋白和guide RNA兩個部分組成。
guide RNA組件是大約100個核苷酸長度的引導RNA。Cas9蛋白結合到guide RNA最后約80個核苷酸位置,之后guide RNA的前20個核苷酸處于游離狀態,通過堿基互補配對與DNA雙鏈結合,此時Cas9與雙鏈DNA在PAM基序位置進行交互交聯并介導DNA雙鏈分離,形成蛋白質、RNA和DNA三重復合物。其中guide RNA的前20個核苷酸將Cas9蛋白引導到特定的基因組位點,通過改變這20個核苷酸序列,就可以重新定向CRISPR/Cas9打靶基因組中不同位點。復合物形成后,Cas9引發DNA雙鏈斷裂。DSB可以通過HDR和非同源末端連接(non-homologous end joining, NHEJ)修復[10]。在同源修復模板存在的情況下,CRISPR/Cas9系統通過同源定向修復(homology directed repair, HDR)產生精確的序列修飾(例如突變、插入或更正),NHEJ則可以介導隨機插入或缺失突變。如果DBS存在于編碼外顯子區域時,NHEJ修復可能導致基因開放閱讀框移位或過早形成終止密碼子,破壞正常翻譯,造成閱讀框架紊亂和相應蛋白滅活。研究表明NHEJ是哺乳動物細胞中DSB修復最主要的途徑且它不依賴于細胞周期[11]。機體通過HDR和NHEJ修復機制從而實現基因編輯作用。
隨著研究深入,CRISPR / Cas9系統已經廣泛應用在基因敲除、敲入、疾病模型建立以及基因治療;因其高效性和易操作性,在生物醫學界引起一陣研究狂潮。
3 應用Cas9介導的基因組編輯技術研究基因功能
Cas9介導的基因編輯系統已廣泛用于遺傳學研究,通過對基因進行定點編輯,了解特定基因作用,建立基因編輯動物模型。通過簡單地構建一個sgRNA,與鄰近PAM基序NGG靶向位點配對,Cas9即可定位到指定DNA位點實現靶向剪切。有研究表明Sp Cas9基因組內平均每8 bp就有一個PAM基序,可靶向編輯幾乎任何感興趣的基因[12]。CRISPR/Cas9技術的使用大大提高了轉基因效率:從真菌和植物到各種動物。這項技術也使得建立疾病模型變得更加容易,推進了遺傳性疾病和癌癥等疾病研究,有助于理解這些病理過程的分子機制[13]。通過引入Cas9和幾個sgRNAs可以很容易地同時編輯多個基因位點,這可以應用于生產大規模的染色體重排。例如在同一染色體內的鄰近區域創建一個DSB可能會導致DNA中間片段的靶向缺失或倒位,而在不同染色體中產生兩個DSB可能導致靶向的染色體易位[14]。這類由Cas9介導的靶向重排,模仿了人類疾病狀態(例如癌癥)中發生的重排,對研究疾病模型和遺傳性疾病具有重要作用。
CRISPR/Cas9系統在治療許多疾病中也越來越重要,包括艾滋病、遺傳性疾病和癌癥等。當Cas9與含有病毒關鍵基因組sgRNA的載體一起感染細胞時,病毒基因組會被滅活或清除,從而防止感染HIV、乙肝病毒、人乳頭瘤病毒和Epstein-Barr病毒[15,16]。有研究顯示,通過CRISPR/Cas9靶向宿主基因組中編碼HIV共同受體共趨化因子受體5(co-receptor chemokine receptor 5,CCR5)使細胞產生HIV-1病毒抗性,從而有助于抵抗HIV感染。更具臨床意義的是,該系統還應用于多種體細胞類型,如原代T細胞和造血干細胞等免疫細胞的基因治療性改變[17]。
以上證據均表明CRISPR/Cas9可通過基因編輯,修復突變或敲除特定基因,探討腫瘤發生機制,進而達到推進腫瘤治療的目的。
4 應用CRISPR/Cas9技術修正基因突變
治療遺傳性疾病最直接方法是通過基因治療糾正導致該疾病的突變。眾多研究表明,CRISPR/Cas9系統可準確有效地編輯細胞基因組從而達到修正基因突變的目的。
囊性纖維化是一種主要影響肺部和消化系統的遺傳性疾病,主要是由囊性纖維化跨膜傳導調節因子(C F T R)突變引起。有研究發現,通過CRISPR/Cas9編輯技術可糾正囊性纖維化患者腸干細胞中CFTR位點突變[18]。被校正的基因能夠正常表達,恢復了因CFTR突變引起的腸干細胞類器官腫脹。
β-地中海貧血癥是常見的單基因遺傳病,由人血紅蛋白beta(HBB)基因突變引起,突變抑制紅細胞產生足夠的含氧血紅蛋白分子從而導致貧血。有研究發現利用CRISPR/Cas9技術和piggy-Bac轉座子將校正DNA序列定位到HBB突變位點,有效修正兩種不同的β-地中海貧血突變,而且經過校正的iPSC分化成紅細胞時,HBB表達恢復[19]。
這些研究表明CRISPR/Cas9技術可以給未來疾病治療方面提供一個新的策略。最近的幾項研究也證明了CRISPR/Cas9系統可用于來糾正小動物模型的遺傳性疾病。
膠質瘤是一種常見但原發性顱內惡性腫瘤,主要由機體攜帶端粒酶基因(TERT)啟動子區域的致癌突變引起,有研究發現,以腺相關病毒(AAV)作為載體,通過CRISPR/Cas9技術進行有效編輯,可以有效抑制小鼠移植瘤的生長,并延長了小鼠的生存時間,從而實現精準修正膠質瘤細胞端粒酶基因啟動子區域的致癌突變[20]。
利用Cas9 mRNA和sgRNA共注射到杜氏肌營養不良(DMD)小鼠體內,成功拯救了具有肌營養不良蛋白突變的小鼠[21]。同時有研究利用CIRSPR/Cas9技術通過HDR糾正了小鼠肝細胞中的Fah突變[22],通過脾臟注射將校正后的肝細胞移植到HT1小鼠模型中,并證明編輯后的肝細胞可以在體內廣泛增殖。該研究證明CRIPR/Cas9編輯在治療HT1以及其他形式的遺傳性代謝性肝病中的潛力。
這些研究都表明CRISPR/Cas9技術在修正基因突變,治療遺傳性疾病方面具有可行性,為未來疾病治療研究提供一個可靠的技術支持。
5 CRISPR/Cas9的風險和局限性
CRISPR/Cas9基因編輯技術的出現給基因治療帶來了新的藍圖,人們希望通過人為地敲除或改造基因,從而達到改善或治療疾病的目的。但在目前CRISPR/Cas9技術還存在一些不足,主要有以下幾個問題。
5.1 脫靶影響
CRISPR/Cas9技術最主要挑戰就是脫靶現象。非目標突變對CRISPR/Cas9技術的使用提出了不確定性,特別是在基因治療的情況下。在過去幾年,研究人員試圖通過優化sgRNA或人工修飾來改善Cas9的蛋白質結構,如PAM結構[23]。此外,通過對抗CRISPR蛋白進行研究,旨在能設計出一種有用的Cas9開關,限制Cas9在細胞核中的活躍時間,從而避免不必要的脫靶影響。
5.2 錯義敲除或插入
Cas9切割后DNA靶向修復,觀察到很少發生小的插入和缺失(<20 bp)。然而,在一些研究中出現了600 bp序列缺失和高達1500 bp不需要的序列缺失,這可能導致不必要的病理損害,也會導致正常組織或細胞表達出現障礙[24]。
5.3 傳遞效率
Cas9在細胞或組織中的傳遞效率是影響CRISPR基因編輯成功的另一關鍵原因。CRISPR/Cas9技術主要通過包含有Cas9和sgRNAs的質粒或病毒載體進行編輯。腺相關病毒載體是Cas9載體中最常用的載體,可以促進基因轉移,然而AAV載體會因為所包裝轉基因的大小而受到限制[25]。此外,mRNA和蛋白質在體內的傳遞方式,例如未能如期到達靶細胞,或者觸發人和動物體內RNA敏感的先天免疫反應繼而產生細胞毒性[26]。已有研究表明,通過改進CRISPR組分和傳遞方式的性能,如使用能攜帶sgRNA和Cas9蛋白的納米粒子作為載體,可以提高體內基因編輯的效率[27]。
另一個亟需解決的重要問題是與人類使用CRISPR技術有關的倫理安全,不管是現在還是未來,CRISPR/Cas9系統仍然是人們用于體內外研究疾病治療相關一種重要的技術和平臺,因此必須制定適當的倫理和監管準則來嚴格把控這項技術的合理使用。
6 展望
基因編輯被認為是在基因組水平上治療疾病的一種有力的現代科學工具。CRISPR/Cas9技術以其操作簡單、更具成本效益,可在體內外不同物種進行特異性基因敲除、插入和替換等優勢,被人們廣泛地應用于疾病的診斷、治療和預防上,是生物醫學研究和基因治療一次巨大的技術革新。
目前,利用CRISPR/Cas9技術建立遺傳性疾病模型已成趨勢,對細胞基因功能、癌癥和其他疾病基因組變化研究有著重要意義。已有科學家利用CRISPR/Cas9技術構建出老鼠、猴子和豬等多種動物模型進行研究,CRISPR/Cas9技術在作物遺傳育種、植物基因改造和農作物品種改良等多個方面也發揮著重要作用。
盡管CRISPR/Cas9技術在多個領域運用效果顯著,但還是存在一些需要克服的困難,比如減小脫靶效應、提高編輯效率和臨床治療中安全倫理等問題仍然是該技術在未來實際應用中最需要解決的事情。近來已有研究表明,載體或質粒的大小對CRISPR內切酶對靶基因的有效性和傳遞有顯著影響[28]。因此,選擇具有良好穿透性和較低宿主免疫激活性的載體,有利于將CRISPR/Cas9技術運用于更多疾病的治療。
接下來科學家們將繼續研究以提高基因靶向的準確性和效率,提高向特定細胞、組織或器官的傳遞性能,增強體內Cas9活性時間和區域,加強對基因編輯引起不良突變的預測和治療效率。我們有理由相信,CRISPR/Cas9基因編輯技術可以在現有技術手段下進一步改進醫學、遺傳學、胚胎學以及生物信息等領域的發展,對研究各種遺傳疾病的生物學和病理生理機制起到巨大的推動作用,對人類健康發展更來更多的福音。

