海研站菌S52 菌株Cr(Ⅵ)還原酶活性和穩定性及其還原Cr(Ⅵ)的條件優化
李佳瑤, 李曉夏, 安秋穎, 范 春, 郭東北, 唐 晨, 張 敏, 桑都哈西·歇里亞孜旦, 趙 苒
(1. 廈門大學分子疫苗學和分子診斷學國家重點實驗室 廈門大學公共衛生學院預防醫學系,福建廈門 361102;2. 四川省成都市邛崍市衛生健康局辦公室,四川 成都 611530)
鉻(Chromium,Cr) 是導致環境污染的主要重金屬元素之一,金屬電鍍、紡織染色和木材處理等工業生產活動中排放出來的污水中均含有Cr[1]。自然界中以三價鉻[trivalent chromium,Cr(Ⅲ)]和六價鉻[hexavalent chromium,Cr (Ⅵ)]最為穩定,但二者的性質大不相同。Cr(Ⅲ) 毒性較小,微量的Cr(Ⅲ)是機體必需的營養物質;Cr(Ⅵ)溶解度更高,具有強烈的致癌、致畸和致突變性,其毒性比Cr (Ⅲ) 高約100 倍,致突變性高1 000 倍[2],美國環境環保局已經把Cr(Ⅵ)確定為對人體最具威脅的17 種化學物質之一[3]。人群主要通過食物、飲用水攝入和空氣等途徑暴露于Cr[4],皮 膚 及 呼 吸 系 統 易 受 損 害[5]。由 于 食 物 鏈的生物富集和放大作用[6],因重金屬等化學污染物排放造成的海洋污染,已致海產品面臨食品安全問題[7]。針對福建省水產品中Cr 蓄積情況的研究[8]顯示:部分水產品樣本存在Cr 超標的現象。流行病學調查[9]顯示:長期職業暴露于Cr 也是肺癌高發的危險因素。因Cr(Ⅵ)污染而帶來的公眾健康問題日益突出,如何安全有效地去除或減少Cr(Ⅵ)污染,對保護生態平衡和人類健康具有重大意義。
Cr(Ⅵ)污染水體的主要治理方法有傳統的物理化學方法和生物修復法。物理化學方法主要包括還原-離子交換法、吸附法和混凝法等,雖然處理效果尚可,但其存在反應過程復雜、成本高、副產物較多和易產生二次污染等不足[10]。生物修復法是一種新興的、環境友好型的Cr(Ⅵ)污染水體修復技術,主要包括動物修復法、植物修復法和微生物修復法,具有過程安全、成本低、修復效率高和無二次污染等優點,具有良好的發展前景[11]。pH 值和溫度一直被認為是微生物修復Cr(Ⅵ)的2 個重要影響因素,可能影響著菌株內或者生物膜上有關蛋白酶的作用。pH 值和溫度影響菌株還原效率的相關研究已多見報道[12-13],但大多停留在對還原菌株的篩選及其還原效率層面,鮮見對菌株胞內胞外活性物質分析及其最優還原條件探索的研究。
本課題組前期從廈門市大嶝島雙滬碼頭附近的海灘沉積物樣品中成功分離篩選獲得一株具有高效Cr(Ⅵ)還原能力的細菌Mesonia sp.S52,將其命名 為 海 研 站 菌 S52 菌 株 ( 授 權 專 利 號:ZL201410819468.3)。在實驗室條件下,該菌株最大 耐Cr (Ⅵ) 濃 度 為500 mg·L-1,48 h 內 對50 mg·L-1Cr(Ⅵ) 的還原率可達73%以上。本研究通過對S52 菌株還原活性物質[Cr(Ⅵ)還原酶] 進行提取和定位,同時探討pH 值和溫度對Cr (Ⅵ)還原酶穩定性和活性的影響,以及不同金屬離子和小分子物質對其還原效率的影響,旨在明確S52 菌株還原Cr(Ⅵ)的途徑及其機制,為后續微生物修復技術的優化提供理論依據。
1 材料與方法
1.1 菌株、主要試劑和儀器
選用的實驗菌株來源于本實驗室從廈門市大嶝島雙滬碼頭附近的海灘沉積物樣品中分離篩選并進行鑒定得到的海研站菌(Mesonia sp.) S52 菌株。LB 肉湯培養基(青島海博生物技術有限公司),重鉻酸鉀、Triton X-100、 乙二胺四乙酸二鈉(EDTA)、丙酮、 吐溫80 和十二烷基硫酸鈉(SDS) 等化學試劑均為分析純。U410-86 型超低溫冰箱(美國NBS 公司),Epoch2 型全波長酶標儀(美國Biotek 儀器有限公司),KQ3200B 型超聲波清洗儀(昆山超聲儀器有限公司),THZ-C 型恒溫振蕩器(江蘇太倉強樂實驗設備有限公司),EL204 型電子天平和FE20 型pH 計(瑞士梅特勒-托利多儀器有限公司),DNP-9052 型恒溫培養箱(廈門精藝興業科技有限公司),VCX130PB 型超聲波破碎儀(美國Sonics 公司),SW-CJ-2F 型超凈工作臺(上海智誠分析儀器制造有限公司),MSH-S 型磁力攪拌器[大龍興創實驗儀器(北京)有限公司],GI54TW 型全自動滅菌鍋[致微(廈門)儀器有限公司],湘儀GL-21M 離心機(湖南湘儀實驗室儀器開發有限公司)。
1.2 種子液的制備
取保存于-80 ℃超低溫冰箱中的S52 菌液,平板劃線法接種于LB 固體培養基中,挑取分離純化得到的S52 單菌落于LB 液體培養基中,37 ℃、160 r·min-1恒溫搖床培養12 h 即得S52 種子液。
1.3 Cr(Ⅵ)還原酶的提取和定位
按4%接種量將S52 種子液接種于LB 液體培養基,過夜培養(12 h)后,4 ℃、12 000 r·min-1離心5min,經0.22 μm 濾膜過濾后,收集上清液即為胞外活性物質(胞外酶);用Tris-HCl 緩沖液(pH 值為8.0)洗滌菌體,再次離心去上清,重復3 次,加入原培養基的1/20 體積的Tris-HCl,漩渦振蕩,轉移到無菌玻璃容器中,用超聲波破碎儀冰浴 破 菌,將 破 碎 液4 ℃、12 000 r·min-1離 心20 min,取上清液到新的離心管中,即為胞內活性物質(胞內酶)[13-14]。將上述獲得的胞內活性物質用Tris-HCl 定容至與胞外活性物質的體積相同,與用作對照組的S52 全菌體分別加入到含50 mg·L-1Cr(Ⅵ)的培養體系中,37 ℃、pH 值為8.0、160 r·min-1搖 床 培 養,于0、3、6、12、24 和48 h 分別采用二苯碳酰二肼分光光度法分別測定溶液中Cr(Ⅵ)濃度,計算不同時刻Cr(Ⅵ)還原率。Cr (Ⅵ) 還原率計算方法:實驗初始Cr (Ⅵ)濃度記為ρ0,待測時點測得Cr(Ⅵ)濃度 記 為ρ1,待 測 時 刻 還 原 率X= (ρ0-ρ1)/ρ0×100%,根據計算所得的Cr (Ⅵ) 還原率判斷Cr (Ⅵ)的還原情況。
1.4 Cr(Ⅵ)還原酶的性質
1.4.1 不同溫度和不同pH 值時Cr(Ⅵ)還原酶活性 37 ℃、pH 值為7.0 條件下,將一定量的Cr (Ⅵ)還原酶(即胞外、胞內活性物質) 與50 mg·L-1Cr(Ⅵ)反應,3 h 后測定Cr(Ⅵ)濃度,將Cr(Ⅵ)濃度的減少量作為活性測定的標準[15],以相對活性指標來表示Cr(Ⅵ)還原酶活性,相對活性=不同條件下Cr(Ⅵ)濃度減少量/前述相對活性的標準×100%。保持pH 值7.0 不變,改變溫度分別為25 ℃、30 ℃、35 ℃、40 ℃、45 ℃和50 ℃;在酶 活 性 最 高 的37 ℃下,改 變pH 值 為5.0、6.0、8.0、9.0 和10.0,分 別 與50 mg·L-1Cr(Ⅵ)反應,同樣計算得出Cr(Ⅵ)還原酶相對活性。
1.4.2 不同溫度和不同pH 值時Cr(Ⅵ)還原酶穩定性 將一定量Cr(Ⅵ)還原酶置于4 ℃、pH 值為7.0 的LB 培養基中24 h 后取出,在pH 值7.0、37 ℃條件下與50 mg·L-1Cr(Ⅵ)反應,3 h 后測定Cr(Ⅵ)濃度,將Cr(Ⅵ)濃度的減少量作為相對穩定性的標準[15],以相對穩定性指標來表示Cr(Ⅵ)還原酶穩定性,相對穩定性=不同條件下Cr(Ⅵ) 濃度減少量/前述相對穩定性的標準×100%。保持pH 值7.0 不變,改變溫度分別為25 ℃、30 ℃、35 ℃、40 ℃、45 ℃和50 ℃;4 ℃條件下將pH 值分別改為5.0、 6.0、 8.0、 9.0 和10.0,24 h 后 分 別 與50 mg·L-1Cr (Ⅵ) 在37 ℃條件下反應,同樣計算得出Cr(Ⅵ)還原酶相對穩定性。
1.5 二苯碳酰二肼分光光度法測定Cr(Ⅵ)濃度
參照《生活飲用水標準檢測方法金屬指標》(GBT 5750.6-2006),測定Cr(Ⅵ)濃度。
1.6 二苯碳酰二肼分光光度法測定不同溫度和不同pH 值組Cr(Ⅵ)還原酶對Cr(Ⅵ)的還原率
將溫度設為25 ℃、30 ℃、35 ℃、40 ℃、45 ℃和50 ℃,pH 值設為5.0、6.0、7.0、8.0、9.0 和10.0。采用混合實驗設計,將各個溫度水平與pH 值水平完全隨機組合(6×6),實驗組總共設為36 組,同時各設3 組平行對照。分別以4%接種量接種S52 種子液于含50 mg·L-1Cr(Ⅵ)的培養基中,不同溫度和不同pH 值條件下,同時置于160 r·min-1恒 溫 搖 床 中 震 蕩 培 養,在0、3、6 和12 h 分別采用二苯碳酰二肼分光光度法測定Cr (Ⅵ)濃度并計算各個時刻的Cr(Ⅵ)還原率。采用方差分析和多重比較等統計學方法,分析S52 菌株的Cr(Ⅵ)還原酶還原Cr(Ⅵ)的最適宜溫度和pH 值,擬合出最優還原條件。
1.7 二苯碳酰二肼分光光度法測定不同金屬離子處理組Cr(Ⅵ)還原酶對Cr(Ⅵ)的還原率
分別將濃度為0.2 mmol·L-1的Cu2+、Mn2+和Cd2+溶液加入到LB 液體培養基中作為處理組,以未作處理的培養基作為對照組,在“1.6”中得到的最優還原條件下與50 mg·L-1的Cr (Ⅵ) 反應3 h,采用二苯碳酰二肼分光光度法測定Cr(Ⅵ)濃度,比較不同金屬離子處理組Cr(Ⅵ)還原酶對Cr(Ⅵ)的還原率。
1.8 二苯碳酰二肼分光光度法測定不同小分子物質處理組Cr(Ⅵ)還原酶對Cr(Ⅵ)的還原率
分別將濃度為1 mmol·L-1的SDS、EDTA 和1%的Triton100、吐溫80 加入到LB 液體培養基中作為處理組,以未做處理的培養基作為對照組,在“1.6”中得到的最優還原條件下與50 mg·L-1的Cr (Ⅵ)反應3 h,用二苯碳酰二肼分光光度法測定Cr(Ⅵ)濃度,比較不同小分子物質處理組Cr (Ⅵ)還原酶對Cr(Ⅵ)的還原率。
1.9 統計學分析
采用SPSS 20.0 統計軟件進行統計學分析,應用Excel 2018 軟件繪制圖表。Cr (Ⅵ) 還原酶對Cr (Ⅵ)的還原率、Cr(Ⅵ)還原酶相對活性和相對穩定性均符合正態分布并且方差齊,以表示,不同溫度和不同pH 值處理組間比較采用析因方差分析和多重比較,不同金屬離子和小分子物質處理組多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1 Cr(Ⅵ)還原酶的提取和定位
隨著時間延長,S52 原菌體對Cr(Ⅵ)的還原率不斷升高,48 h 時對50 mg·L-1Cr(Ⅵ)的還原率可達73.1%; 3 h 時,胞 內 酶 和 胞 外 酶 對Cr (Ⅵ)的還原率達到最高,且胞內酶對Cr(Ⅵ)的還原率高于胞外酶(P<0.05);隨后Cr(Ⅵ)還原率不斷降低,相同時間點胞內酶和胞外酶的對Cr(Ⅵ) 的還原率比較差異無統計學意義(P>0.05),但與對照組比較差異均有統計學意義(P<0.05),12 h 后Cr(Ⅵ)還原率幾乎為0,且12、24 和48 h 間Cr(Ⅵ)還原率比較差異無統計學意義(P>0.05)。見表1。
2.2 Cr(Ⅵ)還原酶的性質
2.2.1 不同溫度時胞內酶和胞外酶的相對活性和穩定性 對于胞內酶,保持良好活性的溫度范圍為35 ℃~45 ℃,若將其預先置于45 ℃~50 ℃條件下24 h 可能會引起酶的不穩定,同時影響酶活性(圖1 A);對于胞外酶,在25 ℃~30 ℃時較適合其酶活性發揮,4 ℃~30 ℃穩定性較好,且不同溫度間差別不明顯(圖1 B)。因此胞內酶最適溫度為35 ℃~45 ℃,胞外酶最適溫度為25 ℃~30 ℃。
表1 不同時間點S52 菌株胞內酶和胞外酶對Cr(Ⅵ)的還原率Tab.1 Reduction rates of Cr(Ⅵ)by intracellular and extracellular enzymes in S52 strain at differenttime points
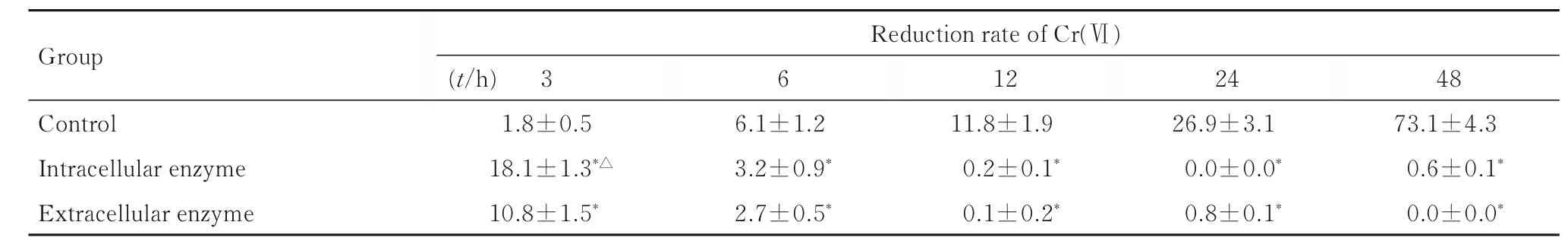
表1 不同時間點S52 菌株胞內酶和胞外酶對Cr(Ⅵ)的還原率Tab.1 Reduction rates of Cr(Ⅵ)by intracellular and extracellular enzymes in S52 strain at differenttime points
*P<0.05 compared with control group;△P<0.05 compared with extracellular enzyme.
Group Reduction rate of Cr(Ⅵ)48 73.1±4.3 0.6±0.1*0.0±0.0*(t/h) 3 1.8±0.5 18.1±1.3*△10.8±1.5*6 12 11.8±1.9 0.2±0.1*0.1±0.2*24 26.9±3.1 0.0±0.0*0.8±0.1*Control Intracellular enzyme Extracellular enzyme 6.1±1.2 3.2±0.9*2.7±0.5*
2.2.2 不同pH 值時胞內酶和胞外酶的相對活性和穩定性 當pH 值<7.0 或pH 值>7.0 時,胞內酶的酶活性或穩定性會有較大損失,因此胞內酶的最適pH 值為7.0;當pH 值在7.0~8.0 時,胞外酶的穩定性較好,但當pH 值>7.0 時,酶活性有一定損失,因此胞外酶的最適pH 值也為7.0。見圖2。
2.3 不同溫度和不同pH 值條件下胞內酶對Cr(Ⅵ)的還原率
隨著時間延長,不同溫度和不同pH 值條件下胞內酶對Cr(Ⅵ)的還原率均逐漸降低,12 h 時所有組未見明顯還原效果。作用3 h 時,相同溫度下,pH 值從5.0 到6.0,胞內酶對Cr(Ⅵ)的還原率明顯升高;隨著pH 值升高,其還原率大幅降低。在一定pH 值條件下,溫度從25 ℃~45 ℃,胞內酶對Cr(Ⅵ)的還原率逐漸升高。在45 ℃、pH 值6.0條件下,胞內酶對Cr(Ⅵ)的還原率最高,達到39.7%。采用析因設計資料方差分析,不同pH 值組間胞內酶對Cr(Ⅵ)的還原率比較差異有統計學意義(F=201.748 ,P<0.05);結合多重比較,當pH 值為6 時,胞內酶對Cr(Ⅵ)的還原率高于其他pH 值組(P<0.05);不同溫度組間胞內酶對Cr(Ⅵ) 的還原率比較差異有統計學意義(F=44.671,P<0.05),溫度為40℃和45℃組胞內酶對Cr(Ⅵ) 的還原率均高于其他組(P<0.05),但其2 組間比較差異無統計學意義(P>0.05)。溫度和pH 值具有明顯的交互效應(P<0.05)。見表2。
2.4 不同溫度和不同pH 值條件下胞外酶對Cr(Ⅵ)的還原率
隨著時間延長,不同溫度和不同pH 值條件下胞外酶對Cr(Ⅵ)的還原率均逐漸降低,12 h 時所有組均未見明顯還原效果。作用3 h 時,溫度一定時,pH 值從5.0 到6.0,胞外酶對Cr(Ⅵ)的還原率明顯升高;隨著pH 值從7.0 增加到10.0,其還原率呈降低趨勢。隨著溫度從30 ℃逐漸上升至50 ℃,胞外酶對Cr(Ⅵ) 還原率逐漸降低。在30 ℃、pH 值6.0 條件下,胞外酶還原率最高(19.8%)。采用析因設計資料方差分析,不同pH值組間胞外酶對Cr(Ⅵ)的還原率比較差異有統計學意義(F=580,P<0.05);結合多重比較,pH 值6.0 和7.0 組胞外酶對Cr(Ⅵ)的還原率均高于其他pH 值組(P<0.05),但其2 組間比較差異無統計學意義(P>0.05);不同溫度組間比較差異有統計學意義(F=355.064,P<0.05),當溫度為30 ℃時胞外酶時Cr(Ⅵ)的還原率高于其他溫度組(P<0.05)。溫度和pH 值具有明顯的交互效應(P<0.05)。見表3。
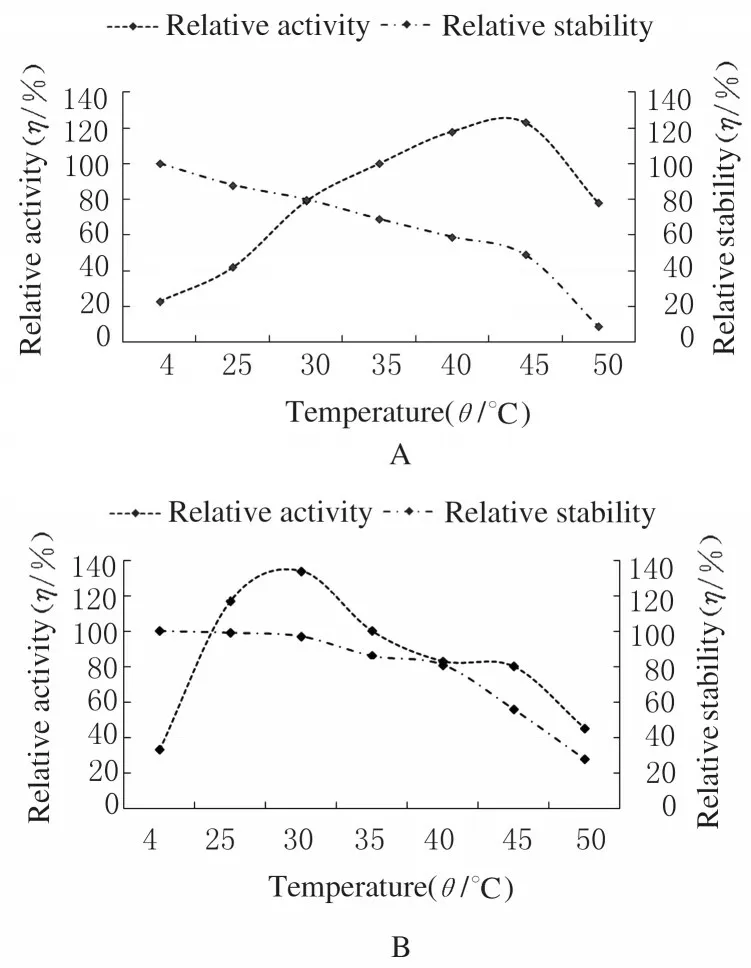
圖1 不同溫度時胞內酶(A)和胞外酶(B)的相對活性和穩定性Fig. 1 Relative activities and stabilities of intracellular and extracellular enzymes at different temperatures
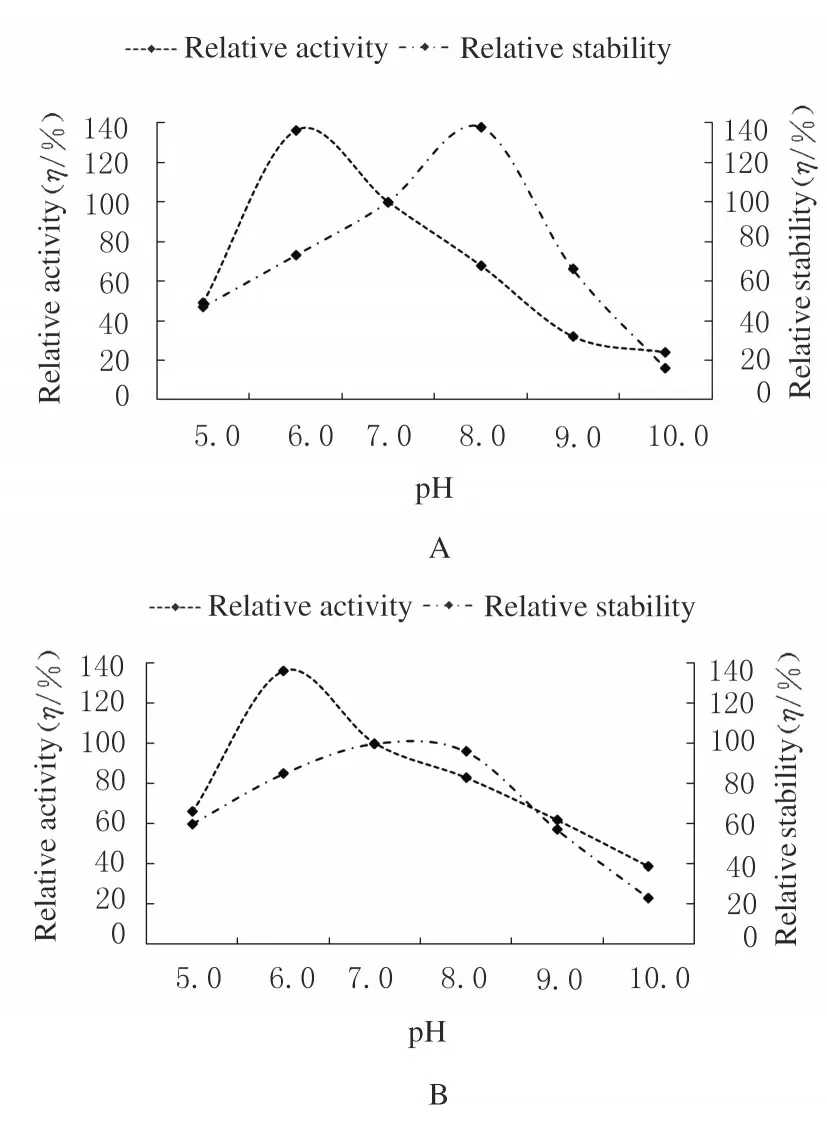
圖2 不同pH 值時胞內酶(A)和胞外酶(B)的相對活性和穩定性Fig. 2 Relative activities and stabilities of intracellular and extracellular enzymes at different pH values
表2 不同溫度和不同pH 值條件下作用3 h 胞內酶對Cr(Ⅵ)的還原率Tab.2 Reduction rates of Cr(Ⅵ)by intracellular enzymes under conditions of different temperatures and pH values at 3 h after treatment
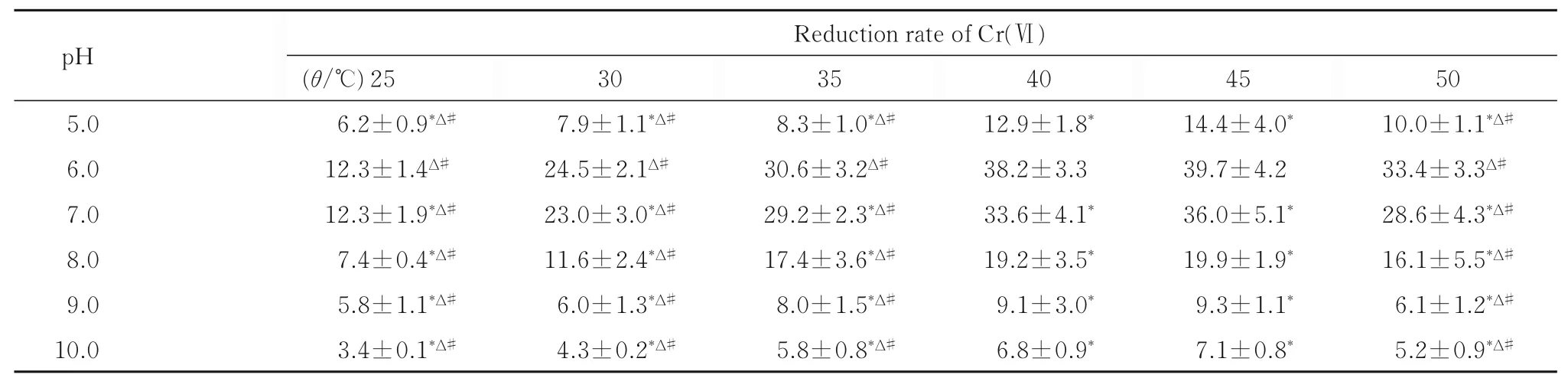
表2 不同溫度和不同pH 值條件下作用3 h 胞內酶對Cr(Ⅵ)的還原率Tab.2 Reduction rates of Cr(Ⅵ)by intracellular enzymes under conditions of different temperatures and pH values at 3 h after treatment
*P<0.05 compared with pH 6.0 group at the same temperature;ΔP<0.05 compared with 40 ℃at the same pH value;#P<0.05 compared with 45 ℃at the same pH value.
pH Reduction rate of Cr(Ⅵ)50 10.0±1.1*Δ#33.4±3.3Δ#28.6±4.3*Δ#16.1±5.5*Δ#6.1±1.2*Δ#5.2±0.9*Δ#5.0 6.0 7.0 8.0 9.0 10.0(θ/℃)25 6.2±0.9*Δ#12.3±1.4Δ#12.3±1.9*Δ#7.4±0.4*Δ#5.8±1.1*Δ#3.4±0.1*Δ#30 7.9±1.1*Δ#24.5±2.1Δ#23.0±3.0*Δ#11.6±2.4*Δ#6.0±1.3*Δ#4.3±0.2*Δ#35 8.3±1.0*Δ#30.6±3.2Δ#29.2±2.3*Δ#17.4±3.6*Δ#8.0±1.5*Δ#5.8±0.8*Δ#40 12.9±1.8*38.2±3.3 33.6±4.1*19.2±3.5*9.1±3.0*6.8±0.9*45 14.4±4.0*39.7±4.2 36.0±5.1*19.9±1.9*9.3±1.1*7.1±0.8*
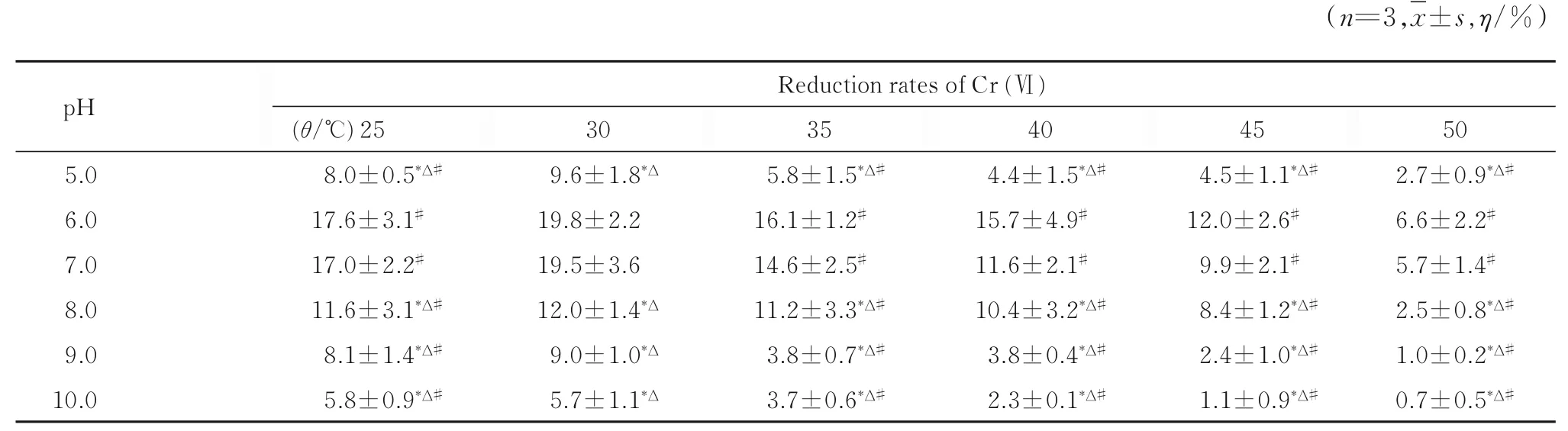
表3 不同溫度和不同pH 值條件下作用3 h 胞外酶對Cr(Ⅵ)的還原率Tab.3 Reduction rates of Cr (Ⅵ)by extracellular enzymes at different temperatures and pH values at 3 h after treatment
2.5 不同金屬離子作用3 h 后各組Cr(Ⅵ)還原酶對Cr(Ⅵ)的還原率
在胞內酶和胞外酶最適條件下,與對照組比較,Cu2+處理組胞內酶和胞外酶對Cr(Ⅵ)的還原率明顯升高(P<0.05),而Cd2+和Mn2+處理組胞內酶和胞外酶對Cr (Ⅵ) 的還原率明顯降低(P<0.05)。見表4。
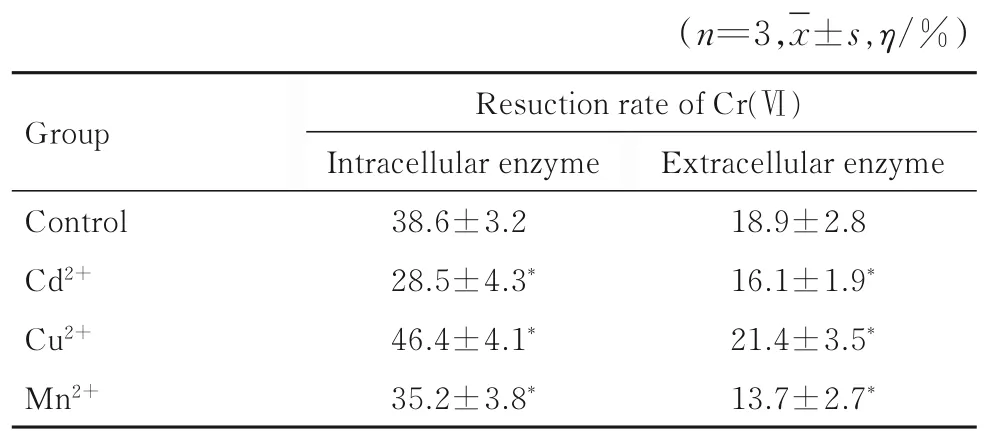
表4 不同金屬離子作用3 h 后各組Cr(Ⅵ) 還原酶對Cr(Ⅵ)的還原率Tab. 4 Reduction rates of Cr(Ⅵ) by Cr(Ⅵ) reductases after treated with different metal ions for 3 h in various groups
2.6 不同小分子物質作用3 h 后各組Cr(Ⅵ)還原酶對Cr(Ⅵ)的還原率
在胞內酶和胞外酶最適條件下,與對照組比較,Triton X-100 處理組胞內酶和胞外酶對Cr (Ⅵ)的還原率差異無統計學意義(P>0.05),吐溫80、EDTA 和SDS 處理組胞內酶和胞外酶對Cr (Ⅵ)的還原率均不同程度降低(P<0.05)。見表5。
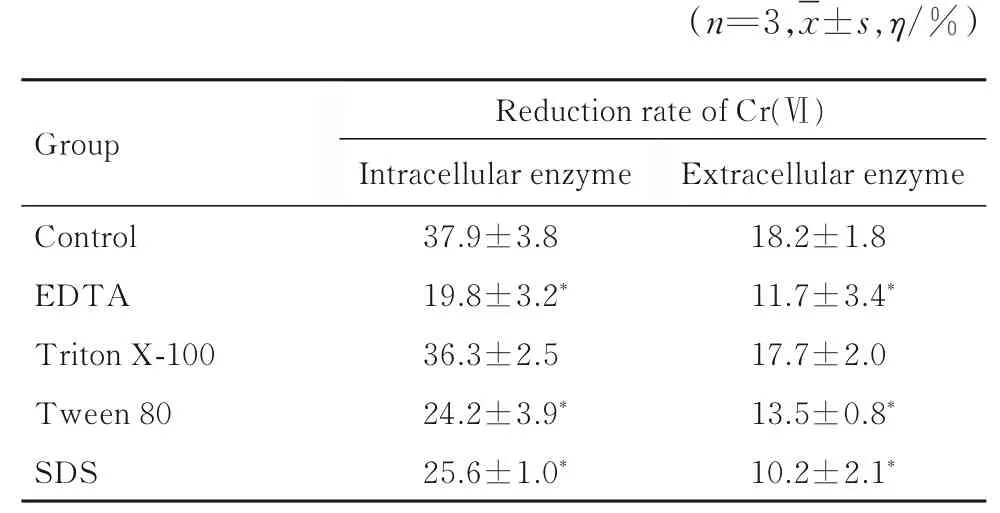
表5 不同小分子物質作用3 h 后各組Cr(Ⅵ)還原酶對Cr(Ⅵ)的還原率Tab. 5 Reduction rates of Cr(Ⅵ) by Cr(Ⅵ) redutases after treated with different small molecules for 3 h in various groups
3 討 論
微生物對Cr(Ⅵ) 的還原通常包含胞內還原和胞外還原[16],催化該過程的還原酶可能位于胞內、胞外和胞膜上[17]。本實驗結果顯示:S52 菌株的細胞內、外均有可能是還原酶還原Cr(Ⅵ)的場所。在pH 值為6.0、溫度45 ℃的條件下反應3 h,胞內酶對Cr(Ⅵ)的還原率最高(39.7%),在pH 6.0、溫度30 ℃的條件下反應3 h,胞外酶對Cr(Ⅵ)的還原率最高(19.8%),之后逐漸降低,均明顯低于S52 全菌的最高還原率(73.1%),故推測除還原酶外,菌株S52 可能還存在使Cr(Ⅵ)還原的其他途徑。酶作為菌株實現其還原功能的最主要單元,理論上其還原效率應近似于全菌,本課題組前期研究的Sporosarcina saromensisM52 菌株[14],雖然其胞外活性物質的還原率遠低于全菌,但其胞內活性物質的還原率約為全菌的1.3 倍。推測本研究中,在反應初期,大量的Cr(Ⅵ)進入菌體內,受相關活性物質催化,在未被還原為Cr(Ⅲ)之前,經電子傳遞系統形成了不穩定的中間體Cr(Ⅴ)[18];隨著還原反應繼續,一部分Cr(Ⅴ)氧化為Cr(Ⅵ),形成大量活性氧(reactive oxygen species,ROS),使得胞內氧化壓力增加,破壞細胞成分,影響核酸和氨基酸等的合成[19],并導致遺傳物質及蛋白質出現氧化損傷[20]。多數微生物在進化過程中形成了應對氧化壓力的保護機制,產生能夠與Cr(Ⅴ)鰲合形成相對 穩 定 的 去 鐵 胺(deferoxamine,DFX) 類 物質[21],但DFX-Cr(Ⅴ)螯合物只能暫時穩定存在,逐漸解離后,Cr(Ⅴ)會被快速氧化為Cr(Ⅵ),DFX 則被排出胞外。該機制可能是S52 菌株胞內和胞外還原率先升高后降低的原因。此外,本實驗所提取的活性物質以離體形式存在,其還原體系中的電子供體總量有限,缺乏持續供能的活性物質及ATP 等,可能也是導致反應無法持續進行及后續還原率降低的原因之一。
本研究對S52 菌株胞內酶和胞外酶的相對活性和穩定性測定以及還原條件優化,結果顯示:胞內酶還原Cr(Ⅵ)的最適溫度為35 ℃~45 ℃,最適pH 值為7.0,胞外酶還原Cr(Ⅵ)的最適溫度為25 ℃~30 ℃,最適pH 值為 7.0;從 二 者 還 原Cr(Ⅵ) 的最適溫度范圍未出現重合這一點來推測,S52 全菌發揮還原作用的溫度范圍可能較大。研究[22-24]顯示:不同來源菌株的還原酶其性質存在一定的差別,如Bacillus sp.、Escherichia coliATCC 33456 和Bacillus thuringiensisC-2 菌 中 的 還原酶最適pH 值、溫度以及相對活性、相對穩定性等最優還原條件均不完全相同。
魏斐等[24]研究發現:Cu2+能夠明顯促進蘇云金芽孢桿菌對Cr(Ⅵ)的還原作用;肖偉等[15]和楊勝男等[25]的研究也證實Cu2+可增強Cr(Ⅵ)還原酶活性。 Cu2+參與構成多種抗氧化酶[26],是很多還原酶的輔基[15],還是氧化呼吸電子轉運的重要部分[27],上述功能有助于通過提高電子轉移效率而提高Cr(Ⅵ)的生物還原[28];除Cu2+外,其他重金屬離子絕大多數在不同程度上抑制Cr(Ⅵ)還原酶的活性。本研究結果顯示:Cd2+和Mn2+可抑制S52 菌株Cr(Ⅵ)還原酶對Cr(Ⅵ)的還原。本研究結果同時顯示:Triton X-100 對Cr(Ⅵ)還原酶還原Cr(Ⅵ) 無明顯影響,吐溫80、EDTA和SDS 則不同程度抑制Cr(Ⅵ)還原酶的活性,與魏斐等[24]研究結果基本一致,與郭東北等[14]研究結果略有不同,其研究顯示Triton X-100 可以抑制Cr(Ⅵ)還原酶對Cr(Ⅵ)的還原。
在應用微生物修復水體Cr(Ⅵ)污染的實踐中,污染水源中其他金屬離子和小分子物質的存在可能會影響Cr(Ⅵ)的預期還原效果,故可通過加入經濟、有效的促還原物質提升修復效果。另有研究[25,29-30]將菌藻共生體系用于修復含Cr(Ⅵ)和苯酚等的廢水,結果顯示:菌藻體系的還原效果高于單一菌株,提示不同細菌對污染物的去除可能存在協同作用,并因菌類和藻類的混合比例不同而表現出不同的修復效果,為進一步優化微生物修復效果提供了新的研究思路。
綜上所述,微生物之所以能夠在高濃度Cr(Ⅵ)的環境下生存,可能源于其存在特定的基因(簇),也可能由于不同濃度的Cr(Ⅵ)誘導微生物的相關功能基因發生變化,進化出對Cr(Ⅵ)的抗性和還原機制[31]。本研究通過對S52 菌株的Cr(Ⅵ)還原酶進行定位,初步探討影響其還原效率的因素并進行優化,為闡明S52 菌株Cr(Ⅵ)還原酶還原Cr(Ⅵ)的分子生物學機制及其后續應用奠定了基礎。

