殼聚糖對腐生葡萄球菌的作用機制
藍蔚青,楊 歆,王 蒙,梅 俊,謝 晶
(1.上海海洋大學食品學院// 2.上海水產品加工及貯藏工程技術研究中心// 3.食品科學與工程國家級實驗教學示范中心(上海海洋大學),上海 201306)
水產品在貯藏期間,微生物是導致其腐敗的主因[1]。微生物種群發生群落演替,其中部分優勢菌起主導作用,產生腐敗臭味和異味等代謝產物,稱之為該類水產品的特定腐敗菌(Specific Spoilage Organism,SSO)[2]。SSO 具有調節和代謝產生一系列化合物與生物活性物質的能力,還可能含有從魚體內非蛋白氮衍生出的各種有機揮發性化合物(volatile organic compounds,VOCs),產生異味,影響產品的感官、質地與新鮮度[3-4]。腐生葡萄球菌(Staphylococcus saprophyticus)為革蘭陽性菌,是大黃魚(Pseudosciaena crocea)貯藏后期的SSO,能分泌蛋白酶與脂肪酶,導致蛋白質降解與脂質氧化,影響其品質[5-6]。目前有部分學者開展了對腐生葡萄球菌作用機理分析,如蘇萌萌等[7]研究得出綠原素能使腐生葡萄球菌細胞膜受損,導致膜電位變化,胞內物質泄漏;朱亞珠等[8]發現山梨酸鉀、異抗壞血酸鈉與雙乙酸鈉復合保鮮劑能明顯抑制腐生葡萄球菌的生長速率,導致菌體核酸與蛋白質外泄。本課題組前期在生物保鮮劑對腐生葡萄球菌的作用機制方面也開展了部分研究工作[9-11]。
殼聚糖是一種天然的陽離子多糖,是甲殼質的脫乙酰產物。其無毒、抗菌活性、可生物降解性和生物相容性、成膜性等優勢能夠提高產品的綜合品質,延長其貨架期[12-14]。此外,殼聚糖還可與具有抗氧化、抗菌或其他活性的功能化合物結合使用,以提升其綜合作用效果[15-16]。由于殼聚糖對革蘭陽性和革蘭陰性細菌具有高效廣譜的殺滅效果,一直受到研究者的關注,具有較大的商業潛力。近年來,國內外研究學者發現殼聚糖在抑菌方面有著顯著的效果,李佳藝等[17]研究得出殼聚糖,茶多酚和溶菌酶復合保鮮可有效減緩魚肉品質變化;Vivek 等[18]使用殼聚糖介導的綠色合成法制備穩定銀納米粒子與聚乙烯醇共混,形成靜電紡纖維復合納米層,得出此復合材料能抑制包裝食品的微生物降解,延長食品保質期一周。學者還探討了殼聚糖對微生物的作用機制,其中李小芳等[19]研究發現細胞膜是殼聚糖對金黃色葡萄球菌作用的主要位點,殼聚糖通過改變細胞膜的滲透性使細胞膜破壞,伴隨大量細胞內容物泄露;柯松等[20]分析了殼聚糖的抑菌性能,發現殼聚糖在特定分子量、特定pH 時,針對某種菌時會有最適抑菌濃度,超過該濃度,殼聚糖的抑菌效果將不會增強,甚至可能下降。然而,目前還未見有殼聚糖對腐生葡萄球菌作用機制的研究報道。
本研究通過測定殼聚糖對腐生葡萄球菌的最小抑菌濃度(Minimum Inhibitory Concentration,MIC),隨后通過分析微生物生長曲線、電導率值、過氧化氫酶(Catalase,CAT)含量、蘋果酸脫氫酶(Malate dehydrogenase,MDH)含量與生物膜生成量等指標的變化,結合掃描電子顯微鏡(Scanning Electron Microscope,SEM)觀察殼聚糖作用后腐生葡萄球菌微觀結構的變化,綜合評價殼聚糖對腐生葡萄球菌的作用機制,以期為殼聚糖更好應用于水產品保鮮提供理論參考。
1 材料與方法
1.1 材料與試劑
腐生葡萄球菌(S.saprophyticus)由上海海洋大學水產品加工與貯藏工程技術研究中心分離純化,鑒定后于-80 ℃超低溫下甘油管凍存。
殼聚糖(白色粉末,脫乙酰度為90%,分子質量70~ 80 ku),上海維編科技有限公司;聚四氟乙烯(poly tetra fluoroethylene,PTFE)膜過濾器,生工生物工程(上海)股份有限公司;胰蛋白胨大豆肉湯(Tryptic Soy Broth,TSB)培養基,青島海博生物技術有限公司;考馬斯亮蘭蛋白測定試劑盒、堿性磷酸酶(Alkaline Phosphatase,AKP)測試盒、過氧化氫酶(Catalase,CAT)與蘋果酸脫氫酶(Malate dehydrogenase,MDH)試劑盒,南京建成生物工程研究所;氯化鈉、無水乙醇、戊二醛等均為國產分析純。
1.2 儀器與設備
DDB-11A 型電導率儀,杭州齊威儀器有限公司;ZQZY-70B 型振蕩培養箱,上海知楚儀器有限公司;Synergy2 型自動酶標儀,美國BioTek 公司;QYC-200 型全溫培養搖床,上海新苗醫療器械制造有限公司;Centrifuge 5810R 型冷凍離心機,德國Eppendorf 公司;DNP-9162BS-型電熱恒溫培養箱,上海新苗醫療器械制造有限公司;UV-2450 型紫外可見分光光度計,日本島津公司;LDZM-40KCS型立式壓力蒸汽滅菌器,上海申安醫療器械廠;MIRAFE-SEMs 型分析型高分辨掃描電鏡,捷克Tescan 公司等。
1.3 方法
1.3.1 菌懸液與殼聚糖溶液制備 菌懸液制備:參考藍蔚青等[11]方法,將腐生葡萄球菌菌種從-80 ℃冰箱中取出,在胰蛋白胨大豆瓊脂(tryptic soy agar,TSA)平板上劃線,30 ℃培養24 h。隨后,挑取單菌落在10 mL 胰蛋白胨大豆肉湯(trypticase soy broth,TSB)中,在37 ℃、150 r/min 恒溫搖床活化培養18 h;再以體積分數1%的接種量接入10 mL的TSB 中,37 ℃、200 r/min 振蕩培養18 h,經5 000 r/min、4 ℃離心10 min,收集菌體后棄去上清液,用質量分數0.85%生理鹽水重懸,調節菌懸液濃度為106CFU/mL,4 ℃保存備用。
殼聚糖溶液制備:用體積分數1%乙酸為溶劑溶解殼聚糖,配制成不同濃度的殼聚糖溶液,通過0.22 μm PTFE 膜過濾器過濾滅菌待用。
1.3.2 最小抑菌濃度(Minimum Inhibitory Concentration,MIC)測定 參照王小敏等[21]的方法,采用微量肉湯稀釋法測定殼聚糖對腐生葡萄球菌的MIC。由二倍稀釋法將殼聚糖液梯度稀釋,使其最終質量濃度分別為20、10、5、2.5、1.25、0.625與0.312 5 mg/mL,依次將不同濃度的殼聚糖加入菌液,并混和均勻。將加樣后的96 孔板于37 ℃恒溫培養箱中靜置培養24 h,用酶標儀測定D(600 nm)值,孔內細菌生長被完全抑制的最低樣品濃度即為該樣品的MIC。隨后,結合D值和孔液澄清情況選出最澄清的3 個所代表的殼聚糖溶液濃度,將己制備的供試菌菌懸液分別接入3 支滅菌后的TSB 試管中。混勻后將試管置于37 ℃、150 r/min 搖床上振蕩培養24 h,同時從3 支試管中各吸取100 μL 在TSA 平板上涂布后培養,以不加入殼聚糖溶液的菌液為對照組。
1.3.3 微生物生長曲線繪制 將己制備的供試菌菌懸液分別加至MIC、2MIC 殼聚糖溶液中,以無菌水處理組為對照。37 ℃、150 r/min搖床培養24 h,每1 h 取樣,測定其D(600 nm)值,實驗重復3次。以時間(h)為橫坐標,D值為縱坐標,繪制殼聚糖對腐生葡萄球菌的生長曲線影響。
1.3.4 電導率值測定 采用盧曉等[22]的方法,稍作修改。將己制備的供試菌菌懸液分別加至MIC、2MIC 殼聚糖溶液中后繼續培養,每2 h 取樣一次。將1 mL 培養液4 000 r/min 離心10 min,上清液稀釋20 倍后,用電導率儀測定其電導率,以不加殼聚糖為對照,實驗重復3 次。
1.3.5 堿性磷酸酶(Alkaline Phosphatase,AKP)含量測定 將己制備的供試菌菌懸液分別加至MIC、2MIC 殼聚糖溶液中,以37 ℃、150 r/min培養12 h,每2 h 取樣一次,取2 mL 細菌溶液置于離心機中,4 ℃、4 000 r/min 離心10 min,取上清液,按AKP試劑盒說明書進行堿性磷酸酶含量測定,以不加殼聚糖為對照,重復測定3 次。
1.3.6 過氧化氫酶(Catalase,CAT)含量測定 參考廖石榴等[23]的方法,將己制備的供試菌菌懸液分別加至MIC、2MIC 殼聚糖溶液中,以37 ℃、150 r/min 培養12 h,每2 h 取樣一次,取10 mL 懸浮液低溫超聲2 min 后,4 ℃、4 000 r/min 離心12 min,取上清液,按CAT 試劑盒說明書進行酶含量測定,以不加殼聚糖為對照,重復測定3 次。
1.3.7 蘋果酸脫氫酶(Malate dehydrogenase,MDH)含量測定 參考周磊等[24]的方法,稍作修改。將己制備的供試菌菌懸液分別加至MIC、2MIC 殼聚糖溶液中,以37 ℃、150 r/min 培養12 h,每2 h 取樣一次,取2 mL 懸浮液4 ℃、3 000 r/min 離心15 min,棄上清液,用Tris-HCl(0.1 mol/L,pH 7.4)洗滌3 次,再加入等體積溶菌酶(2.0 g/L),38 ℃靜置15 min,待菌體發黏時冰浴,再加入Tris-HCl,5 000 r/min 離心12 min,取上清液按CAT 試劑盒說明書進行酶含量測定,以不加殼聚糖為對照,重復測定3 次。
1.3.8 生物膜生成量測定 將制備好的菌懸液與TSB 培養基按體積比1∶3 的比例加入96 孔板中,每孔200 μL,在28 ℃條件下培養48 h,取出孔板,棄去浮游菌,用250 μL 無菌生理鹽水清洗2 次,然后60 ℃干燥固定30 min,每孔加入體積分數0.1%的結晶紫溶液200 μL,染色5 min 后,用250 μL 無菌生理鹽水清洗3 次,干燥,再加入體積分數33%的冰乙酸200 μL,放置10 min,用酶標儀測D(595 nm)值。
1.3.9 掃描電鏡分析 參考Xu 等[25]方法測定腐生葡萄球菌細胞結構變化。將己制備的供試菌菌懸液分別加至MIC、2MIC 殼聚糖溶液中,以37 ℃、150 r/min 振蕩7 h 后,得到進入生長對數期的菌液。將一定量的細菌溶液以4 000 r/min 離心4 min,棄去上清液。細胞用pH 7.4 磷酸鹽緩沖液(Phosphate buffer solution,PBS)進行3 次洗滌,在4 ℃冰箱中用體積分數2.5%戊二醛固定4 h。以不同體積分數乙醇(30%、50%、70%、90%、100%)依次脫水,并置于-80 ℃冰箱中冷凍保存4~8 h 后,冷凍干燥24 h。最后涂在金屬箔上固定并噴金,在掃描電鏡下觀察細胞形態。
1.4 數據處理
數據用軟件Origin(Pro)8.5 繪制曲線,數據間差異通過統計軟件SPSS13.0 中的Duncan 新復極差法進行方差分析與多重比較,結果以平均值±標準偏差表示。實驗數據由3 次平行實驗平均值獲得。
2 結果與分析
2.1 最小抑菌濃度MIC 確定
通過前期對菌懸液的D(600 nm)值測定,并結合菌懸液澄清度變化情況(表1)可知,0 h,對照組菌液澄清,處理組菌液呈現殼聚糖溶液原色;12 h,對照組菌液混濁,表明腐生葡萄球菌已進入對數期,而2.5、1.25 與0.625 mg/mL 殼聚糖處理組試管中的菌液變得澄清;培養24 h 后,可觀察到對照組菌液的混濁程度加深,表明菌體已進入穩定期,代謝產物隨之積累,此時0.625 mg/mL 殼聚糖管已混濁。由后期3 個濃度加入殼聚糖處理組菌液涂布平板培養的最終結果判斷得出殼聚糖對腐生葡萄球菌的MIC 為1.25 mg/mL。

表1 殼聚糖對腐生葡萄球菌生長的作用效果Table 1 Effects of chitosan on the growth of Staphylococcus saprophyticus
2.2 殼聚糖處理對微生物生長曲線的影響
將MIC 與2MIC 殼聚糖液加入腐生葡萄球菌菌液中,對該菌的生長曲線影響如圖1 所示。
圖1 表明,處理組和對照組的細菌生長遵循“S”型生長曲線。對照組的腐生葡萄球菌在2 h 后開始進入對數生長期,12 h 后達到穩定期。而MIC 處理下的腐生葡萄球菌在6 h 后開始進入對數期,同時2MIC 下的腐生葡萄球菌仍處于調整期,且在9 h后進入對數期,表明殼聚糖能顯著抑制腐生葡萄球菌的生長(P<0.05)。可能是因為殼聚糖屬于氨基多糖,一定程度上能為菌體生長提供營養,當抑制作用在交互中占主導地位時,使菌體生長受抑;而當殼聚糖作為其促進生長的必要營養時,抑制作用相對減弱[26]。
2.3 殼聚糖對堿性磷酸酶AKP酶含量的影響
堿性磷酸酶(Alkaline Phosphatase,AKP)位于細胞壁和細胞膜間,當細胞壁遭到破壞,AKP被釋放到胞外,因而可通過測定AKP含量來表征殼聚糖對細胞壁的損傷程度[9],其變化過程如圖2所示。
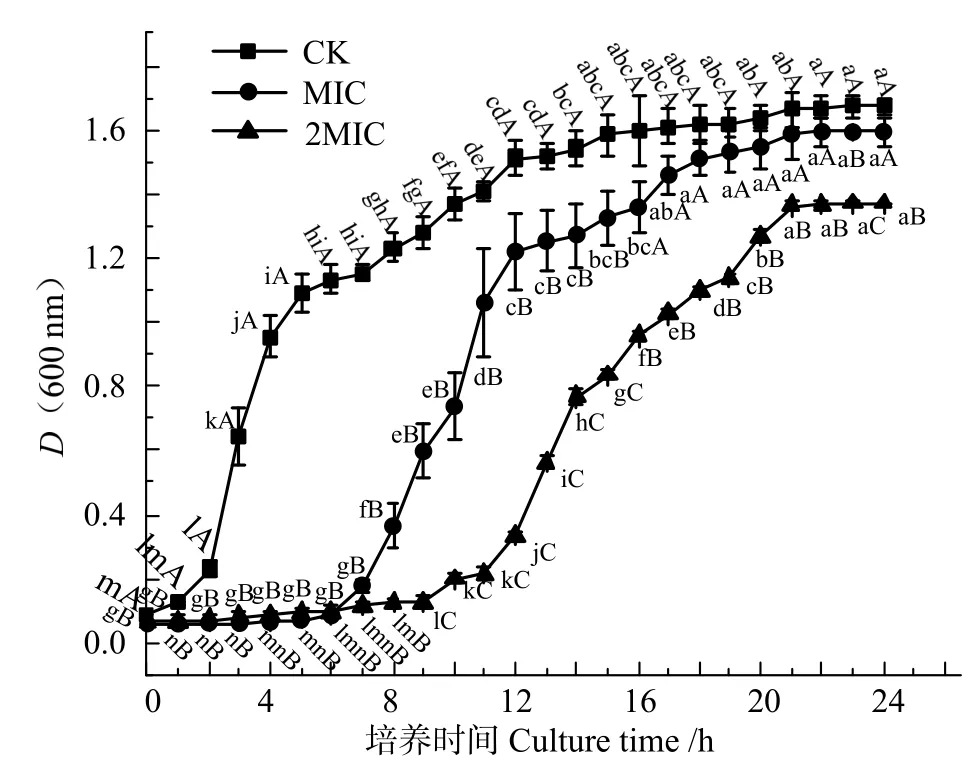
圖1 殼聚糖處理對腐生葡萄球菌生長曲線影響Fig.1 Effects of chitosan on the growth curve of Staphylococcus saprophyticus
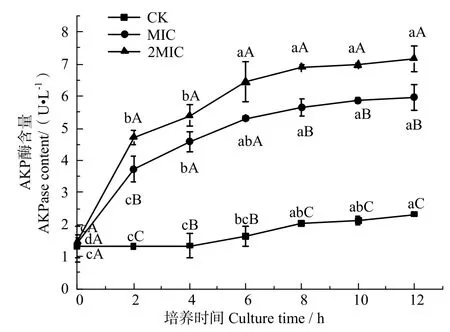
圖2 殼聚糖對腐生葡萄球菌AKP酶含量變化的影響Fig.2 Effects of chitosan on the AKPase content of Staphylococcus saprophyticus
圖2 表明,腐生葡萄球菌經殼聚糖處理后,其AKP酶含量明顯高于對照組,且AKP酶含量高低與殼聚糖濃度呈正比。可見,腐生葡萄球菌經殼聚糖處理后,引起細胞壁的損傷,使細菌細胞壁的通透性與完整性發生改變。AKP酶暴露在膜外,膜的作用被削弱而發生質壁分離,壁膜結構被破壞,細菌失去細胞壁的保護,胞內內容物泄漏而死亡。其中,Raafat 等[27]研究得出革蘭陽性菌的細胞壁成分糖脂質——脂壁酸可為殼聚糖在細胞表面提供分子連接,進一步干擾菌體的膜功能。
2.4 殼聚糖對電導率值的影響
細胞內成分滲漏是細菌細胞質膜受損的決定性標志,反映菌體細胞膜的通透性變化[28]。
由圖3 可知,隨著處理時間的延長,各組處理液的電導率值均有所升高,而與對照組相比,MIC 和2MIC 處理的菌懸液電導率明顯增加(P>0.05)。表明殼聚糖處理可使腐生葡萄球菌細胞懸液的電導率值升高,可能是因為殼聚糖對菌體細胞膜通透性產生影響,導致細胞電解質滲漏,抑制其正常生長代謝,造成菌體死亡。其中MIC 處理組電導率值在4~6 h 處下降,參照圖1 中腐生葡萄球菌生長曲線,可能由于MIC 處理組在4~6 h 腐生葡萄球菌處于延滯期,細胞吸收胞外電解質如K+、Ca2+為對數生長期作準備。從而導致電導率下降,而2MIC組,由于其對腐生葡萄球菌破壞力較強,因而不受影響。與此同時,對照組組菌懸液的電導率值也在緩慢增加,可能由于菌體的自然衰老、死亡引起膜通透性變差。此結果與菌體的生長曲線變化趨勢保持一致。
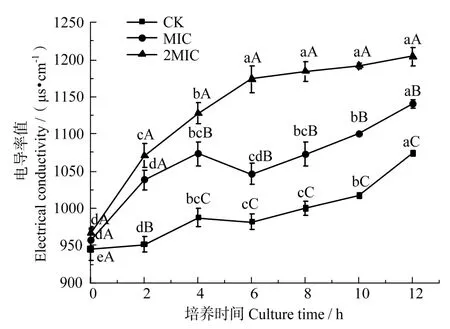
圖3 殼聚糖對腐生葡萄球菌電導率值變化的影響Fig.3 Effects of chitosan on the electrical conductivities of Staphylococcus saprophyticus
2.5 殼聚糖對過氧化氫酶(CAT)含量的影響
細胞膜的損傷和酶的失活可能會嚴重影響細胞代謝[29]。CAT 是細胞內的保護酶,具有清除活性氧自由基,保證細胞膜結構完整度的功能。
圖4 表明,未經殼聚糖處理過的腐生葡萄球菌的CAT 含量總體保持較高水平,在培養6 h 達到最高峰,參照圖1 中腐生葡萄球菌的生長曲線,這可能是因為在0~6 h,腐生葡萄球菌屬于對數生長期,細胞代謝產生大量過氧化氫,細菌調控后產生大量CAT,而后腐生葡萄球菌滴度趨于穩定,CAT 含量下降后保持穩定。而MIC 與2MIC 處理下的菌體CAT 含量在2 h 后快速下降,且在此后保持緩慢降低,到12 h 時兩者基本一致。這可能是因為殼聚糖的大分子結構在處理初期不易進入菌體細胞內,后經破壞細胞壁和細胞質膜進入細胞內,破壞保護酶系統,最終導致細胞菌體死亡。
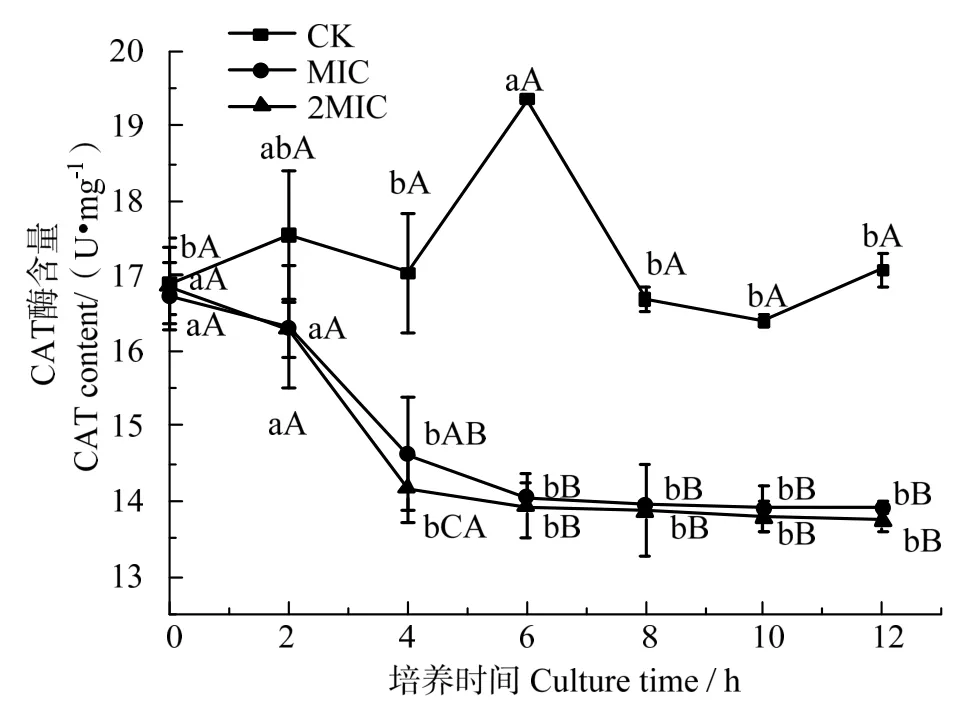
圖4 殼聚糖對腐生葡萄球菌CAT 酶含量變化的影響Fig.4 Effects of chitosan on the CAT content of Staphylococcus saprophyticus
2.6 殼聚糖對蘋果酸脫氫酶(MDH)含量的影響
MDH 是三羧酸循環中關鍵酶類之一,其酶含量變化可直接反映出細胞的能量代謝情況[30]。由圖5 可知,細菌培養2 h 后,相比于對照組菌懸液11.96 U/mg酶活力,殼聚糖處理組的MDH含量降低67%,表明殼聚糖對腐生葡萄球菌MDH 有明顯抑制作用。同時,殼聚糖濃度對MDH 含量無顯著影響(P>0.050)。酶含量變化反映了腐生葡萄球菌對糖的氧化代謝被抑制,使菌體生長繁殖受到阻礙[23]。
2.7 殼聚糖對生物膜生成量的影響
生物膜是一個微生物群落,其聚集在一起并附著在同一表面上,形成由胞外聚合物(Extracellular polymeric substances,EPS)組成的自生保護層[31]。由圖6 可知,與對照組相比,MIC 組D(595 nm)值下降37.10%,2MIC 組D(595 nm)值下降67.74%,即隨著殼聚糖濃度的增大,抑制率明顯升高,表明殼聚糖對腐生葡萄球菌的生物膜形成能力有較好抑制作用。
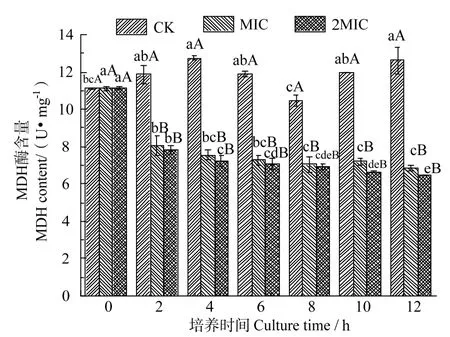
圖5 殼聚糖對腐生葡萄球菌MDH 酶含量變化的影響Fig.5 Effects of chitosan on the MDH content of Staphylococcus saprophyticus

圖6 殼聚糖對腐生葡萄球菌生物膜形成能力的影響Fig.6 Effects of chitosan on the biofilm formation of Staphylococcus saprophyticus
2.8 殼聚糖處理前后腐生葡萄球菌微觀結構
由圖7 可知,未經處理的腐生葡萄球菌細胞呈現正常形態且飽滿;然而,經殼聚糖處理的腐生葡萄球菌培養7 h 后,細胞形狀不規則,表面呈不規則皺褶,出現破損細胞或細胞碎片,黏附聚集明顯。以上變化表明,殼聚糖破壞了腐生葡萄球菌的外部結構,導致蛋白質、核酸等細胞質成分的泄漏。藍蔚青等[32]通過掃描電鏡觀察ε-聚賴氨酸處理腐生葡萄球菌,發現其可使細菌體表粗糙、扭曲變形與細胞相互黏結。

圖7 腐生葡萄球菌經殼聚糖處理前后的掃描電鏡Fig.7 Scanning electron micrographs of staphylococcus saprophyticus before and after treatment with chitosan
2.9 殼聚糖對腐生葡萄球菌作用分析
綜合如上指標分析結果,殼聚糖對腐生葡萄球菌作用機制如圖8 所示。
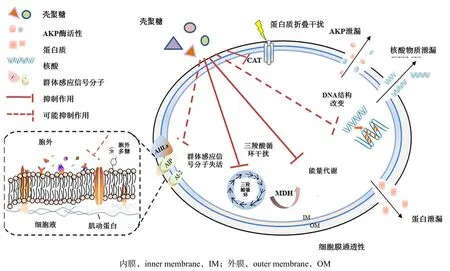
圖8 殼聚糖對腐生葡萄球菌作用機制示意Fig.8 Action mechanism of chitosan on Staphylococcus saprophyticus
由圖8 可見,殼聚糖的作用位點多樣,其可改變細胞膜通透性,對細胞中的CAT 酶、三羧酸循環、能量代謝產生干擾,導致AKP酶、核酸及蛋白質泄漏,使其DNA 結構的改變,干擾群體感應分子,使其失活,這解釋了本研究結果中CAT 酶與MDH含量降低,AKP酶含量和電導率值上升,同時掃描電鏡結果中殼聚糖處理后腐生葡萄球菌的外部結構遭到破壞。然而,殼聚糖對菌體細胞膜、信號分子的分泌與接收、能量代謝與物質循環、增殖與傳代等影響仍需深入研究,正如本研究中殼聚糖處理組明顯降低腐生葡萄球菌的生物膜生成量。該研究結果與RAI M 等[32]綜合分析結果相似;同時,在菌體外部普遍存在的胞外基質(extracellular matrix,ECM)中,作為群體感應系統中關鍵因素的AHLs等信號分子及胞外多糖(extracellular polysaccharide,EPS)在不同菌種間的差異性可能也會對不同菌株對殼聚糖的耐受力產生一定影響。因此,后期可通過群體感應機制研究,深入探究殼聚糖對水產品特定腐敗菌的作用機制。
3 結論
本研究探究殼聚糖處理對腐生葡萄球菌的作用機制,測定,其對腐生葡萄球菌的MIC 為1.25 mg/mL,經菌體經MIC 和2MIC 處理后,CAT 與MDH 含量降低,電導率值上升,對腐生葡萄球菌的生長曲線產生較大影響,且使腐生葡萄球菌的生物膜生成量明顯降低。掃描電子顯微鏡觀察發現,經殼聚糖處理的腐生葡萄球菌細胞形狀不規則,表面呈不規則皺褶,出現破損細胞或細胞碎片,黏附聚集明顯,嚴重時導致蛋白質、核酸等細胞質成分泄漏。殼聚糖能延緩腐生葡萄球菌的生長,抑制菌體生物膜的形成,損壞細胞壁結構,增強其細胞膜通透性,隨后進入細胞內,破壞保護代謝的酶系統,最終導致細胞死亡。

