鈦顆粒誘導骨溶解的不同動物模型形態學研究
張 晨 劉子歌 宋國瑞 李 燕 陳德勝 程萌旗
(1. 寧夏醫科大學臨床醫學院,銀川 750004;2. 寧夏醫科大學基礎醫學院,銀川 750004; 3. 寧夏醫科大學總醫院骨科,銀川 750004; 4. 上海交通大學附屬第六人民醫院關節外科,上海 200011)
人工關節置換術是現階段治療終末期骨性關節炎的重要方法,它不僅能有效緩解關節疼痛,還能重建關節功能。隨著中國老齡化人口正以比總人口增長更快的速度增加,中國人工關節置換術也呈遞增趨勢。僅2018年,國內共完成近70萬人工關節置換術[1]。人工關節置換術后的假體無菌性松動是此類手術主要的并發癥之一,松動失效的人工關節需要行翻修手術治療,給患者帶來巨大的痛苦和經濟壓力[2]。現階段,假體無菌性松動的機制未知,而研究[3-4]顯示假體磨損產生的磨損顆粒會誘導慢性炎性反應,促進假體周圍骨吸收及假體無菌性松動。考慮到臨床現狀及醫學倫理學限制,研究人員難以獲得早期假體松動標本,因此,制作能夠真實模擬假體松動周圍病理生理環境的動物模型對研究其病理機制至關重要。本研究用鈦顆粒誘導3種動物模型,模擬不同的假體松動病理生理環境。
1 材料與方法
1.1 實驗動物與分組
選用在寧夏醫科大學實驗動物中心SPF級動物房飼養的近交系雌性BALB/c小鼠共55只,鼠齡8~10周,體質量(22.6±3.4) g,健康狀況良好,實驗動物許可證號:SCXK(京)2016-0008。小鼠適應性飼養1周后進行實驗,5只/籠。將45只小鼠采用數字表法隨機分為顱骨模型組(A組)、氣囊模型組(B組)及氣囊植骨模型組(C組),每組各15只,另外10只作為氣囊植骨模型組顱骨骨片供體。本實驗獲得寧夏醫科大學實驗動物管理和使用委員會審批通過。
1.2 鈦顆粒準備
鈦顆粒購自美國Alfa Aesar公司(Ward Hill, MA),選用商品化純鈦顆粒,顆粒直徑<20 μm。實驗前鈦顆粒進行去除內毒素測試和內毒素處理,內毒素檢測試劑盒購自上海潤成生物科技有限公司。去內毒素處理后鈦顆粒浸泡于100%(體積分數)無水乙醇,之后將鈦顆粒與無水乙醇混合液置于離心管離心出鈦顆粒;去除漂浮在上層的無水乙醇,加入磷酸鹽緩沖鹽水(phosphate buffer saline, PBS)液洗滌3遍,最后加入無菌PBS液,將鈦顆粒制成濃度為300 g/L的顆粒懸液。
1.3 試劑與儀器
蘇木精-伊紅(HE)染色、乙醇、PBS 液購自銀川潤研生物技術有限公司;光鏡采用日本Olympus DP70電子顯微鏡系統進行拍攝,離心加速機購自Sal-feadent公司;真空烘箱、石蠟包埋機、石蠟切片購自日本Olympus公司;透射電子顯微鏡采用的是日本Hitachi Kyoto透射電子顯微鏡(型號Hitachi H-7650)下觀察。
1.4 實驗方法
1.4.1 動物模型的建立
(1)鈦顆粒刺激顱骨骨溶解模型組(A組):用4%(質量分數)水合氯醛,按照0.11 mL/kg對小鼠進行腹腔麻醉,麻醉成功后對小鼠頭部充分脫毛、碘伏消毒、鋪無菌巾,沿小鼠顱頂矢狀線(小鼠外耳道連線中點的垂線)將小鼠頂部皮膚切開1.0~1.5 cm,充分暴露小鼠顱頂1 cm2范圍骨膜,用小鑷子或小刀分離顱骨外膜,在外膜下注射0.3 mL鈦顆粒懸液,并使其均勻分布于骨膜表面(圖1A)。無菌線縫合傷口,術后常規給予青霉素抗炎2 d,預防感染。
(2)鈦顆粒刺激氣囊模型組(B組):第1天,4%(質量分數)水合氯醛腹腔注射麻醉后,小鼠背部剃毛備皮、消毒、無菌鋪單,無菌注射器在背部正中注射2 mL 無菌空氣,形成氣囊。第2天,在同一部位向氣囊中注射1 mL 無菌空氣,第3、4、5、6天,連續向氣囊中注射0.5 mL無菌空氣,維持氣囊中存氣量。1周后小鼠背部注射部位無紅腫、硬結、滲出及炎性水腫等反應,氣囊建立。第8天在無菌操作下將0.3 mL鈦顆粒懸液注射進小鼠背部氣囊(圖1B),術后常規給予青霉素抗炎2 d,預防感染。
(3)鈦顆粒刺激氣囊植骨模型組(C組):將顱骨供體的10只小鼠麻醉后脫頸處死,取出約0.5 cm2顱骨骨片,剔除周圍多余軟組織后從中一分為二。15只小鼠氣囊建立成功后,4%(質量分數)水合氯醛腹腔注射麻醉,背部消毒、鋪巾,將已形成的氣囊切開,向內植入一塊顱骨組織,并在顱骨周圍注射0.3 mL鈦顆粒懸液(圖1C)。無菌線縫合傷口,術后常規給與青霉素2 d,預防感染。
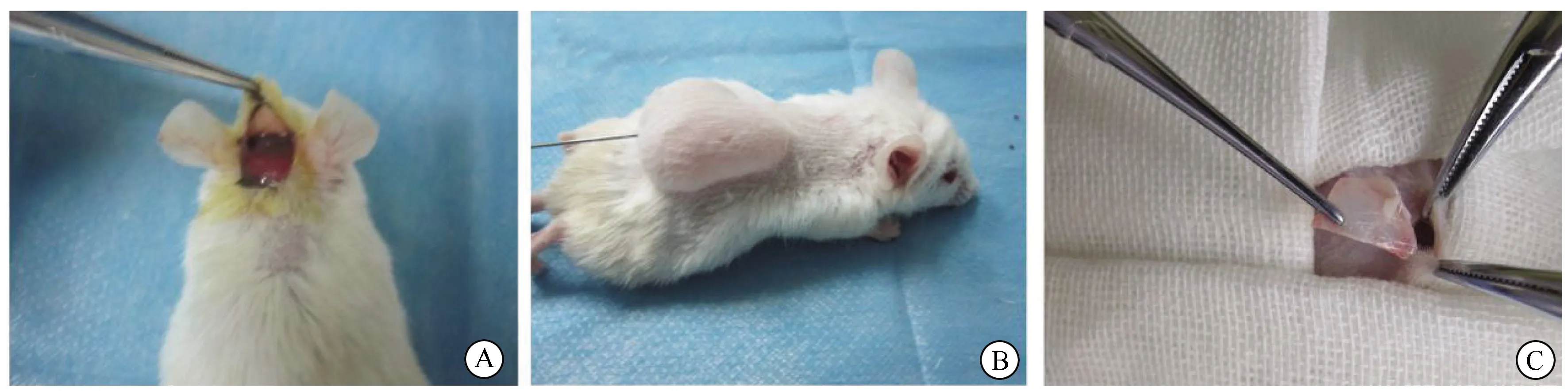
圖1 3組鈦顆粒誘導模型建模過程Fig.1 Modeling process of three groups of titanium particles induced modelA: Titanium particles stimulate skull osteolysis model; B: Titanium particles stimulate balloon model group;C: Titanium particles stimulate balloon model of bone graft.
1.4.2 標本采集及處理
建模完成14 d后,小鼠麻醉后脫頸處死,分別取出顱骨模型組的顱骨骨片、氣囊模型組的囊壁組織及氣囊植骨組的顱骨骨片和囊壁組織,分為兩份。一份標本用PBS緩沖液體沖洗,浸泡固定于0.1 mol/L中性多聚甲醛24 h。A組與B組將骨片組織置于10%(體積分數)EDTA脫鈣液2~3周,每隔4 d需要更換一次脫鈣液,待針刺組織無明顯阻力感時取出。骨片及囊壁組織采用不同乙醇梯度按順序進行脫水處理,并且予二甲苯透明處理,浸泡于液體石蠟中,待石蠟凝固包埋后連續6 μm厚度切片,撈片到載玻片中,烤片后待用。一份標本保存在預冷的PBS緩沖液中,以供掃描電鏡觀察。
1.4.3 蘇木精-伊紅(HE)染色
將切片置于37 ℃恒溫箱中過夜,后分別經過二甲苯Ⅰ、二甲苯Ⅱ各20 min,70%、80%、90%、95%(體積分數)乙醇各5 min,超純水5 min脫蠟入水。隨后蘇木精染色2.5 min,超純水沖洗干凈,然后在1%(體積分數)鹽酸乙醇中分化3 s后自來水沖洗干凈,ddH2O中反藍20 min,伊紅染色3~5 s,風干后用中性樹脂封固, 顯微鏡下觀察。
1.4.4 透射電子顯微鏡
將PBS中的標本經0.9%(質量分數)氯化鈉注射液(以下簡稱生理鹽水)沖洗3遍后,置于4%(體積分數)戊二醛固定2 h,再用0.1 mmol/L二甲砷酸鈉緩沖液沖洗3次,固定過夜,生理鹽水沖洗3遍,2%(體積分數)鋨酸固定2 h以上,依次用乙醇、叔丁醇逐級脫水,各15 min。后在4 ℃環境放置24 h以上,放入液氮冷凍,干燥后鍍金,掃描電子顯微鏡下觀察,每個標本截取5個不同視野,應用Image Pro Plus 6.0圖像分析軟件對圖像中骨吸收面積進行統計計算。
1.5 統計學方法
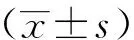
2 結果
2.1 大體觀察結果
A組可見顱骨表面有鈦顆粒浸潤,顱骨骨面不光整,部分骨面有侵蝕缺損。B組氣囊組織中有鈦顆粒浸潤,色灰暗,氣囊囊壁增厚,有炎性水腫,表面較光滑,質地脆,易剝離。C組可見植骨顱骨塊與周圍的氣囊組織之間有單核細胞及淋巴細胞等浸潤,有鈦顆粒包裹,且炎性反應明顯,并伴有新生血管增生(圖2)。
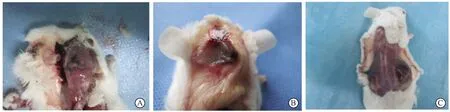
圖2 三組鈦顆粒誘導模型取材過程Fig.2 Material extraction process of three groups of titanium particles induction modelA: Titanium particles stimulate skull osteolysis model; B: Titanium particles stimulate balloon model group; C: Titanium particles stimulate balloon model of bone graft.
2.2 HE染色結果
A組可見顱骨表面鈦顆粒周圍有部分炎性反應,少許團簇狀巨噬細胞及淋巴細胞等炎性細胞浸潤,骨溶解較少,骨面欠平整(圖3A)。在B組可見氣囊囊壁厚,囊壁內有多種巨噬細胞、淋巴細胞等炎性細胞浸潤,周圍炎性反應顯著,成纖維細胞少見,氣囊壁組織可有鈦顆粒聚集,并由巨噬細胞浸潤包繞而結節樣增生,夾雜著成纖維細胞和毛細血管組織(圖3B)。C組可見鈦顆粒周圍有大量炎性細胞浸潤及纖維結締組織增生,引起顱骨骨片表面廣泛骨溶解發生,骨面有塌陷(圖3C)。
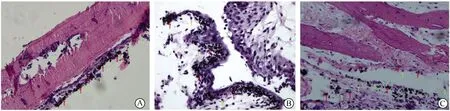
圖3 三組鈦顆粒誘導模型Fig.3 HE staining results of three groups of titanium particles induced modelA: Titanium particles stimulate skull osteolysis model(HE staining,20×). Red arrows are labeled titanium particles, green arrows are labeled inflammatory cells; B: Titanium particles stimulate balloon model group(HE staining,40×); C: Titanium particles stimulate balloon model of bone graft (HE staining,20×).
2.3 透射電子顯微鏡結果
A組可見破骨細胞胞質內見到鈦顆粒,細胞周圍基質可見膠原蛋白及骨樣基質等,鈦顆粒下有部分片狀骨溶解,數量較少,大小不一。B組可見細胞胞質內有鈦顆粒浸潤,巨噬細胞變形,呈皺縮狀,細胞核固縮、核碎裂及核仁消失,細胞內可見大量大小不等的空泡,周圍的細胞外散在有基質組織,基質組織中含水量減少。C組小鼠顱骨骨面缺失,殘缺的骨面下可見有大片骨溶解,骨片周圍有增生的破骨細胞,在其周圍散落著部分活躍的破骨細胞前體細胞,細胞外基質含有大量骨樣基質,細胞胞質可見大小不等的團簇狀鈦顆粒及完整的高爾基體(圖4)。用IPP軟件分析圖像,A組骨溶解面積為(190.67±26.33)nm2,C組骨溶解面積為(228.67±30.06)nm2,兩組比較,差異有統計學意義(t=3.217,P<0.05)。
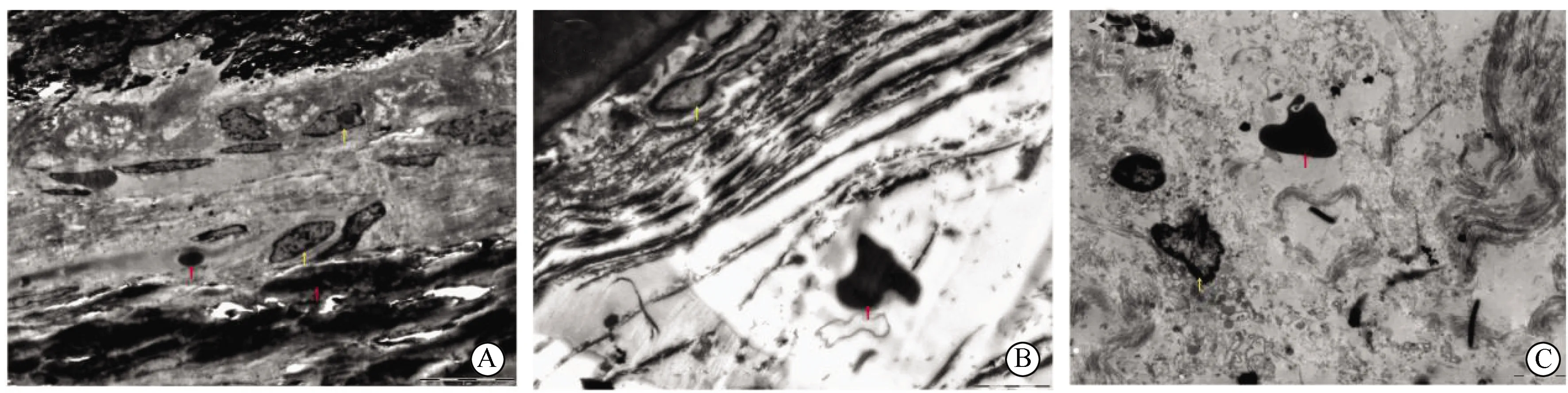
圖4 3組鈦顆粒誘導模型掃描電子顯微鏡結果(5 000×)Fig.4 Scanning electron microscope results of three groups of titanium particles induced modelA: Titanium particles stimulate skull osteolysis model; B: Titanium particles stimulate balloon mode group; C: Titanium particles stimulate balloon model of bone graft. Red arrows are labeled titanium particles, yellow arrows are labeled osteolysis areas.
3 討論
隨著人工假體置換術發展,假體的材料有很多,最常見的是以鈦為原料的金屬類假體,不但耐磨耐腐蝕,而且容易與人的自體骨相適應,但長期的磨損造成的磨損顆粒是導致人工假體松動的重要原因之一[5]。磨損顆粒在人體內到底會引起什么樣的病理生理變化,目前為止并沒有一個確切的答案,由于人體標本取材困難,建立相應的動物模型成為研究此類問題的關鍵。1996年Allen等[6]就開始在大鼠體內植入特制人工假體建立了骨溶解動物模型,證實假體會與周圍的骨組織發生炎性反應,出現了異形細胞。
近年來越來越多的實驗[7-8]選用小鼠制作骨溶解動物模型,采用小鼠作為實驗動物的優勢在于能近似準確地模仿無菌性松動引起的人工假體周圍骨溶解的病理反應過程,簡便、快捷地對破骨細胞進行相應的檢測;更易于研究無菌性松動中破骨細胞增生、成熟、分化;實驗方法簡單,操作步驟簡化。更重要的是,研究[9]顯示,小鼠模型的背部氣囊組織中囊壁組織的細胞組成與人體內滑膜等軟組織類似,為建立真實的人工關節術后模型提供了理論依據。本實驗選用的純鈦顆粒作為磨損顆粒,主要由于純鈦顆粒在純度和顆粒大小都能符合實驗用條件[10]。此外,顆粒需要通過內毒素檢測方可用于實驗,純鈦顆粒在這方面的實驗要求條件已經成熟。合金顆粒由多種金屬材料構成,組成比較復雜,顆粒大小及純度不容易掌控,對于內毒素的內毒素檢測比較困難,單因素控制難以實現[11]。
鈦顆粒刺激小鼠顱骨骨溶解的動物模型是將鈦顆放置于顱骨骨膜缺損區,與骨膜緊密接觸,出現的骨溶解病理環境,可以更好地模擬假體周圍無菌性松動骨組織的病理改變,是一種急性溶骨性病理模型范疇,能快速簡介建立的一種無菌性松動動物模型[12]。與氣囊植骨組相比,骨溶解面積小,且在骨溶解區域外可見破骨細胞,細胞基質有散在的膠原蛋白和骨樣基質,可能是由于有骨重建過程的參與,在鈦顆粒刺激的炎性刺激下,骨髓間充質干細胞會向成骨細胞及軟骨細胞分化[13]。鈦顆粒刺激顱骨模型中,誘導的骨組織有神經、營養和血供支持,可以比較真實地還原磨損顆粒在體內關節腔誘導骨溶解的病理生理環境,可以反映出骨重建過程中成骨細胞的成骨作用與破骨細胞的溶骨反應的動態平衡[14]。而且此實驗模型的構建可以有利于縮短實驗周期。然而,其缺點為磨損顆粒在骨膜外,多引起皮下組織較強的炎性反應,而溶骨時間短,且在皮下組織缺乏關節內環境中相應的組織諸如滑膜組織及其相應的分泌功能[15]。
氣囊模型是在實驗動物皮下注射無菌空氣,在實驗動物背部形成穩定的氣囊組織后,氣囊內部的纖維結締組織不斷成熟,囊壁細胞和囊腔內部基本滲液的有效成分與人關節的滑膜組織相比,具有明顯的相似性[16]。本實驗通過構建小鼠氣囊的動物模型基礎上,選用鈦顆粒作為磨損顆粒注入氣囊內,直接刺激氣囊囊腔出現無菌性炎性反應,用以模擬假體松動病理過程中磨損顆粒對關節周圍軟組織的直接刺激,這也是本實驗創新之處。通過大體觀察,模型組小鼠的氣囊囊壁存在明顯的炎性反應,并伴有新生血管增生,在組織病理學觀察中,氣囊囊壁在鈦顆粒的直接刺激下,有巨噬細胞增生、變性及淋巴細胞浸潤,炎性反應明顯,部分囊壁細胞核固縮、裂解,細胞基質中含水量減少,此病理變化和人工關節無菌性松動的翻修手術中所取滑膜組織炎性反應病理過程具有明顯的相似性,Park等[17]研究顯示,膝關節假體周圍的軟組織彈性減弱、膠原纖維的炎性變是導致假體松動的重要因素之一。通過氣囊模型與氣囊植骨組的對比,可以觀察到骨溶解的發生對囊壁的炎性反應的影響,以模擬人工關節置換術后骨溶解的發生對關節周圍滑膜的影響[18]。
鈦顆粒刺激氣囊植骨模型組是在氣囊建立的前提下,在氣囊內植入骨片及鈦顆粒懸液,以觀察氣囊內出現一系列溶骨病理改變,是一種慢性溶骨性病理模型[19],最大程度還原了關節內磨損顆粒對骨溶解及滑膜炎產生影響的病理生理環境。本組模型大體觀察可見植入骨塊與囊壁組織之間的炎性反應明顯,周圍組織紅腫、滲出并伴有血管增生,組織病理學結果可見在顱骨骨塊表面骨吸收現象明顯,骨塊周圍有增生活躍的破骨細胞,超微結構下可觀察到團狀鈦顆粒周圍部分破骨細胞胞質內高爾基體豐富,這些改變與臨床上人工關節翻修手術中的所取的關節滑膜標本組織的炎性表現類似[20],驗證了氣囊植骨模型中既能保留氣囊囊壁對刺激顆粒的敏感性,又可以模擬人工關節術后晚期顆粒誘導的骨溶解反應的病理過程[21]。但此模型中的骨組織由于缺少血供、神經營養支持,不能將骨溶解中骨組織的自體修復體現出來,不能還原破骨細胞溶骨及成骨細胞修復的動態平衡[22],這一點在研究討論時還需與顱骨誘導模型的骨溶解病理過程相結合。
綜上所述,3種鈦顆粒刺激下的小鼠骨溶解動物模型各有利弊,可以反映不同情況下假體周圍骨溶解的病理變化,同時建立不同的動物模型可以各取所長,更有利于探討人工關節無菌性松動不同階段的病理進程。這3種動物模型中,氣囊植骨模型組不僅能模擬出磨損顆粒刺激產生的界膜組織,也能模擬磨損顆粒誘導的骨溶解反應,在磨損顆粒誘導的骨溶解病理過程中模擬度更高。

