基于ICC自噬探討疏肝健脾法調節功能性消化不良胃腸動力障礙的研究思路?
毛蘭芳, 汪龍德, 杜曉娟, 張 晶, 張 萍, 王淼蕾, 牛媛媛
(1.甘肅中醫藥大學附屬醫院, 蘭州 730020;2.甘肅中醫藥大學, 蘭州 730000)
功能性消化不良(functional dyspepsia, FD)是指起源于胃十二指腸區域的1個或1組癥狀,并且缺乏能解釋這些癥狀的任何器質性、代謝性或系統性疾病,以慢性、持續性、易反復發作為其特點[1,2]。FD的全球發病率約為10%~30%[1],在歐美國家達到20%~25%[3,4],亞洲國家為8%~23%[2-4],在我國約為18%~25%[5]。值得注意的是FD的癥狀常與其他消化道癥狀重疊,需要藥物治療且腹部手術的風險高[6],使得用于診斷和治療FD的醫療資源消耗巨大。目前報道顯示,FD患者的醫保使用率明顯高于無消化不良者[7]。同時,長期反復發作的FD癥狀與病程的遷延導致患者出現不同程度的精神心理障礙[4]。由此可見,FD的高發病率、癥狀的持續、重疊及病程遷延,嚴重影響了患者的心理健康及生活質量,也造成了醫療費用的增加,因此對其研究備受關注。
1.1 FD的發病機制與治療現狀
FD也是一類心理、生理、病理相互作用形成的典型心身疾病,單一的治療原則不能完全改善患者的癥狀[7]。目前尚缺乏高效、針對性強的治療,西藥常用促胃腸動力藥、質子泵抑制劑(proton pump inhibitor,PPI)、抗焦慮/抑郁藥、微生態制劑及安慰劑等藥物治療,但這些藥物特異性差,相對于中藥不良反應多[9]。如促胃腸動力藥會增加心源性猝死、心律失常等心血管不良事件發生的風險[10],長期服用PPI會增加骨折及骨質疏松的風險[11]。因此,西藥的臨床應用存在一定的局限性,如何解決或彌補西醫治療中獲益有限的問題,嘗試探索通過新的補充和替代治療策略成為FD治療研究的思路之一。1項關于FD與中草藥的系統評價指出[12],中草藥在緩解FD癥狀方面優于促胃腸動力劑,此項研究認為當出現促胃腸動力劑和PPI使用禁忌癥時,中草藥可作為治療FD的一種替代方法。然而中醫藥的作用機制尚未完全揭示,明確中醫藥的作用機制為臨床廣泛應用提供理論依據。
目前認為FD的病因及發病機制與多種因素[13,14]相關,包括內臟高敏感性、黏膜免疫功能紊亂、胃和十二指腸炎癥、微生物失調、幽門螺桿菌感染、胃酸分泌增加、遺傳易感性及社會心理等,甚至環境、飲食、藥物等因素也會影響FD的發生,羅馬IV標準則認為FD是腸-腦互動異常[1],這些因素都會直接或間接相互影響導致FD的發生,引起胃腸動力障礙[15]。因此胃腸動力障礙是FD發病的基礎,改善胃腸動力障礙是治療消化吸收功能、內分泌功能及免疫功能的前提。FD胃腸動力障礙的機制主要取決于胃腸道運動的環節。胃腸道的運動一方面來源于胃腸道的肌電活動,Cajal間質細胞(interstitial cells of cajal,ICC)產生的慢波電位是胃腸道肌電活動的起步電位,決定胃腸道平滑肌收縮的節律,是胃腸動力的基礎;另一方面取決于神經遞質及胃腸激素誘導平滑肌的收縮舒張,而ICC亦參與胃腸道神經遞質的信號傳遞,故揭示ICC在FD中的作用,是明確FD胃腸動力障礙的關鍵。
1.2 ICC在FD胃腸動力障礙中的作用
ICC是介于胃腸道神經纖維末端和平滑肌細胞之間的一種特殊間質細胞,ICC具有少量的收縮因子,但含有大量的線粒體、豐富的內質網和不同的細胞膜通道,由一個梭形的胞質體、一個大的橢圓形細胞核和樹突組成[16]。研究發現,FD模型大鼠胃組織中出現ICC體積增大、線粒體腫脹、溶酶體數量增多等超微結構改變,ICC的特異性標志物c-kit及其配體干細胞生長因子(stem cell factor, SCF)的mRNA與蛋白水平的表達降低[17],鈣離子激活的氯離子通道蛋白Ano1在mRNA和蛋白質水平上都有很強的表達[18],Ano1是更具有特異性和敏感性的ICC標記物。
1.2.1 ICC在胃腸道肌電活動中作用 平滑肌細胞(smooth muscle cell, SMC)是胃腸道功能的物質基礎,SMC的收縮-舒張功能異常導致胃腸動力障礙,是胃腸運動的直接靶點。SMC的位相性收縮由ICC產生的慢波驅動,Ano1參與慢波的傳導,其基因敲除對成年小鼠小腸Ca2+瞬變和慢波有明顯的損傷作用[15],體外細胞培養研究也揭示Ano1在ICC增殖中的作用[19]。另外,ICC與SMC之間形成縫隙連接,縫隙連接在介導SMC的同步收縮中起著至關重要的作用,縫隙連接蛋白43(Cx43)是這一過程關鍵蛋白,存在于ICC中,與c-Kit具有共定位作用,缺乏Cx43表達可能是導致平滑肌運動功能障礙的部分原因;與正常大鼠比較,FD模型大鼠Cx43水平明顯降低[20]。
1.2.2 ICC在胃腸道神經遞質信號傳導中的作用 腸神經系統(Enteric Nervous System, ENS)中存在的神經遞質是維持SMC生理功能的信號物質,但兩者之間有80~100 nm的縫隙,導致ENS不能直接作用于SMC。ICC細胞膜上有相應的神經遞質受體,ENS中釋放的神經遞質通過兩者之間的突觸連接與ICC表面的受體結合[21],ICC再通過縫隙連接介導神經信號傳遞至SMC,使之去極化或超極化,從而產生興奮或抑制效果[22]。一般認為,興奮性腸神經遞質乙酰膽堿能受體(acetylcholine, ACh)和P物質(substance P, SP)在FD中低表達,抑制性腸神經遞質血管活性腸肽(vasoactive intestinal peptide, VIP)和一氧化碳(nitric oxide, NO)在FD中高表達[23],課題組前期研究和預實驗結果也證實了這一觀點[24]。
1.3 AMPK-mTOR介導的ICC自噬與ghrelin在FD中的相關性
細胞自噬(Autophagy)是維持細胞生存、緩解細胞內外壓力的重要代謝過程,基礎水平的自噬為細胞提供能量,促進物質循環和細胞自我更新;過度水平的自噬破壞性地降解了有用的蛋白質和細胞器,引起自噬性凋亡[25],因此自噬調節被認為是多種疾病潛在的治療措施。目前在FD大鼠模型中發現,自噬相關蛋白Beclin1和LC3的mRNA與蛋白水平的表達增高,研究結論認為ICC結構和數量異常可能與ICC過度自噬有關[16,26]。
自噬的發生需要通過自噬傳導通路的參與。細胞自噬多條上游信號通路均在雷帕霉素靶蛋白(mTOR)點匯合,抑制mTORC1可上調自噬,刺激mTORC1可下調自噬,mTOR可通過抑制ULK1與下丘腦腺苷酸激活蛋白激酶(AMPK)之間的相互作用抑制自噬發生[27]。AMPK可通過激活ULK1復合體直接誘導自噬,AMPK也可以負性調節mTOR活性,阻斷其對ULK1的抑制作用[28]。因此,在功能上AMPK-mTOR信號通路和自噬是相輔相成的,在對自噬的調控中,AMPK和mTOR既相互獨立又呈上下游的關系。
胃促生長素(ghrelin) 是主要由胃黏膜X/A 樣細胞在接受饑餓信號刺激后分泌的一種腦腸肽,可以促進胃酸分泌,提高胃腸道動力,加速胃排空[29]。已有研究[30]指出,胃動力紊亂可通過調節ICC的功能或通過ghrelin受體激動劑促進食欲來控制惡心。另外,mTOR可能在促進ghrelin分泌的過程中發揮重要的作用。研究表明,胃竇組織中mTOR的變化也會導致ghrelin表達量的改變,從而影響食物攝取[31];研究還發現ghrelin增強下丘腦AMPK及其靶點的磷酸化,這與mTOR的磷酸化水平降低有關[32],表明ghrelin促進FD胃腸動力的作用可能與AMPK-mTOR信號通路有關。因此,ghrelin與ICC及AMPK-mTOR信號通路之間的聯系提示,ghrelin促FD胃腸動力的作用可能與AMPK-mTOR信號通路介導ICC自噬調節有關。目前,尚無從AMPK-mTOR信號通路深入研究FD與ICC自噬的相關性。
1.4 中醫學“肝脾相關”理論與胃腸動力及ICC自噬的關系
FD屬于中醫學“痞滿”范疇,《傷寒論·辨太陽病脈證并治》謂:“但滿而不痛者,此為痞”。FD病位在胃,涉及肝脾。葉天士提出:“脾宜升則健,胃宜降則和”,脾胃同居中焦,為氣機運化之樞紐,清升濁降則氣機條暢,脾胃功能障礙、升降失常則導致該病的發生,故“脾虛不運”是其發病基礎,這與FD胃腸動力障礙的機理具有一致性[33]。葉天士曰:“肝為起病之源,胃為傳病之所”,故見肝之病知肝傳脾。中醫學認為外邪飲食刺激或素體脾胃虛弱,經反復、持久的情志刺激能夠影響脾的運化及肝的疏泄功能,使脾失運化、肝失疏泄、胃不受納而導致FD癥狀的出現,故“肝脾失調”是FD發病的重要環節[34,35]。現代醫學認為,FD多伴有不同程度的焦慮、抑郁、軀體化等精神障礙[36],在導致情緒異常的同時,會引起食欲不振、早飽、噯氣、腹脹等胃腸道反應,再者FD患者大多平素體質較弱,消化吸收功能較差,且神經-內分泌調節失衡,表現為感受性及情緒興奮性過強,這與中醫證候學中的“肝脾吻合”具有一致性。
Nature雜志提出“代謝失衡和消耗過度”與自噬“自我保護和誘導死亡”的作用相關[37],表明細胞自噬具有雙重性。“過猶不及”是中醫學強調陰陽平衡的基本觀點之一,這與“自噬過度”和“自噬不足”的雙重性相一致,因此細胞自噬被認為是陰陽平衡的微觀基礎。國內李秀惠團隊[38]的一項關于自噬與乙肝病毒關系的研究證明了這一觀點。從中醫理論來認識“肝脾相關”理論正是陰陽平衡論的具體體現,“肝疏泄太過或不及”也符合細胞自噬雙重性的特點。此外,細胞器和蛋白質是維持細胞生存的重要物質,其中線粒體將營養物質轉化成ATP,維持機體的生命活動,線粒體的這一功能與脾運化水谷精微,化生氣血,濡養五臟六腑四肢百骸作用極為相似。宋雅芳[39]等研究發現,脾虛模型大鼠細胞線粒體數量減少,線粒體結構損傷。因此,FD發病中的ICC自噬正符合肝木克脾土,臟腑失衡的中醫學“肝脾相關”理論。
1.5 疏肝健脾法治療FD的優勢
肝失疏泄、胃氣上逆、脾失運化是導致FD的主要病因病機,肝郁脾虛是FD的主要證型,治療以疏肝健脾為主要治法,但脾胃功能失調可導致氣滯、血瘀、濕熱、痰飲、火郁、食積等一系列的病理產物,這些病理產物可引起氣機阻滯影響脾胃升降,從而導致胃腸功能障礙,這提示脾胃虛弱是FD的發病基礎,肝氣郁滯是發病條件,痰、火、瘀、食郁是病理產物,國內單兆偉、張照蘭等也肯定了這一理論[40-42]。然而單一的治療原則并不能完全改善患者的癥狀,治療上強調健脾運、疏肝氣、降胃氣基礎上要兼顧代謝病理產物及消食和胃、活血化瘀,除濕化痰,清熱化濕等,從而達到綜合調理的目的,這與國醫大師周信有“復方多法、綜合運用、整體調節”的學術思想相吻合。現代藥理學研究亦表明,中藥理氣藥、活血化瘀藥、健脾消食藥或潤腸通便藥能夠不同程度促進、抑制或雙向調節胃腸動力[43]。課題組前期基于“肝脾相關”理論,發現以疏肝健脾法為代表的中藥復方制劑平胃膠囊,改善胃腸動力障礙的作用與SP、VIP、ghrelin等腦腸肽的異常表達相關[44-46]。
綜上,胃腸動力障礙是FD發病的基礎,ICC是胃腸道電活動的起搏細胞,可產生和傳播慢波,參與胃腸道神經遞質的信號傳遞,ICC異常導致FD胃腸動力障礙可能與其自噬相關,細胞自噬的過程由AMPK-mTOR信號通路調節。課題組前期研究發現,FD模型大鼠胃腸動力障礙與ghrelin有關,而ghrelin在FD中的表達與AMPK-mTOR及ICC具有相關性。因此課題組認為,FD胃腸動力障礙可能與ICC自噬相關,ghrelin促FD胃腸動力的作用可能與AMPK-mTOR信號通路介導的ICC自噬調節有關(見圖1)。FD胃腸動力障礙的機理及ICC自噬的觀點與“肝脾相關”理論相吻合。課題組研究亦發現疏肝健脾法促胃腸動力的機制與ghrelin有關。因此,課題組認為,疏肝健脾法通過AMPK-mTOR信號通路介導的ICC自噬調節FD胃腸動力障礙。課題組進一步通過動物實驗進行驗證,研究結果將對于緩解FD胃腸動力障礙、改善患者生活質量具有積極意義。這正是中醫學理論特色和優勢所在,也是中醫學整體觀、辨證觀具體應用的體現,同時是對國醫大師學術思想和經驗的繼承與發展,也為中醫藥治療FD提供了思路與方法。
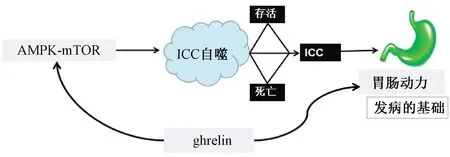
圖1 ICC自噬與胃腸動力障礙圖

