熱加工對小麥蛋白結構和消化特性的影響
(馬夢瑤 謝巖黎 范亭亭 高 浦
(河南工業大學糧油食品學院1,鄭州 450001)
(河南省糧油食品安全檢測與控制重點實驗室2,鄭州 450001)
小麥蛋白也稱谷朊粉,是從小麥粉中分離得到的符合現代膳食營養需求的天然蛋白質[1]。小麥蛋白富含二硫鍵,根據其在乙醇溶液中的溶解性可分為可溶性的單體小麥醇溶蛋白和不溶性的聚集體小麥谷蛋白,麥醇溶蛋白結構有四種類型:α、β、γ和ω型;分子形狀為球形,分子量小,延展性好,彈性小[2];麥谷蛋白是由多肽鏈的分子間二硫鍵形成的大分子聚合物,主要由2種亞基組成,分別為低分子量亞基和高分子量亞基,其分子內含有較多的β-折疊結構,易發生聚集作用,分子結構呈纖維狀,具有彈性,延伸性小[3]。面筋蛋白是多數烘焙產品的主要原料,有助于改善加工過程中面團的流變特性,因此,面筋蛋白在一定程度上決定了小麥粉產品的質量[4,5]。小麥蛋白由于自身獨特的結構而含有大量的疏水性和不帶電荷的氨基酸,具有溶解性差、不易消化的特點,在實際生產和生活應用里受到限制[6,7]。因此,研究提高面筋蛋白的溶解度,改善其功能性質,拓寬其應用范圍十分重要。
物理改性是利用超高壓、超聲波、熱處理及冷凍、超微粉碎等物理方式改變食品中蛋白質空間結構與理化特性的方法, 可以顯著改善蛋白質質地、口感和營養價值, 有利于人體消化吸收,提高蛋白質的利用率。面制品在凍藏過程中, 冰晶會發生遷移和重結晶, 導致面筋蛋白變性出現風味減退等問題[8]。WANG 等[9]研究結果表明,面筋蛋白在凍藏后發生解聚現象,網狀結構變得疏松,熱穩定性下降。黃達維等[10]研究了超聲對面筋蛋白功能性質的影響,發現了當超聲時間達到20 min時,可提高面筋蛋白的起泡性和乳化性。熱加工是食品加工中的主要手段,研究表明熱加工可使蛋白發生降解或聚集,導致含量下降[11]。但是對蛋白進行適當的熱加工可以通過增加蛋白酶的接觸位點來提高其功能特性[12,13]。王曉琳等[14]發現在100 ℃條件下加熱5 min時,花生蛋白的乳化穩定性達到最大值。齊寶坤等[15]研究了不同加熱溫度(80、90、100 ℃)對大豆11S球蛋白處理0~90 min后發現,熱處理會改變大豆11S球蛋白的Zeta電位和平均粒徑。陶汝清等[16]研究發現熱處理會導致大豆蛋白二級結構中β-折疊含量下降、無規則卷曲結構顯著增加。
目前,關于熱處理對面筋蛋白結構和功能特性影響的報道較多,但缺乏對麥谷蛋白、麥醇溶蛋白單體深入的研究。本研究以麥谷蛋白、麥醇溶蛋白為原料,采用不同程度的熱處理,利用激光粒度分布儀、SDS-聚丙烯酰胺凝膠電泳、掃描電子顯微鏡、傅里葉變換紅外光譜和凱氏定氮儀研究不同熱處理時間對小麥蛋白粒徑、亞基、微觀結構、二級結構以及消化特性的影響,以期為改善面筋蛋白的功能特性及新產品的研發提供參考。
1 材料與方法
1.1 材料與試劑
麥谷蛋白(Glu);麥醇溶蛋白(Gli);胃蛋白酶(2 940 U/mg)、胰蛋白酶(300 U/mg),其他試劑均為分析純。
1.2 儀器與設備
ALPHA 傅里葉紅外光譜儀,DL-5-B低速離心機, SU3500掃描電子顯微鏡,BT-9300ST激光粒度分布儀,K1100全自動凱氏定氮儀。
1.3 方法
1.3.1 樣品制備
Gli樣品制備:用75%的乙醇溶解適量的Gli,將形成的Gli溶液放置100 ℃的水浴鍋里分別加熱5、15、30 min,在干燥箱里干燥36 h后得到樣品A1、A2、A3。
Glu樣品制備:將適量的Glu溶于少量的NaOH中,形成的Glu溶液放置在100 ℃的水浴鍋里分別加熱5、15、30 min,在干燥箱里干燥36 h后得到樣品 B1、B2、B3。
1.3.2 粒徑測定
選用BT-9300ST激光粒度分布儀進行粒度測定,以超純水為分散劑,設定實部折射率1.46,虛部折射率0.1。
1.3.3 SDS-聚丙烯酰胺凝膠電泳
根據Laemmli[17]報道的方法, 在不連續緩沖系統上進行SDS-PAGE分析, 分別取麥醇溶蛋白、麥谷蛋白0.01 g放入小試管中,加入1 mL的樣品緩沖液,混勻后放入沸水中水浴加熱5 min,冷卻之后離心。電泳條件:縮膠濃度6%,分離膠濃度15%,上樣量10 μL,以10 μL Maker用作分子量標記,先將電壓調至80 V至樣品進入分離膠后再將電壓調至120 V直至電泳完成。然后將膠取出,染色,脫色,照相分析。
1.3.4 掃描電鏡分析
使用SU3500掃描電子顯微鏡觀察小麥蛋白的網絡結構,取干燥后的樣品平整處進行噴金處理,于2 000倍放大倍數下觀察結構,加速電壓為1.5 kV。
1.3.5 傅里葉變換紅外光譜分析
采用傅里葉變換紅外光譜儀對小麥蛋白二級結構進行表征。紅外光譜采用OPUS軟件進行掃描,測試參數為:分辨率:32-1;掃描次數:16次;掃描范圍:4 000~400 cm-1。樣品粉末與溴化鉀粉末按1∶50(m/m)比例混合后,置于模具中壓片后進行測試。所有樣品圖譜采用OPUS和Peak Fit v4.12件進行校正分析,確定各子峰與各二級結構的對應關系,計算各子峰面積的質量分數。
1.3.6 體外消化率測定
小麥蛋白體外消化率的測定采用胃-胰蛋白酶兩步消化法[18],樣品蛋白含量和沉淀蛋白含量的測定采用GB 5009.5—2010中的凱氏定氮法。模擬胃液:0.1 g胃蛋白酶溶于1 L濃HCl(pH=1.5);模擬腸液:0.533 g胰酶溶于1 L磷酸鹽緩沖液中(pH=8)。具體方法如下:稱取0.5 g樣品于三角瓶中,添加15 mL模擬胃液后在恒溫37 ℃振蕩水浴鍋中以190 r/min 轉速消化3 h;用0.2 mol/L的NaOH將消化液pH調至8.0,添加7.5 mL的模擬胃液后在恒溫37 ℃振蕩水浴鍋中消化2 h。模擬消化實驗結束后立即加入10 mL 20%的TCA終止反應,離心30 min后取沉淀。體外消化率=(粗蛋白含量-沉淀蛋白含量)/粗蛋白含量×100%。
1.4 數據處理
所有實驗均重復3次以上,所有數據均用Microsoft Office Excel 2003進行初步整理,使用Oringin8.5軟件統計分析數據,方差分析采用Duncan多重比較法進行顯著性檢驗(P<0.05),實驗所得數據以(平均值±標準差)表示。
2 結果與分析
2.1 熱處理對小麥蛋白粒徑的影響
由圖1可知,隨著加熱時間的延長,麥醇溶蛋白與麥谷蛋白的平均粒徑在加熱30 min時分別達到了254.3、237.4 μm,可能是熱處理導致蛋白質分子發生聚集,表明較高溫度的熱處理利于大尺寸聚集體的形成。粒徑的D10、D50、D90值可以更加清晰直觀地了解蛋白粒徑的分布情況,D10為累積分布百分比達到10%時的粒徑值;D50為累積分布百分比達到50%時的粒徑值,也稱為中粒徑;D90表示累積分布百分比達到90%粒徑值時對應的粒徑。由表1可以看到,隨著熱處理時間的增加,麥醇溶蛋白的D10逐漸減小,在熱處理30 min后麥醇溶蛋白中粒徑小于15.64 μm 的顆粒只占總顆粒的10%;繼續觀察D50值,發現在加熱處理30 min后麥醇溶蛋白和麥谷蛋白的中粒徑顯著升高,表明在加熱過程蛋白的粒徑發生了明顯的變化,且D50處在130~220 μm之間,說明蛋白粒度組成中中粒徑占的顆粒多為大蛋白顆,也說明顆粒粒徑逐漸增大;麥醇溶蛋白與麥谷蛋白的D90值在未加熱時分別達到了288.9、210.4 μm,可能是由于蛋白樣品中本來就含有大顆粒物質,可以看到隨著熱處理時
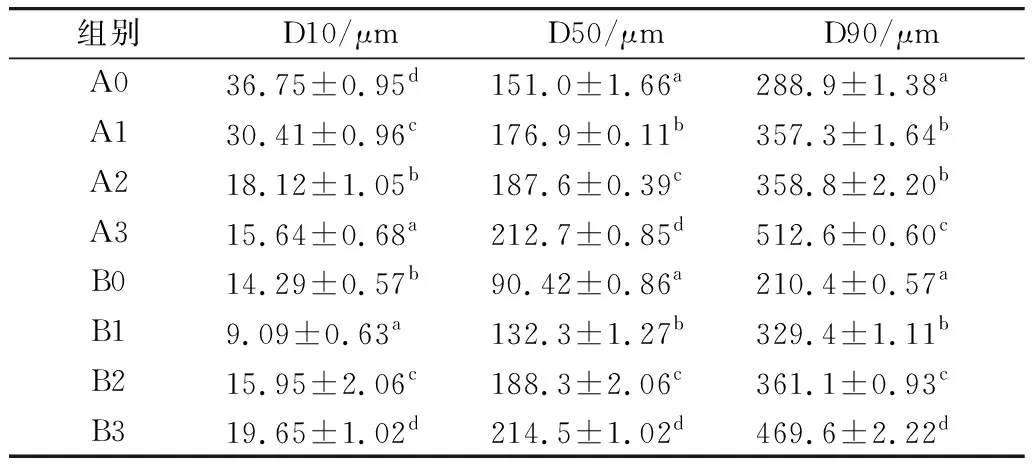
表1 不同熱處理后小麥蛋白的粒徑值
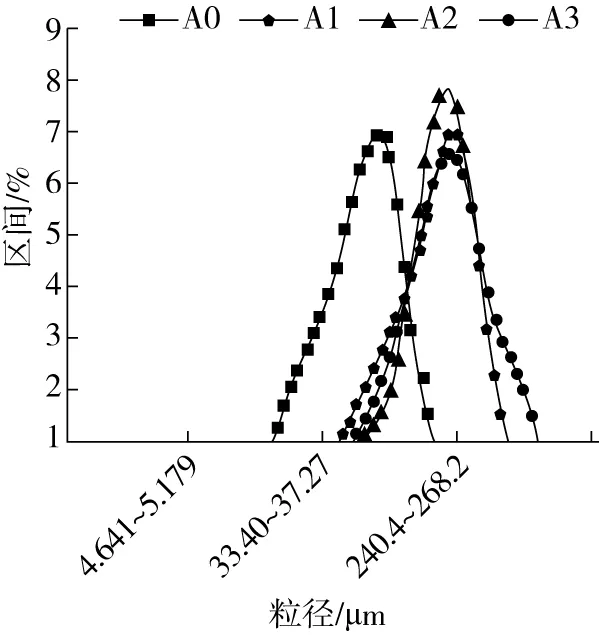
注:A0~A3分別為麥醇溶蛋白熱處理0、5、15、30 min;B0~B3分別為麥谷蛋白熱處理0、5、15、30 min,下同。
間的增加,麥醇溶蛋白與麥谷蛋白的D90表現出大幅度的增長,蛋白顆粒的粒徑的分布也逐漸向大顆粒靠近,說明熱處理時間的延長會加速蛋白質分子的運動,強化蛋白質相互間的碰撞幾率,增強蛋白質分子聚集現象[19]。
2.2 熱處理過對小麥蛋白的SDS-PAGE分析
圖2為麥醇溶蛋白與麥谷蛋白空白組和加熱處理后的SDS-PAGE圖。麥醇溶蛋白的相對分子質量在3×104~8×104u之間,形成的為球狀單體蛋白質;麥谷蛋白是一種可溶性的多肽鏈蛋白質,各肽鏈之間通過二硫鍵連接,相對分子質量在105~107u之間,形成的是高分子聚合物。在SDS電泳系統中,HMW-GS(高分子量麥谷蛋白亞基)在凝膠板的上部,LMW-GS(低分子量麥谷蛋白亞基)處在中部,麥醇溶蛋白在下部[20]。從第一泳道可以明顯看到在分子量75~135 ku內有三條很清晰的條帶,屬于高分子量麥谷蛋白亞基,分子量大且遷移速率慢;觀察麥醇溶蛋白的第5~8泳道可以看到,25~48 ku之間的圖譜顏色比較深,含量較多,分子量小遷移速率快。與空白組小麥蛋白相比,麥醇溶蛋白與麥谷蛋白在經過不同時間的熱處理后,其電泳泳帶數目和相對遷移率都沒有發生顯著的變化,說明小麥蛋白亞基沒有發生變化。在整個加熱過程中,小麥蛋白的亞基不會隨著加熱時間的延長而產生明顯變化。范鵬輝等[21]研究凍藏時間對面筋蛋白亞基的影響,發現麥谷蛋白和麥醇溶蛋白亞基分子量大小和分布均未發生明顯變化。

注:1~8泳道分別為B0、B1、B2、B3、A0、A1、A2、A3。
2.3 熱處理對小麥蛋白微觀結構的影響
通過掃描電子顯微鏡觀察小麥蛋白的網狀結構是了解蛋白結構變化的關鍵[22]。圖3為不同加熱時間下麥醇溶蛋白與麥谷蛋白的微觀結構圖。可以看出,麥谷蛋白比較均勻,表面光滑,呈現規則的紋路;而醇溶蛋白表面較凹凸不平,紋路不規則。100 ℃5 min的麥谷蛋白與麥醇溶蛋白微觀結構與對照組相比有一些差異,蛋白結構出現少量破裂,完整性降低,繼續延長加熱時間,會發現麥谷蛋白和麥醇溶蛋白結構出現嚴重斷裂,已不能形成連續的網狀結構。可能是較高的溫度處理造成小麥蛋白表面張力變大,形成凹陷甚至破裂的不規則表面,這說明熱處理會破壞小麥蛋白完整的網狀結構,并且隨著熱處理時間的增長,小麥面筋蛋白的結構會被進一步破壞[23]。

圖3 熱處理后小麥蛋白的微觀結構圖
2.4 傅里葉紅外光譜分析
圖4是麥醇溶蛋白與麥谷蛋白樣品經過傅立葉去卷積處理和peakfit曲線擬合的酰胺Ⅰ帶(1 600~1 700 cm-1)圖譜,蛋白質的酰胺I帶(1 700~1 600 cm-1)是蛋白質結構特有的峰形[24]。各二級結構所占比例如表2所示,麥醇溶蛋白與麥谷蛋白的二級結構以β-折疊為主,隨著100 ℃熱處理時間的延長,β-折疊含量增大,加熱30 min后含量增加到35.95%、33.21%;而α-螺旋結構的質量分數逐漸減小;β-轉角由未加熱的26.92%、28.12%下降到19.67%、17.63%;在熱處理30 min后,麥醇溶蛋白與麥谷蛋白的無規則卷曲結構的質量分數分別由21.80%、21.56%達到了29.78%、29.76%;說明在加熱過程中α-螺旋、β-轉角向β-折疊、無規則卷曲結構轉變。這應該是由于小麥蛋白在加熱過程中,存在于蛋白質分子相鄰肽鍵間的氫鍵被破壞,維持α-螺旋的氫鍵斷裂,發生解螺旋,α-螺旋結構的質量分數減小;一部分α-螺旋結構展開,蛋白質結構由有序趨向于無序,無規則卷曲結構的質量分數增加;另一部分α-螺旋結構在分子間相互作用下轉換為β-折疊結構,β-折疊結構存在于蛋白質內部折疊區域,通常造成β-折疊結構質量分數的增加,從而改變了蛋白質的二級結構,使蛋白質結構變得疏松不緊密[25]。
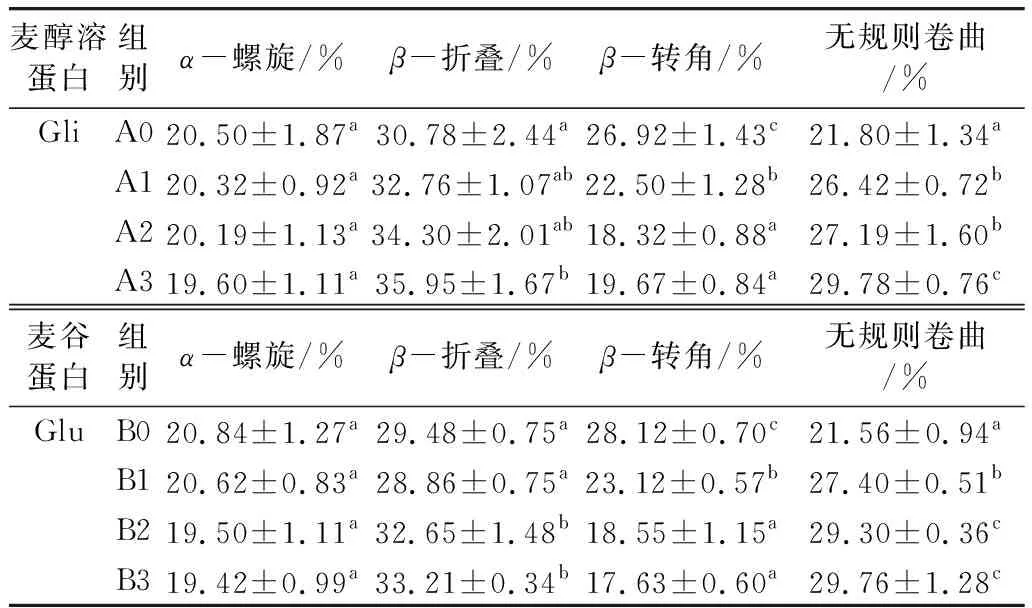
表2 熱處理對小麥蛋白二級結構的影響
2.5 熱處理對小麥蛋白體外消化率的影響
蛋白質在經過熱處理后,會改變其結構和功能性質,導致消化特性發生改變。由圖4可見,經過100 ℃的加熱處理后,麥谷蛋白和麥醇溶蛋白的消化率均有增加;且小麥蛋白在熱處理時間小于5 min時其體外消化率變化不大;但當熱處理超過5 min時,小麥蛋白的體外消化率與熱處理時間成正比。熱處理破壞了蛋白質的二級結構增加其消化性[26],因為加熱會導致蛋白質的疏水鍵、氫鍵、二硫鍵、范德華力等發生斷裂重排,而這些鍵的斷裂重排在一定程度上有利于蛋白消化,此過程需要一定的作用時間,時間越長,作用力越大。

圖4 熱處理對小麥蛋白體外消化率的影響
3 結論
研究熱處理對麥醇溶蛋白和麥谷蛋白結構特征和消化特性的影響,結果表明:小麥蛋白顆粒受熱發生聚集,導致蛋白分子粒徑逐漸向大顆粒轉變;小麥蛋白在整個加熱過程中并不會因為受熱導致亞基含量發生變化;隨著熱處理時間的延長,小麥蛋白的微觀結構從連續網狀向破裂無規則狀態轉換;熱處理會改變小麥蛋白的結構,麥醇溶蛋白與麥谷蛋白都表現為α-螺旋、β-轉角質量分數減小,而β-折疊、無規則卷曲結構質量分數增加;100 ℃的熱處理有利于小麥蛋白的消化吸收,且消化率與熱處理時間呈正比。

