低谷蛋白稻米組分蛋白提取工藝優化
(蘭 艷 隋曉東 王 錦 吳超越 丁春邦 李 天
(四川農業大學農學院/作物生理生態及栽培四川省重點實驗室1,成都 611130)
(四川農業大學生命科學學院2,雅安 625014)
低谷蛋白水稻是指可吸收蛋白 (清蛋白、球蛋白、谷蛋白之和) 含量低于4%的具有輔助療效的功能型水稻品種[1]。食用等量的低谷蛋白大米后,人體不會因攝入過量熱量而使血糖、血脂升高,能有效預防、輔助治療糖尿病和腎病[2]。水稻籽粒中含有7%~10%的蛋白質,一般糙米的蛋白質含量約為8%,精米約7%[3, 4]。根據蛋白質的溶解性,可將其分為四類:水溶性的清蛋白、鹽溶性的球蛋白、醇溶性的醇溶蛋白和堿溶性的谷蛋白[5]。由此,稻米中組分蛋白的提取通常采用連續提取法,即首先用水提取得到清蛋白,其殘渣用稀鹽溶液提取得到球蛋白,再用75%乙醇提取得到醇溶蛋白,最后用堿溶液提取得到谷蛋白[6]。然而,稻米中的四種蛋白質含量差異很大,且同一種蛋白質在不同品種中含量也有差異[7, 8]。據報道,普通稻米胚乳中各類蛋白質量分數分別為:清蛋白2%~5%、球蛋白2%~10%、醇溶蛋白1%~5%、谷蛋白75%~90%[5]。而低谷蛋白稻米中各蛋白組分的含量與普通稻米相差甚遠[9, 10],普通稻米的提取液濃度是否適用還未知;此外,蛋白的提取率還受溫度、料液比、提取時間等因素影響[11]。因此本實驗在連續提取法的基礎上,篩選最適提取液濃度并利用Design-Expert (RSM) 軟件設計實驗條件,優化低谷蛋白稻米各組分蛋白的提取時間、料液比、提取溫度及提取次數,為低谷蛋白功能稻的綜合評價提供參考。
1 材料與方法
1.1 材料與試劑
選取低谷蛋白稻米(D105)為材料,稻谷收獲風干并存放三個月,加工成精米粉碎過篩后烘干供測試用。
G250、牛血清蛋白標準品、無水乙醇、氯化鈉 (AR)、磷酸 (AR)、氫氧化鈉 (AR)。
1.2 儀器與設備
YB-750A粉碎機,THZ-82A恒溫水浴振蕩搖床,Thermo離心機,Analytik Jena Specord 200 Plus雙光束紫外分光光度儀,BT-124S型電子天平。
1.3 實驗方法
1.3.1 提取劑濃度篩選實驗
以各組分蛋白含量為指標,考察提取劑濃度:球蛋白提取劑氯化鈉溶液(0.5、0.6、0.7、0.8、0.9、1.0 mol/L)、醇溶蛋白提取劑乙醇體積分數為(70%、75%、80%、85%、90%)、谷蛋白提取劑氫氧化鈉溶液(0.02、0.04、0.06、0.08、0.09、0.1 mol/L) 對各組分蛋白含量的影響,并固定溫度35℃,時間30 min,提取3次。
1.3.2 組分蛋白含量測定
稻米中組分蛋白提取量的測定采用G250顯色法,取待測液1 mL,加4 mL G250試劑,搖勻,靜置5 min,于595 nm檢測吸光值。以牛血清蛋白標準液濃度為x軸、吸光度為y軸,繪制標準曲線。按公式計算各組分蛋白含量:
蛋白含量=
1.3.3 稻米中各組分蛋白的提取
采取連續提取法對稻米組分蛋白進行提取,具體步驟為:準確稱取精米粉0.300 0 g,按設定料液比例加入超純水,恒溫水浴搖床(190 r/min)振蕩浸提后6 000轉離心10 min,收集多次提取的上清液合并定容,為清蛋白的待測液;對提取過清蛋白的樣品中再加入氯化鈉溶液,重復上述提取步驟,為球蛋白提取液;依次對提取過球蛋白的樣品加入乙醇溶液,提取醇溶蛋白,對提取過醇溶蛋白的樣品中加入氫氧化鈉溶液提取谷蛋白;并按1.3.2 方法測定并計算稻米中各組分蛋白的含量。
1.3.4 單因素實驗
以各組分蛋白含量為指標,分別考察料液比(1∶10、1∶15、1∶20、1∶25、1∶30,固定溫度35 ℃,時間40 min,提取3次)、提取溫度(25、30、35、40、45 ℃,固定料液比1∶20,時間40 min,提取3次)、提取時間(20、40、60、80、100 min,固定料液比1∶20,溫度35 ℃,提取3次)、提取次數(2、3、4、5、6,固定料液比1∶20,溫度35 ℃,時間40 min)、4個因素對各組分蛋白含量的影響。
1.3.5 響應面優化實驗方法
在單因素實驗結果的基礎上,采用Design-Expert 11 (RSM)軟件設計實驗條件,選用Box-Behnken (BB) 模型,以各組分蛋白含量為響應值,料液比(A)、提取溫度(B)、提取時間(C)、提取次數(D) 為自變量,設計4因素3水平響應面實驗 (表1)。
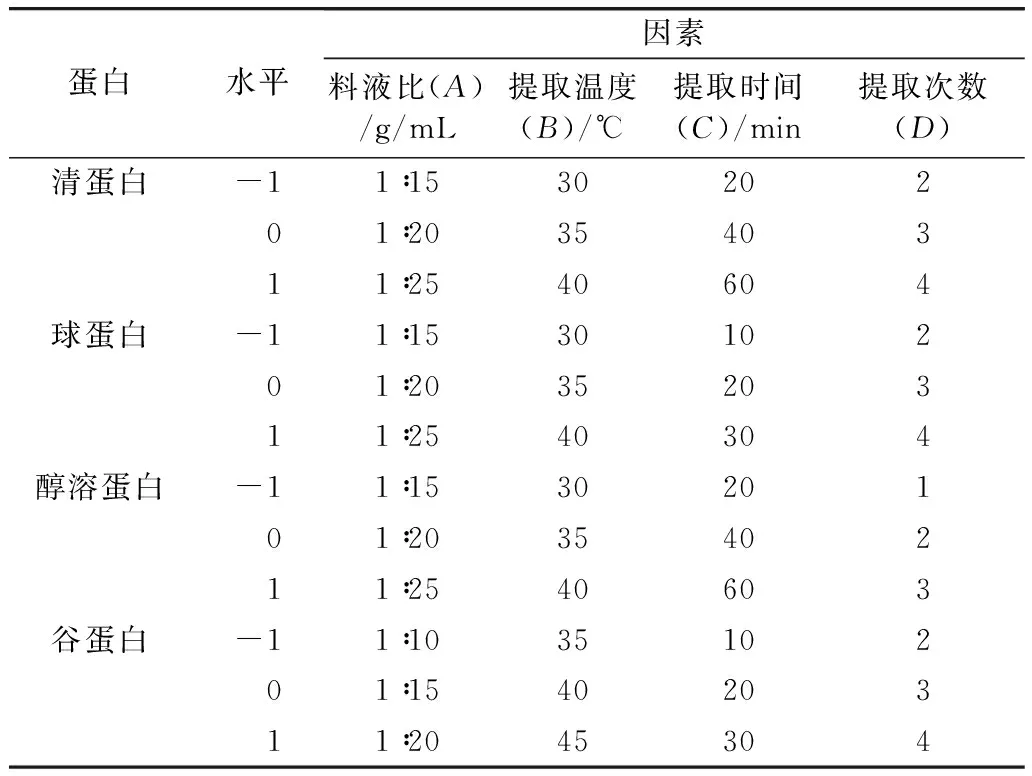
表1 因素水平編碼表
1.4 數據處理
采用Microsoft Excel 2010、SPSS 17.0、Design expert 11、SAS 9.4對實驗數據進行統計分析處理。所有實驗均重復3次。
2 結果和分析
2.1 提取劑濃度篩選
2.1.1 氯化鈉濃度對球蛋白含量的影響
由圖1可知,球蛋白含量隨著氯化鈉溶液濃度的增大呈先增后降的變化,當氯化鈉濃度為0.6 mol/L時,含量達到6.29 mg/g。這可能是較高濃度的鹽離子造蛋白質的部分沉淀,降低了球蛋白的提取量。因此,選擇氯化鈉濃度為0.6 mol/L。
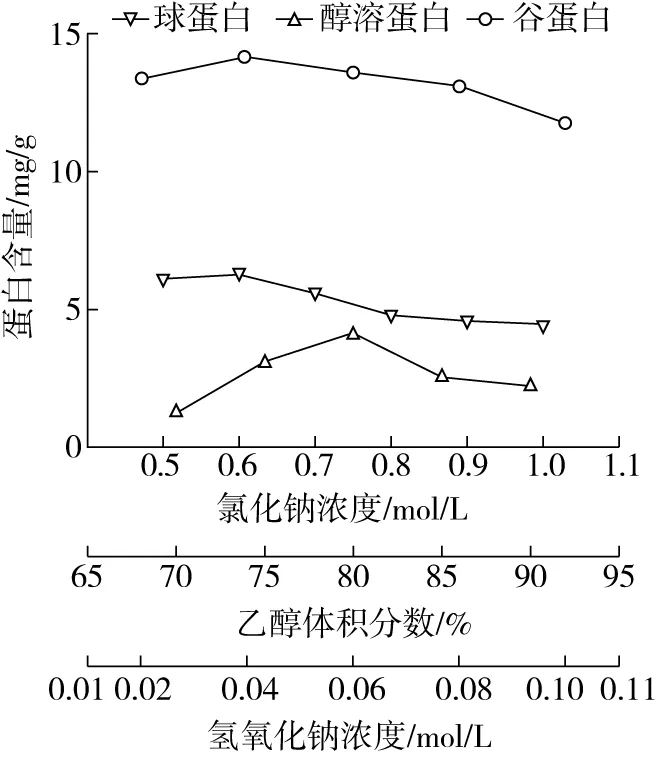
圖1 不同提取劑濃度對各組分蛋白含量的影響
2.1.2 乙醇濃度對醇溶蛋白含量的影響
由圖1可知,醇溶蛋白含量隨著乙醇濃度的增大呈先增后降的變化趨勢,當乙醇體積分數為 80% 時,含量達到4.13 mg/g。這可能是較高乙醇濃度造成蛋白質的結構的破壞,造成部分沉淀,從而降低了醇溶蛋白的提取量。因此,選擇乙醇體積分數為80%。
2.1.3 氫氧化鈉濃度對谷蛋白含量的影響
由圖1可知,谷蛋白含量隨著氫氧化鈉濃度的增大呈先增后降的變化趨勢,當氫氧化鈉濃度為 0.04 mol/L 時,含量達到14.15 mg/g。這可能是氫氧化鈉會與蛋白質發生一定反應,在較高濃度下會降低蛋白質的溶解性,從而降低了谷蛋白的提取量。因此,選擇氫氧化鈉濃度為0.04 mol/L。
2.2 單因素試驗結果
2.2.1 料液比對各組分蛋白含量的影響
由圖2可知,隨著料液比的增加,四種組分蛋白提取量增加,清蛋白、球蛋白、醇溶蛋白、谷蛋白分別在料液比為1∶20,1∶20,1∶25,1∶15達到最大值,分別為5.59,15.27,4.19,20.26 mg/g。當提取料液比超過最大提取值的料液比時,四種組分蛋白提取量逐漸降低;說明此時,稻米四種蛋白已基本溶出,料液比繼續增加,可溶性雜質增多,降低蛋白對溶劑的親和力,降低提取量[12]。因此,響應面分析時清蛋白和球蛋白選擇料液比:1∶15、1∶20、1∶25;醇溶蛋白料液比:1∶20、1∶25、1∶30;谷蛋白料液比:1∶10、1∶15、1∶20。
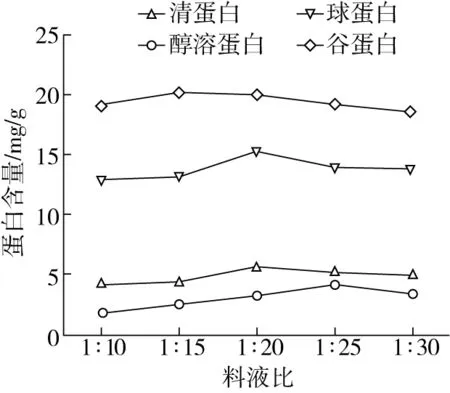
圖2 料液比對各組分蛋白含量的影響
2.2.2 提取溫度對各組分蛋白含量的影響
由圖3可知,當溫度為25~40 ℃時,四種組分蛋白提取量增加,清蛋白、球蛋白、醇溶蛋白都在35 ℃達到最大值,分別為4.59、10.29、2.49 mg/g,谷蛋白在40 ℃達到最大值為19.68 mg/g。當提取繼續增加,四種組分蛋白提取量逐漸降低。這可能是由于實驗中一定的溫度 (35、40 ℃)可以加快分子間的運動,提高蛋白溶解量,但超過一定溫度 (35、40 ℃)時,可能會影響蛋白的結構,使蛋白從溶液中析出,降低提取量[13]。因此,響應面分析時選擇清蛋白、球蛋白、醇溶蛋白提取溫度為:30、35、40 ℃;谷蛋白提取溫度為:35、40、45 ℃。
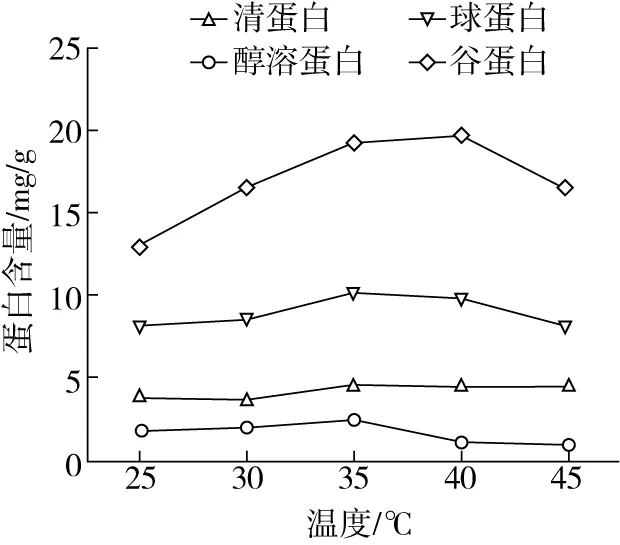
圖3 溫度對各組分蛋白含量的影響
2.2.3 提取時間對各組分蛋白含量的影響
由圖4可知,清蛋白和醇溶蛋白提取量隨提取時間的延長先增加后降低,在40 min達到最大值,分別為4.49、2.49 mg/g。谷蛋白和球蛋白的提取量則隨提取時間延長下降,在提取時間為20 min時達到最大值分別為20.44、9.26 mg/g。當清蛋白和醇溶蛋白提取時間超過40 min;谷蛋白和球蛋白超過20 min時,四種組分蛋白提取量逐漸降低。這可能在40、20 min時稻米四種蛋白已基本溶出,提取時間繼續增加,蛋白質發生部分的沉淀,降低提取量[12]。因此,響應面分析時選擇清蛋白和醇溶蛋白提時間為:20、40、60 min;球蛋白提取時間為:10、20、30 min;谷蛋白提取時間為:10、20、30 min。

圖4 提取時間對各組分蛋白含量的影響
2.2.4 提取次數對各組分蛋白含量的影響
由圖5可知,清蛋白、球蛋白和谷蛋白提取量隨提取次數增加先升后降,在提取次數為3次時達到最大值,分別為 4.59、10.29、21.79 mg/g。醇溶蛋白提取量則隨提取次數增加而降低,當提取次數為 2次時含量達到最大值為1.70 mg/g。當清蛋白、球蛋白和谷蛋白提取超過3 次,醇溶蛋白提取超過2次時,四種組分蛋白提取量逐漸降低;此時稻米四種蛋白已基本溶出,隨著提取次數繼續增加,其他物質溶出量增加,使得最終樣品液中的蛋白發生部分的析出,降低提取量[12]。因此,響應面分析時選擇清蛋白、球蛋白、谷蛋白提取次數為:2、3、4;醇溶蛋白提取次數為:1、2、3。
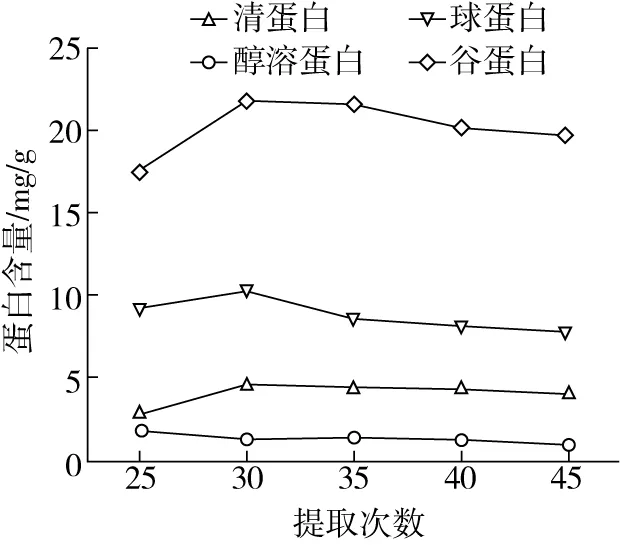
圖5 提取次數對各組分蛋白含量的影響
2.3 響應面實驗結果及分析
2.3.1 響應面實驗設計及結果
基于單因素實驗結果擬確定的最佳條件,以稻米中各蛋白組分對應的提取條件:料液比(A)、提取溫度(B)、提取時間(C)和提取次數(D) 為自變量,以為響應值 (組分蛋白的含量)為因變量,設計4因素3水平響應面實驗,結果見表2。
對表2中的結果進行多元線性回歸擬合,得到稻米中各蛋白組分含量對其相應提取的料液比(A)、提取溫度(B)、提取時間(C)、提取次數(D) 的二次多項回歸方程模型結果如下:
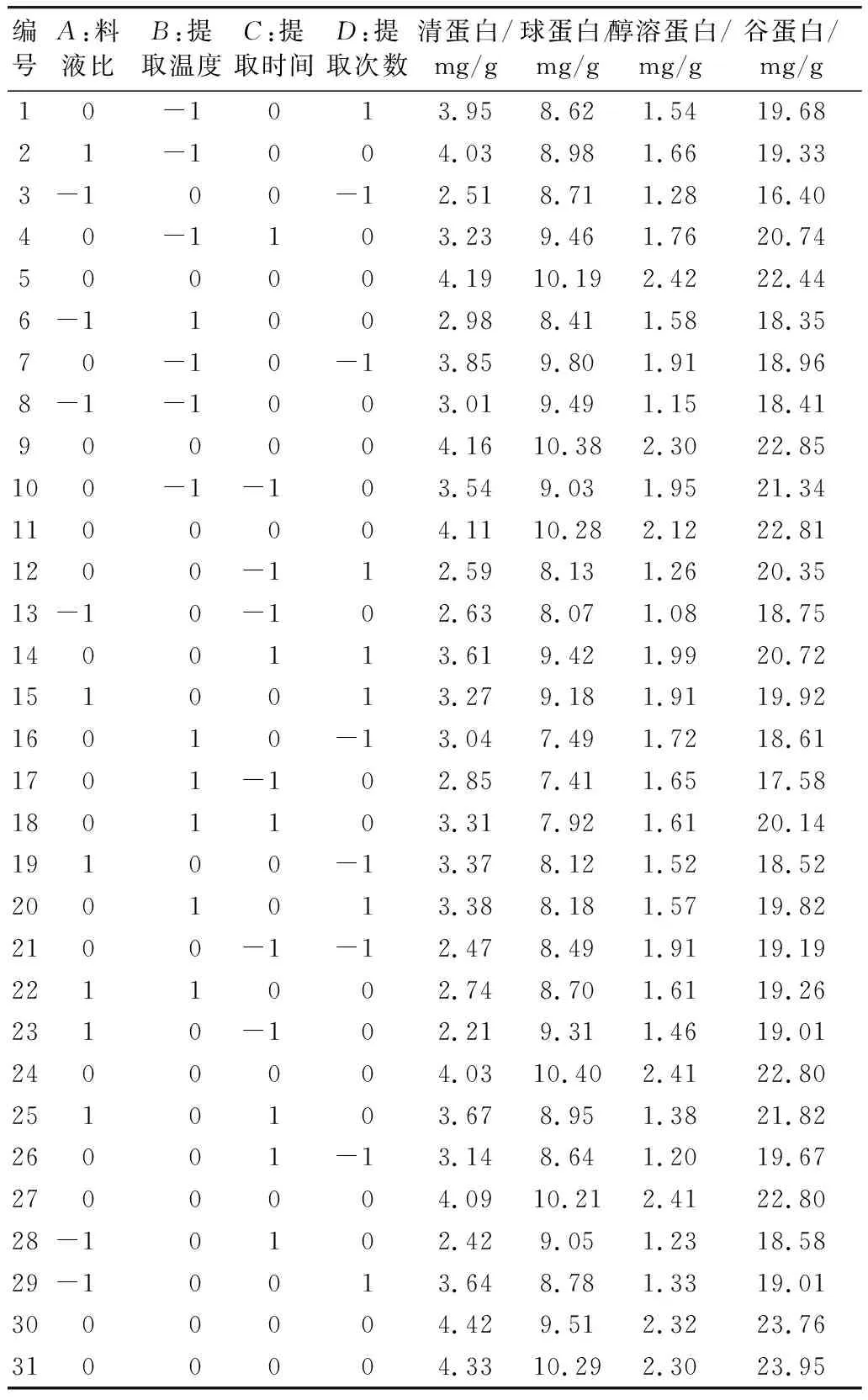
表2 響應面分析方案
清蛋白:Y=1.581 3A+0.781 5B+0.005 5C+3.119 2D-0.012 6AB+0.004 1AC-0.061 5AD+0.001 9BC+0.012 0BD+0.004 4CD-0.027 2A2-0.001 0B2-0.002 0C2-0.385 4D2-29.990 4
球蛋白:Y=0.060 8A-0.605 8B+0.249 2C+0.089 2D+0.200 0AB-0.335 0AC+0.247 5AD+0.020 0BC+0.407 5BD+0.282 5CD-0.552 5A2-0.835 0B2-0.785 0C2-0.825 0D2+10.18
醇溶蛋白:Y=0.1575-0.019 2B-0.011 7C+0.005D-0.120 0AB-050 75AC+0.085 0AD+0.037 5BC+0.055BD+360 0CD-0.566 6A2-0.251 6B2-0.405 4C2-0.322 9D2+2.33
谷蛋白:Y=0.696 7A-0.391 7B+0.454 2C+0.679 2D-0.002 5AB+0.745 0AC-0.302 5AD+0.790 0BC+0.122 5BD-0.027 5CD-2.47A2-0.186B2-1.15C2-2.03D2+23.10
2.3.2 回歸模型的方差分析與顯著性檢驗
利用Design-Expert 11軟件對回歸模型進行方差分析 (analysis of variance,ANOVA),確定各因素對稻米組分蛋白提取的影響程度,同時也檢驗回歸方程的失擬項。從表3~表6可知,經RSM四種組分蛋白獲得的模型極顯著(P<0.01),失擬項P值為0.103 8(清蛋白)、0.344 1(球蛋白)、0.123 4(醇溶蛋白)、0.271 8(谷蛋白),P值均不顯著(P>0.05);相關系數R2=0.896 9(清蛋白)、0.837 4(球蛋白)、0.856 9(醇溶蛋白)、0.900 0(谷蛋白),說明該模型擬合度較好。表明建立的數學模型成功擬合實驗數據,在一定范圍內對稻米中各組分蛋白提取量具有較好的預測性。
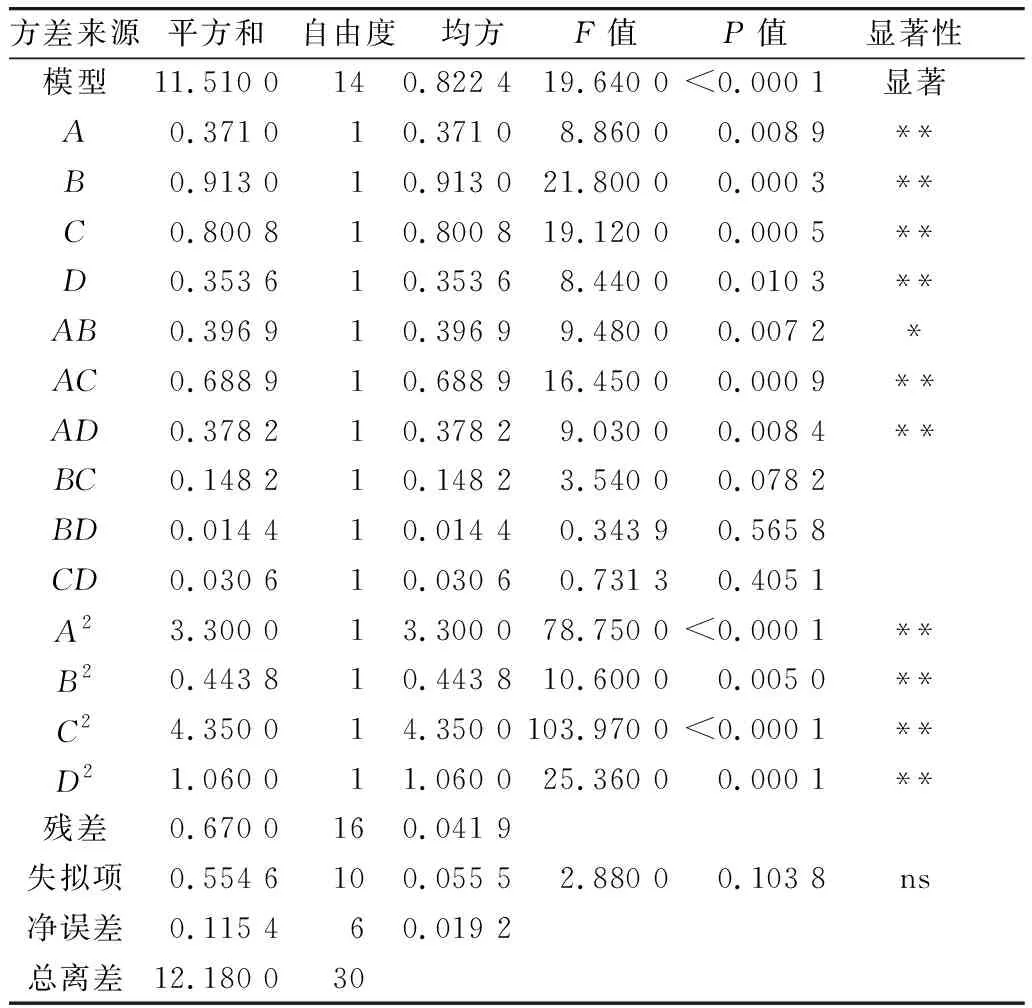
表3 清蛋白響應面回歸模型方差分析
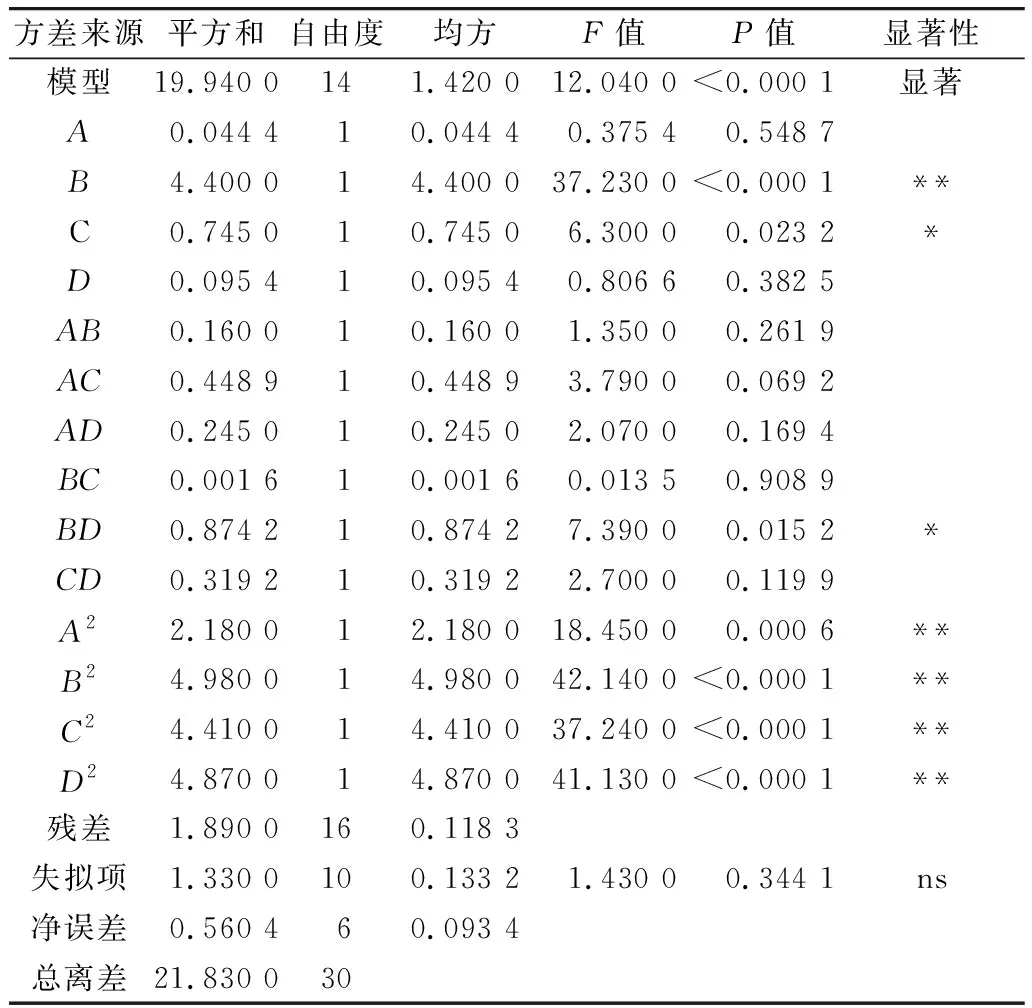
表4 球蛋白響應面回歸模型方差分析
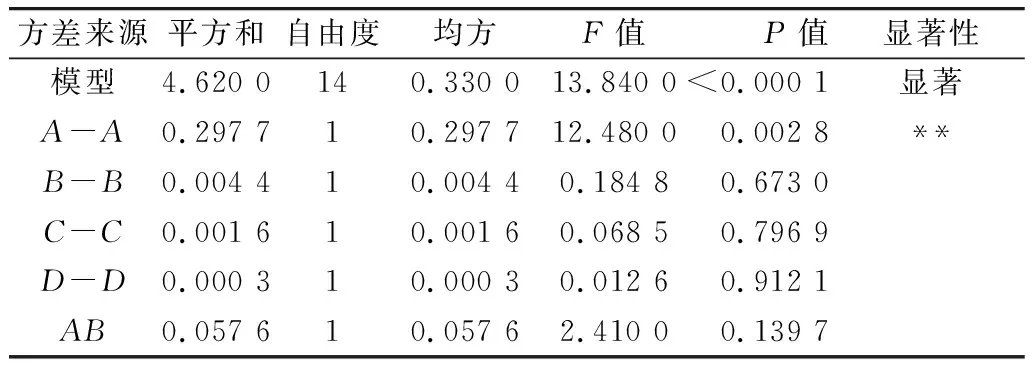
表5 醇溶蛋白響應面回歸模型方差分析
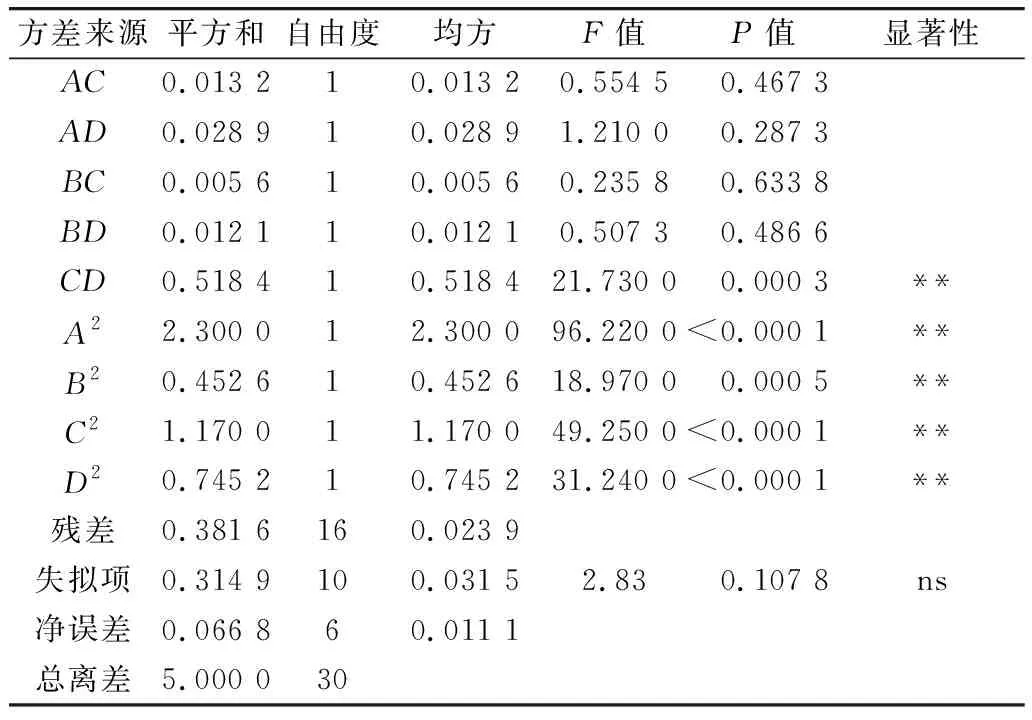
續表5
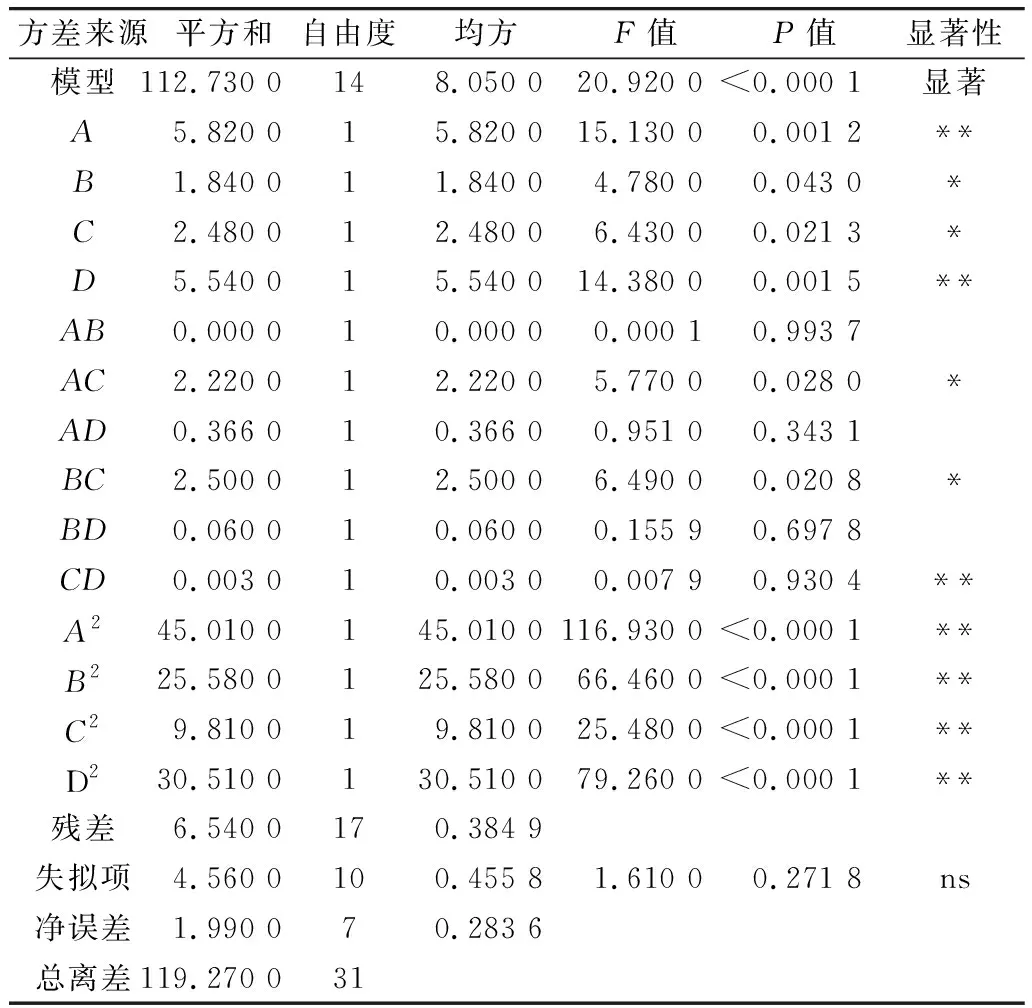
表6 谷蛋白響應面回歸模型方差分析
各因素對稻米各組分蛋白含量顯著性分析可以看出,清蛋白:A、AC、B、C、D、AD、A2、B2、C2、D2的P值小于0.01,AB的P值小于0.05,且根據F值的大小,可以得出四個因素對清蛋白提取量的影響大小為C>A>B>D;球蛋白:B、A2、B2、C2、D2的P值小于0.01,C、BD的P值小于0.05,且根據F值的大小可以得出四個因素對球蛋白的提取量的影響大小為B>C>D>A,且D、A對球蛋白的提取的影響未達到顯著水平,表明D、A對球蛋白的提取影響較B、C小;醇溶蛋白:A、CD、A2、B2、C2、D2的P值小于0.01,且根據F值的大小可以得出四個因素對球蛋白的提取量的影響大小為A>B>C>D,且D、B、C對醇溶蛋白的提取的影響未達到顯著水平,表明D、B、C對醇溶蛋白的提取影響較A小;谷蛋白:A、D、A2、B2、C2、D2的P值小于0.01,AC、BC、B、C的P值小于0.05,且根據F值的大小可以得出四個因素對谷蛋白的提取量的影響大小為A>D>C>B。各模型的顯著性分析也表明各因素對提取的組分蛋白含量的影響并不是一般的線性關系。
2.3.3 響應面分析
根據實驗結果,利用Design-Expert 11軟件作圖,得到四種組分蛋白在不同提取條件下四個因素交互作用的響應面,可直觀反映各因素的交互作用。響應曲面越平緩反應響應值對于因素的改變越不敏感,反之,響應面越陡峭,響應值對于因素的改變越敏感。清蛋白:料液比和提取溫度、提取次數、提取時間的交互曲面陡峭,交互作用顯著,提取溫度與提取時間,提取次數,交互面平緩,交互作用不顯著,提取時間和提取次數交互面也平緩,交互作用不顯著,與方差分析結果一致。球蛋白:提取溫度和提取次數的,交互曲面陡峭,交互作用顯著,其余各因素間的交互曲面平緩,交互作用不顯著。與方差分析結果一致。醇溶蛋白:提取時間和提取次數的交互曲面陡峭,交互作用顯著,其余各項的交互曲面平緩,交互作用不顯著,與方差分析結果一致。谷蛋白:料液比與提取時間、提取溫度與提取時間、提取時間與提取次數的交互曲面陡峭,交互作用顯著,其余各項的交互曲面平緩,交互作用不顯著,與方差分析結果一致。隨著各因素值的增大,響應值逐漸增大,但當響應值達到最大值之后,隨著各因素值的繼續增高,響應值則逐漸降低。
2.3.4 驗證實驗
根據實驗所建立的模型,得到各組分蛋白的提取最佳條件分別為,清蛋白∶料液比1∶21.64,提取溫度 31.57 ℃,提取時間 43.42 min,提取次數 3.06次;球蛋白:料液比1∶19.65,提取溫度 33.1 ℃,提取時間 21.6 min,提取次數2.97次;醇溶蛋白∶料液比1∶20.75,提取溫度 34.63 ℃,提取時間39.6 min,提取次數 2.01次;谷蛋白:料液比1∶15.83,提取溫度 34.7 ℃,提取時間 22.35 min,提取次數 3.15次。在此條件下各組分蛋白的預測提取質量分數分別為4.34、10.31 、2.34 、23.27 mg/g。
考慮到實驗操作的可行性,將優化的提取條件修改為:清蛋白∶料液比1∶22、提取溫度31.6 ℃、提取時間43 min,提取次數 3次;球蛋白∶料液比1∶20、提取溫度33.1 ℃、提取時間22 min,提取次數3次;醇溶蛋白∶料液比1∶21、提取溫度34.6 ℃、提取時間40 min,提取次數 2次;谷蛋白∶料液比1∶16、提取溫度34.7 ℃、提取時間22 min,提取次數 3次。在此條件下進行3 次重復實驗,稻米各組分蛋白的平均提取量分別為,清蛋白:4.26 mg/g,球蛋白:9.76mg/g,醇溶蛋白:2.27 mg/g,谷蛋白:23.60 mg/g,與預測值的相對誤差為 0.018 7(清蛋白),0.056 3(球蛋白),0.030 8(醇溶蛋白),0.014(谷蛋白),表明響應面法優化所得提取條件較好,具有應用價值。
3 結論
提取劑濃度篩選結果表明,稻米球蛋白、醇溶蛋白、谷蛋白隨著提取劑濃度的增加呈先增后降的趨勢;球蛋白提取最適提取氯化鈉溶液濃度為0.6 mol/L、醇溶蛋白最適乙醇體積分數為80%、谷蛋白的最適提取濃度為0.04 mol/L。
單因素實驗結果表明,4種組分蛋白的提取量均隨著料液比的增加呈現先升高后降低的趨勢;清蛋白的提取量隨著溫度的升高呈現先升高后平緩下降的趨勢,而其余3種蛋白的提取量均呈現先升高后降低的趨勢;球蛋白和谷蛋白的提取量隨著時間的增加呈現平緩下降的趨勢,而醇溶蛋白和清蛋白則呈現先升高后平緩降低的趨勢;醇溶蛋白的提取量隨著提取次數的增加呈現平緩下降的趨勢,其余3種蛋白的提取量均呈現先升高后降低的趨勢。
通過Design-Expert 11軟件和Box-Behnken(BB)實驗設計進行響應面優化,得到清蛋白最佳提取工藝:料液比1∶22、提取溫度31.6 ℃、提取時間43 min,提取次數3次,球蛋白∶料液比1∶20、提取溫度33.1 ℃、提取時間22 min,提取次數 3次,醇溶蛋白∶料液比1∶21、提取溫度34.6 ℃、提取時間40 min,提取次數 2次,谷蛋白∶料液比1∶16、提取溫度34.7 ℃、提取時間22 min,提取次數 3次。結果表明,相比普通稻米提取,該方法不僅提取率高,還節約了提取成本和提取時間。

