玉米花絲多糖的提取制備與抑菌作用研究
于小磊, 孟 鑫, 丁 楠, 金 萍
(錦州醫科大學食品科學與工程學院,遼寧錦州 121001)
玉米須多糖是禾本科植物玉蜀黍的花柱和柱頭(稱玉米須) 所含有的多聚糖,其大部分由已糖和戊糖聚合而成,在酸溶液中的最終水解產物為阿拉伯糖、木糖、半乳糖等。 玉米須多糖具有免疫活性,可降血糖、降血壓、抗癌、抗菌等(陳圣陽等,2016)。 我國是玉米生產國之一,在我國現有的0.93 億公頃耕地之中, 玉米面積約為0.21 億公頃,占耕地面積的1/5。 所以玉米花絲資源非常豐富,且花絲容易采集,費用低,玉米花絲多糖在醫藥、食品工業中都有廣泛應用,具有多種藥理作用。 本文旨在優化從玉米花絲中提取花絲多糖的方法, 并對花絲多糖的抑菌作用進行研究。
1 材料與方法
1.1 材料與試劑 玉米花絲 (錦州醫科大學農場);纖維素酶(北京奧博星生物技術有限公司);無水乙醇、95%乙醇、丙酮、無水乙醚、氯仿、異戊醇、三氯乙酸、甲醇、氫氧化鈉、氯化鈉均為分析純;葡萄糖(食用級)、營養瓊脂(北京陸橋技術有限責任公司);牛肉膏、半固體瓊脂、瓊脂粉(北京奧博星生物技術有限責任公司);胰蛋白胨(F802型);新鮮馬鈴薯(市售)。
1.2 儀器與設備 Sigma-3K15 高速冷凍離心機(德國);BL-320S 電子天平(日本島津);微量移液器 (大龍醫療設備有限公司);RE-300 型旋轉蒸發器 (上海亞榮生化儀器廠);SHB-III 型循環水式多用真空泵 (鄭州長城科工貿有限公司);HH數顯水浴鍋 (金壇市金城國勝試驗儀器廠);LDZX-40SC 型立式壓力蒸汽滅菌器(上海申安醫療器械廠);DHP060 型恒溫培養箱 (上海試驗儀器廠有限公司);SW-CJ-2F(D)型生物潔凈工作臺(蘇州市華宇凈化設備有限公司)。
2 試驗方法
2.1 工藝流程 玉米花絲多糖分離提取:玉米花絲→粉碎→酶法破壁→水浴提取→過濾→除雜質(醇沉,離心分離)→稱重→純化(離心分離)。
玉米花絲多糖抑菌作用: 配制濃度→制作培養基→活化菌種 (接種肉湯→斜面→肉湯)→平板劃線→挑取單個菌落→搖動培養→平板涂布→量抑菌圈直徑。
2.2 操作步驟
2.2.1 花絲粉碎破壁 先用剪刀將花絲按5 ~7 cm剪成數段,初步粉碎。再用榨汁攪拌機進行最后粉碎,最終成 1 ~ 2 mm 的粉狀。 其中,新鮮花絲只進行初步粉碎(丁衛軍和楚占營,2016)。 稱取1.5 g花絲,按相應比例加水,使花絲充分浸透,配制成溶液。為使新鮮花絲與干花絲(半老花絲、老花絲)多糖含量相同, 須知道新鮮花絲干燥失水后的得率。 新鮮花絲400 g 干燥后得干花絲52.98 g,計算得率:52.98 g/400g=13%。 即100 g 新鮮花絲中多糖含量相當于13 g 干花絲的含量。
酶解破壁:向上述溶液中加入12%的纖維素酶,50 ~ 60 ℃ 水浴 2~ 3 h。 期間劇烈振蕩,使花絲破壁充分。
2.2.2 多糖提取正交試驗設計 在玉米花絲多糖的提取中,選擇花絲種類、水和花絲的比例、水浴溫度以及水浴時間4 個因素,各取3 個水平,進行4 因素 3 水平正交試驗設計 L9(34)(表1)。 平行做兩次提取率計算,然后對結果進行分析,并確定出最優方案。

表1 正交試驗因素水平
2.2.3 多糖的分離純化 分離: 將花絲多糖的浸提液用60 目尼龍網過濾,棄掉殘渣,取濾液。合并濾液, 利用旋轉蒸發儀濃縮至1/2 ~1/3 體積;4000 g/min 離心(6861 r/min)10 min,棄沉淀,取上清液;加入等體積的無水乙醇,振蕩混勻,靜置于冰上 10 min;5000 r/min 離心 10 min,棄上清液,取沉淀;加入4 mL 95%乙醇,搖勻,5000 r/min 離心10 min;取沉淀,加入2 mL 蒸餾水溶解,再加4 mL 95%乙醇,4000 r/min 離心 10 min;取沉淀,加入2 mL 無水乙醇洗滌, 搖動混勻,4000 r/min 離心10 min;取沉淀,加入 2 mL 丙酮:乙醚(1:1),搖動混勻,4000 r/min 離心 10 min;取沉淀,加入 2 mL蒸餾水溶解,再加入2 mL 三氯乙酸(或氯仿:異戊醇=24:1)洗滌,搖動混勻,4000 g/min 離心 10 min;取上清夜, 等體積加入95%乙醇, 搖動混勻,5000 r/min 離心10 min。 此時所得沉淀即為花絲粗多糖(張翠香等,2017)。 收集沉淀,干燥,稱重,去皮,計算質量(譚志燦等,2015)。
純化: 收集粗多糖溶液于錐形瓶中, 劇烈振蕩,分裝 10 mL 離心管,3000 r/min 離心 6 min,上清液轉入新的錐形瓶中, 沉淀加入4 mL 無水乙醇,聚集到一管內,6000 r/min 離心 10 min(姚秋萍和姬青松,2015)。 收集沉淀,標記為 F。
甲醇分級沉淀: 純化上清液, 并收集沉淀物(馬福敏和劉玉玲,2016)。 每 10 mL 離心管裝入4 mL 粗多糖溶液(上述上清夜),方法見表2。對于沉淀 A、B、C(同 F),用無水乙醇劇烈振蕩后,洗入10 mL 離心管中,6000 r/min 離心 10 min, 最終分別并入一管。 對沉淀物進行沉重、去皮,得純化后多糖質量(王博等,2016)。 4 種多糖(F、A、B、C),按20、40、60、80、100、120 mg/mL 配制多糖濃度。
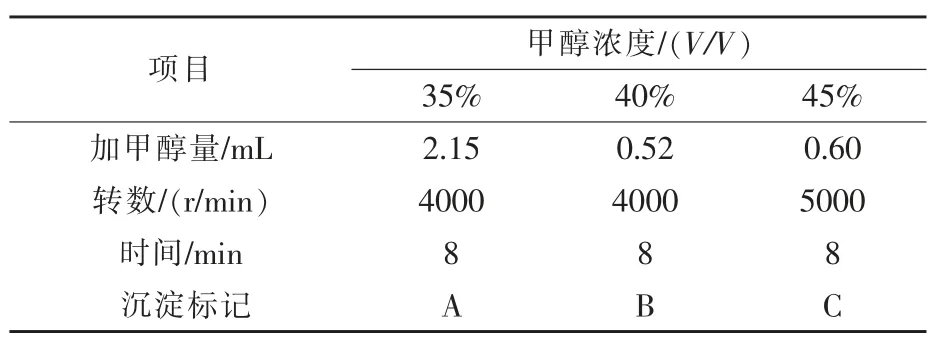
表2 甲醇分級沉淀法
2.2.4 抑菌試驗 菌種活化:在無菌操作下,將未開封的菌種開封,加入生理鹽水微溶,挑取一環于營養肉湯中;已開封且用石蠟保存的,倒出石蠟,挑取 2 環于營養肉湯中,37 ℃、24 h 培養。再反復接種肉湯、斜面,37 ℃、24 h 培養,增強菌種活力與純度(吳盼盼等,2015)。真菌從玉米葉上剪下,用生理鹽水溶解浸泡,再培養(真菌27 ℃培養48 h)(李月等,2017)。
抑菌部分:在無菌操作下,挑取一環肉湯中的菌液,平板劃線于瓊脂平板上,37 ℃培養24 h。從平板上挑取單個菌落, 置營養肉湯中,37 ℃搖動培養 24 h,制成菌懸液(李月等,2017)。 先以沙門氏菌做嘗試,確定有抑菌效果的多糖及濃度。同時用0.85%的滅菌生理鹽水將菌懸液稀釋10 倍至1×10-1稀釋度(周海嬪等,2018)。 用微量移液器吸取0.1 mL 上述菌懸液加入營養瓊脂培養基表面,用L 棒涂抹均勻,制成含菌平板。 取直徑5 ~6 mm的無菌濾紙片放入不同多糖的不同濃度中浸泡10 min, 用無菌鑷子取出浸泡過的濾紙片貼在含菌平板上(王凱等,2015)。事先標記好與多糖及濃度相對應的記號,每皿貼3 片(φ75),并做一次平行試驗。 然后用保鮮膜密封,置37 ℃培養箱倒置培養24 h,測定濾紙片的抑菌圈的大小,確定有效的具體多糖及具體濃度。 對照用無菌水和花粉多糖(濃度為50 mg/mL)各做一平板(GuO 和Beta,2013)。 剩下的菌按此多糖和濃度,再進一步細化濃度,重復上述方法作抑菌試驗。測定濾紙片的抑菌圈大小,比較抑菌效果。
3 結果與分析
3.1 正交試驗 極差的大小可以反映各因素對花絲多糖提取的影響程度。 根據表3 的極差分析,可排出各因素的順序:B(水和花絲的比例)>C(水浴溫度)>A(玉米花絲的種類)>D(水浴時間)。 因素 B第一水平為最好,即水和花絲比例為1:6,超過這個比例多糖的提取率不會提高。 因素C 以第三水平為最好,低于這個溫度(60 ℃)多糖的提取效果會變差,超過此溫度易使多糖變性。 因素A 以第三水平為最好, 新鮮花絲和半老花絲的提取得率不高。 因素D 以第二水平為最好, 即較為合適,多于或少于這個時間,并不會使多糖得率提高。因此,玉米花絲多糖提取的優化條件為:B1C3A3D2。
3.2 抑菌試驗 成品多糖呈棕黃色凝結狀。 F 種加水后渾濁,棕色,壁上有粉粒未溶,靜置后分層,上層為棕黃色清液,下層為大量沉淀。A 種加水后溶解,微渾濁,土黃色,靜置,底部有少量沉淀析出。B 種加水后全溶,乳白色泛黃,靜置,底部有極微量沉淀析出。 C 種加水后全溶,乳白色微黃,靜置,無沉淀析出。
3.2.1 4 種玉米花絲多糖對沙門氏菌的抑菌結果花粉多糖的抑菌圈直徑為11.5 mm, 花絲多糖的抑菌效果與其差異并不大, 而無菌水的抑菌圈直徑為5 mm,無抑菌效果。 其中濾紙片直徑5 mm。另外,4 種玉米花絲多糖對沙門氏菌的抑菌結果見表4。F 種、A 種多糖無效果,抑菌圈直徑均為濾紙片直徑,即5 mm。但是B 種、C 種多糖對抑菌有顯著效果。 濃度效果雖差異不大,但在40 mg/mL濃度具有明顯分界,此后抑菌圈直徑都稍有增大。將 B 種、C 種多糖濃度細分至 20、30、40 mg/mL,用此做剩下7 種細菌和4 種真菌的抑菌試驗。

表3 正交試驗結果
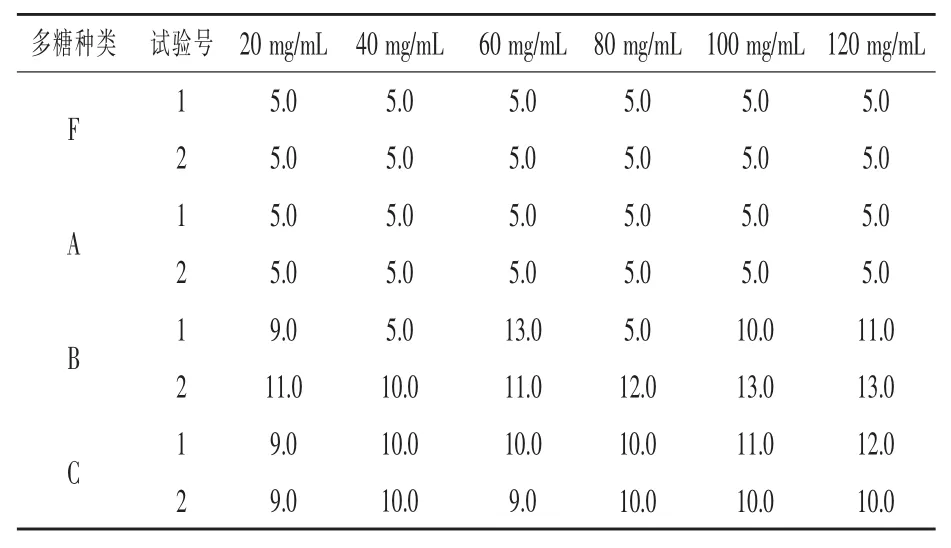
表4 玉米花絲多糖對沙門氏菌的抑菌結果(抑菌圈含濾紙片直徑) mm
3.2.2 玉米花絲多糖B 對各細菌的抑菌結果 由表5 可知,B 種玉米花絲多糖對革蘭氏陽性菌和革蘭氏陰性菌都有抑菌效果, 并且隨著多糖濃度的提高,抑菌能力明顯增強。 其中對痢疾志賀氏菌的抑制作用好于其他菌,其次為綠膿假單胞菌。 而對變形桿菌和枯草芽孢桿菌的抑制作用稍差。 表中未明顯表明, 玉米花絲多糖B 對革蘭氏陰性菌的抑制作用要好于革蘭氏陽性菌, 但革蘭氏陽性菌(沙門氏菌、痢疾志賀氏菌)對花絲多糖更敏感。

表5 玉米花絲多糖B 對各細菌的抑菌結果(抑菌圈含濾紙片直徑) mm
3.2.3 玉米花絲多糖C 對各細菌的抑菌結果由表6 可知,C 種玉米花絲多糖對革蘭氏陽性菌和革蘭氏陰性菌都有抑菌效果, 并且隨著多糖濃度的提高,抑菌能力明顯增強。其中對枯草芽孢桿菌和綠膿假單胞菌、 金黃色葡萄球菌的抑制作用明顯,其余菌稍差,大腸桿菌次之。 表6 未能表現出花絲多糖C 對革蘭氏陽性菌和革蘭氏陰性菌哪種抑制作用更明顯,均有敏感菌。
3.2.4 玉米花絲多糖B 對各真菌的抑菌結果由表7 可知,B 種玉米花絲多糖對各種玉米常見真菌病菌均有抑菌效果, 并且隨著多糖濃度的提高,抑菌能力明顯增強。 其中花絲多糖B 對絲黑穗病菌真菌抑制作用較好,其余真菌對B 種多糖不敏感。 在20 mg/mL 濃度下,玉米花絲多糖B 對各真菌的抑菌結果為: 絲黑穗病菌>玉米小斑病菌>玉米大斑病菌>玉米條銹病菌。

表6 玉米花絲多糖C 對各細菌的抑菌結果(抑菌圈含濾紙片直徑) mm

表7 玉米花絲多糖B 對各真菌的抑菌結果(抑菌圈含濾紙片直徑) mm
3.2.5 玉米花絲多糖C 對各真菌的抑菌結果由表8 可知,C 種玉米花絲多糖對各種玉米常見真菌病菌均有抑菌效果, 并且隨著多糖濃度的提高,抑菌能力明顯增強。 其中花絲多糖C 對玉米小斑病菌抑制作用較好,其余真菌對C 種多糖不敏感。 在20 mg/mL 濃度下,玉米花絲多糖C 對各真菌的抑菌結果為: 玉米小斑病菌>玉米條銹病菌>絲黑穗病菌>玉米大斑病菌。

表8 玉米花絲多糖C 對各真菌的抑菌結果(抑菌圈含濾紙片直徑) mmmm
玉米花絲多糖對細菌和真菌都有抑菌作用,廣譜抗菌。 但相對于真菌,多糖對細菌的抑菌效果更強。
4 結論
本試驗結果表明, 玉米花絲多糖提取的最佳方法為:采用老花絲,花絲與水比例為1:6,60 ℃水浴2.5 h,提取率為3.65%。 玉米花絲多糖對細菌有明顯的抑制作用, 對真菌也有一定的抑制作用。 其中,以40%甲醇濃度,4000 r/min 和45%甲醇濃度,5000 r/min 進行離心分離的多糖對細菌和真菌的抑制效果較好。

