MeCeOx(Me=In,Zr)固溶催化劑制備及催化合成碳酸二甲酯研究
王逸舟,劉 飛,趙天翔,曹建新,許 芳
(1.貴州大學化學與化工學院,貴陽 550025;2.貴州大學,貴州省綠色化工與清潔能源技術重點實驗室,貴陽 550025;3.貴州民族大學材料科學與工程學院,貴陽 550025)
0 引 言
世界工業迅猛發展加劇了化石燃料的消耗,所引起的全球變暖問題使得CO2資源化利用成為近年來的研究熱點[1-2]。碳酸二甲酯(DMC)是一種含有羰基、甲基、甲氧基和羰基甲氧基的綠色化工中間體,被視為有毒和腐蝕性甲基或羰基化劑如甲基鹵化物(CH3X)、硫酸二甲酯(DMS)和光氣(COCl2)的生態友好替代品[3-4]。同時,碳酸二甲酯分子結構中含兩個甲氧基使其成為高含氧量化合物,也可用作燃料添加劑[5-6]。
目前,碳酸二甲酯的合成主要有光氣法、甲醇氧化羰基化法、甲醇酯交換法、尿素醇解法及CO2甲醇法[7-10]。與其他合成方法相比較,CO2甲醇法,即CO2和甲醇直接合成碳酸二甲酯,因具有可實現CO2資源化利用和反應原子利用率高的特點,而成為最具潛在應用前景的技術路線之一。采用固定床多相催化反應裝置,CO2甲醇法合成碳酸二甲酯催化體系以金屬基負載催化劑和金屬氧化物催化劑等為主。
圍繞金屬基負載催化劑改性制備,國內中山大學孟躍中[11-13]課題組系統考察了不同助劑和載體對催化劑結構性質和催化性能的影響,但金屬基負載型催化劑是以Cu或Ni及兩者形成的合金相為活性組分,在反應體系中需克服金屬原子相易燒結失活的技術難題。另外一類催化劑代表是以Zr基或Ce基為主的雙金屬氧化物催化劑(Fe0.3Zr0.7Oy、Zr0.5Ce0.5O2、TiO2-CeO2、Al2O3-CeO2、La-CeO2、Gd-CeO2、Pr-CeO2)[14-20]。如Fu等[19]采用水熱合成法制備了TiO2-CeO2催化劑,在1.2 MPa、120 ℃反應條件下碳酸二甲酯選擇性90.1%,甲醇轉化率4.4%;Stoian等[20]采用水熱合成法制備了Gd-CeO2催化劑,在3.0 MPa、120 ℃反應條件下碳酸二甲酯選擇性98.0%,甲醇轉化率84.0%; Chen等[21]采用水熱合成法制備了TixCe1-xO2催化劑,在1.2 MPa、120 ℃反應條件下碳酸二甲酯選擇性78.5%,甲醇轉化率24.3%。
基于金屬氧化物的催化機制研究表明,碳酸二甲酯是中間體單配位甲氧基經單齒酸甲酯轉變得到,催化劑上Lewis堿和Lewis酸的協同作用是提高該反應轉化效率的關鍵。通過摻雜改性制備的雙金屬氧化物因構造形成的特殊氧空位和界面協同效應,不僅可抑制雙配位甲氧基和三配位甲氧基生成,還有助于穩定單齒酸甲酯(-OCOOCH3)并促使其進一步轉化為碳酸二甲酯[20]。在這些金屬氧化物中,CeO2獨特的CeO2-Ce2O3自身固溶特性及晶格穩定性使Ce-O結構有利于碳酸二甲酯選擇性地生成大量弱酸堿位點與氧空位[22]。同時,已有研究報道In2O3和ZrO2的特殊電子結構效應和幾何效應在CO2加氫轉化工藝中有助于CO2分子活化轉化[23-25]。據此,為進一步揭示雙金屬氧化物氧空位和界面電子協同效應,論文提出借助液相共沉淀工藝,分別采用In2O3和ZrO2對CeO2進行摻雜改性制備雙金屬氧化物固溶體,借助XRD、XPS、H2-TPR、CO2-TPD及CH3OH-TPD等表征手段對制得固溶結構催化劑晶相組成、氧空位及吸附特性進行分析表征,在評價催化劑催化性能基礎上,進一步采用漫反射傅里葉變換紅外光譜(DRIFTS)原位技術對催化反應機制進行了初探,以期建立催化劑構效關系。
1 實 驗
1.1 MeCeOx(Me=In,Zr,Fe,Co,Cu,Ni)催化劑制備
采用濕化學共沉淀法制備MeCeOx(Me=In,Zr,Fe,Co,Cu,Ni)催化劑。按一定摩爾比,分別將對應金屬硝酸鹽與(NH3)2Ce(NO3)4·6H2O配置成0.1 mol·L-1的混合溶液,90 ℃條件下向混合溶液中加入1.0 mol·L-1氨水,控制沉淀體系pH=9,攪拌2 h,靜置老化3 h,洗滌抽濾、105 ℃干燥12 h,500 ℃下焙燒4 h制得MeCeOx催化劑。
1.2 催化劑表征
采用德國布魯克D8型X射線多晶衍射儀(XRD)對催化劑晶相組成進行分析,管電壓為40 kV、管電流為40 mA、掃描速度為5(°)·min-1、步長為0.02°、掃描范圍2θ=5°~90°。采用美國賽默飛世爾公司K-Alpha Plus型X-射線光電子能譜(XPS)對催化劑表面氧空位進行分析,Al-Kα輻射(1 486.6 eV)、功率為150 W。采用美國Micromeritics公司Auto ChemⅡ2920型全自動程序升溫化學吸附儀對催化劑吸附特性進行分析。CO2-TPD:在高純氮氣氣氛下,以 10 ℃/min升溫到200 ℃保持0.5 h,降溫至45 ℃后,切換至10%CO2-90%He進行 CO2吸附,直至吸附飽和后在高純氮氣氛圍下,吹掃除去樣品表面與CO2發生的物理吸附60 min,待基線平穩后(30 min),設定10 ℃/min速率升溫到600 ℃,記錄TPD信號數據。CH3OH-TPD:在高純氮氣氣氛下,以10 ℃/min升溫到200 ℃保持0.5 h,降溫至45 ℃后切換至1.0×10-4CH3OH-N2,CH3OH吸附直至吸附飽和后在高純氮氣氛圍下,吹掃除去樣品表面與CH3OH發生的物理吸附60 min,待基線平穩后(30 min),設定10 ℃/min速率升溫到450 ℃,記錄TPD信號數據。采用美國賽默飛世爾公司IS50紅外光譜分析儀結合漫反射原位池進行原位測試分析,N2吹掃30 min,通入甲醇標準氣和CO2,控制壓力1.0 MPa,反應溫度140 ℃,利用MCT檢測器采集反應10 min后的實驗數據。
1.3 催化劑評價
催化劑性能評價在加壓固定床反應器上進行,取1.0 g 40~60目(0.425~0.250 mm)催化劑填裝在固定床不銹鋼反應管的恒溫區(上下部分用石英棉填裝)、儀器檢漏合格后,通入反應氣,V(CO2)/V(CH3OH)/V(N2)比例為4∶1∶5,反應壓力1.0 MPa,反應溫度140 ℃,反應空速(GHSV)為3 600 mL/(g·h)。采用GC9560型氣相色譜儀在線檢測反應產物含量,取反應5 h后數據計算得到甲醇轉化率X(CH3OH)、碳酸二甲酯選擇性S(DMC)及時空產率STY(DMC)。
2 結果與討論
2.1 不同金屬氧化物摻雜改性對雙金屬氧化物催化性能的影響


表1 MeCeOx雙金屬氧化物的催化性能
2.2 In2O3和 ZrO2摻量對MeCeOx催化性能的影響
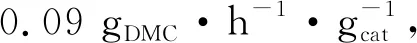

圖1 不同In2O3和ZrO2摻量制得InCeOx和ZrCeOx的催化性能
2.3 InCeOx和ZrCeOx構效關系研究
為揭示In2O3和ZrO2摻雜改性引起的雙金屬氧化物協同作用,對10%摻量制得的InCeOx和ZrCeOx雙金屬氧化物進行了XRD、XPS、H2-TPR、CO2-TPD和CH3OH-TPD分析表征,結果如圖2~6所示。從XRD圖譜可知(見圖2),不同改性金屬摻雜制得雙金屬氧化物樣品中未見任何溶質組分銦氧化物和鋯氧化物的晶相衍射峰,均僅出現具有立方晶系螢石結構單一CeO2晶相(PDF No.78-0694)。但與純CeO2衍射峰相比(見圖2(b)),發現制得雙金屬氧化物樣品部分晶面(111)和(200)衍射峰向高角度偏移,由布拉格定律可知,這是由于離子半徑較小的溶質組分In3+和Zr4+摻雜固溶進入離子半徑較大的CeO2晶格中引起部分晶面間距縮短所致,預示著InCeOx和ZrCeOx樣品中特定固溶結構的形成。

圖2 不同催化劑的XRD圖譜
純CeO2及摻雜改性制得MeCeOx(Me=In,Zr)雙金屬氧化物催化劑的Ce 3d XPS圖譜如圖3所示。一般認為,圖譜中v(882.1 eV)、v″(888.5 eV)、v″′(898.0 eV)和u(900.6 eV)、u″(907.1 eV)、u″′(916.4 eV) 為CeO2樣品中Ce4+特征峰,v′(884.3 eV)和u′(902.8 eV)為Ce3+特征峰,Ce3+含量可間接表征CeO2樣品中氧空位含量[21]。由圖可知,與純CeO2類似,摻雜改性制得InCeOx和ZrCeOx固溶結構催化劑均出現Ce4+和Ce3+特征峰,且InCeOx的v′(884.5 eV)和u′(903.0 eV)結合能出現增大趨勢,而ZrCeOx的v′(884.1 eV)和u′(902.6 eV)結合能出現減小趨勢,表明In2O3和ZrO2的摻雜在一定程度上影響了Ce元素化學環境,這可能與形成特殊氧空位有關。與文獻[20,25]報道一致,CeO2因獨特的CeO2-Ce2O3自身固溶特性也出現部分氧空位特征。為進一步揭示不同樣品中氧空位濃度,計算(Ce3+3d)A/(Ce3+3d)A+(Ce4+3d)A=(v′+u′)/(v+v″+v″′+u+u″+u″′)峰面積比間接反映樣品表面氧空位相對濃度,結果如表2所示。由表列數據可知,純CeO2氧空位相對濃度為20.1%,而經摻雜改性制得InCeOx和ZrCeOx樣品氧空位相對濃度均有不同程度增大,分別達22.9%和21.8%,這可能與特定固溶結構形成有關,同時也表明制得的InCeOx樣品具有更為豐富氧空位缺陷。

表2 不同催化劑的氧空位缺陷濃度
為進一步探尋In2O3和ZrO2摻雜改性對雙金屬氧化物相互作用的影響,對純CeO2及摻雜改性制得的MeCeOx(Me=In,Zr)雙金屬氧化物催化劑進行了H2-TPR分析,結果如圖4所示。圖譜中耗氫峰對應溫度變化可間接反映雙金屬氧化物的相互作用。從圖譜不難看出,純CeO2在500 ℃附近出現明顯耗氫峰,這與CeO2在氫還原氣氛中Ce4+向Ce3+轉變有關;與純CeO2比較,InCeOx和ZrCeOx的耗氫峰對應溫度均出現明顯降低,兩者分別在250 ℃和350 ℃左右出現耗氫峰,表明In2O3和ZrO2摻雜均在一定程度上影響了雙金屬氧化物的協同作用,提升了雙金屬氧化物的氧析出能力,表現出特定協同氧空位構建效應。其中,InCeOx的耗氫峰對應還原溫度最低,預示著該催化劑在經400 ℃焙燒作用下形成最為豐富的氧空位數量,這一結果與XPS氧空位分析結果一致。

圖3 不同催化劑的Ce 3d的XPS譜圖

圖4 不同催化劑的H2-TPR圖譜

圖5 不同催化劑中氧空位濃度與碳酸二甲酯STY的關系

純CeO2及摻雜改性制得MeCeOx(Me=In,Zr)雙金屬氧化物催化劑的CO2-TPD和CH3OH-TPD圖譜如圖6和7所示。由圖6(a)和7(a)可知,三種催化劑均對CO2和CH3OH探針分子表現出一定化學吸附能力,且脫附峰值均出現在140 ℃附近,表明此類催化劑不宜在較高溫度下進行催化反應,這與文獻報道一致(適宜反應溫度≤160 ℃)。進一步計算不同催化劑100~200 ℃溫度區間CO2和CH3OH吸附量可知(見圖6(b)和7(b)),與純CeO2比較,摻雜改性制得MeCeOx催化劑的CO2和CH3OH吸附量均有不同程度增大,且InCeOx表現出最大的CO2和CH3OH吸附量,這可能與其豐富氧空位缺陷濃度有關,預示著對CO2和CH3OH反應分子潛在的反應活性。

圖6 不同催化劑的CO2-TPD圖譜

圖7 不同催化劑的CH3OH-TPD圖譜

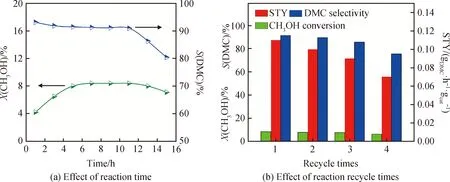
圖8 InCeOx催化劑的穩定性和循環性能

圖9 反應前后催化劑的Ce 3d的XPS譜圖
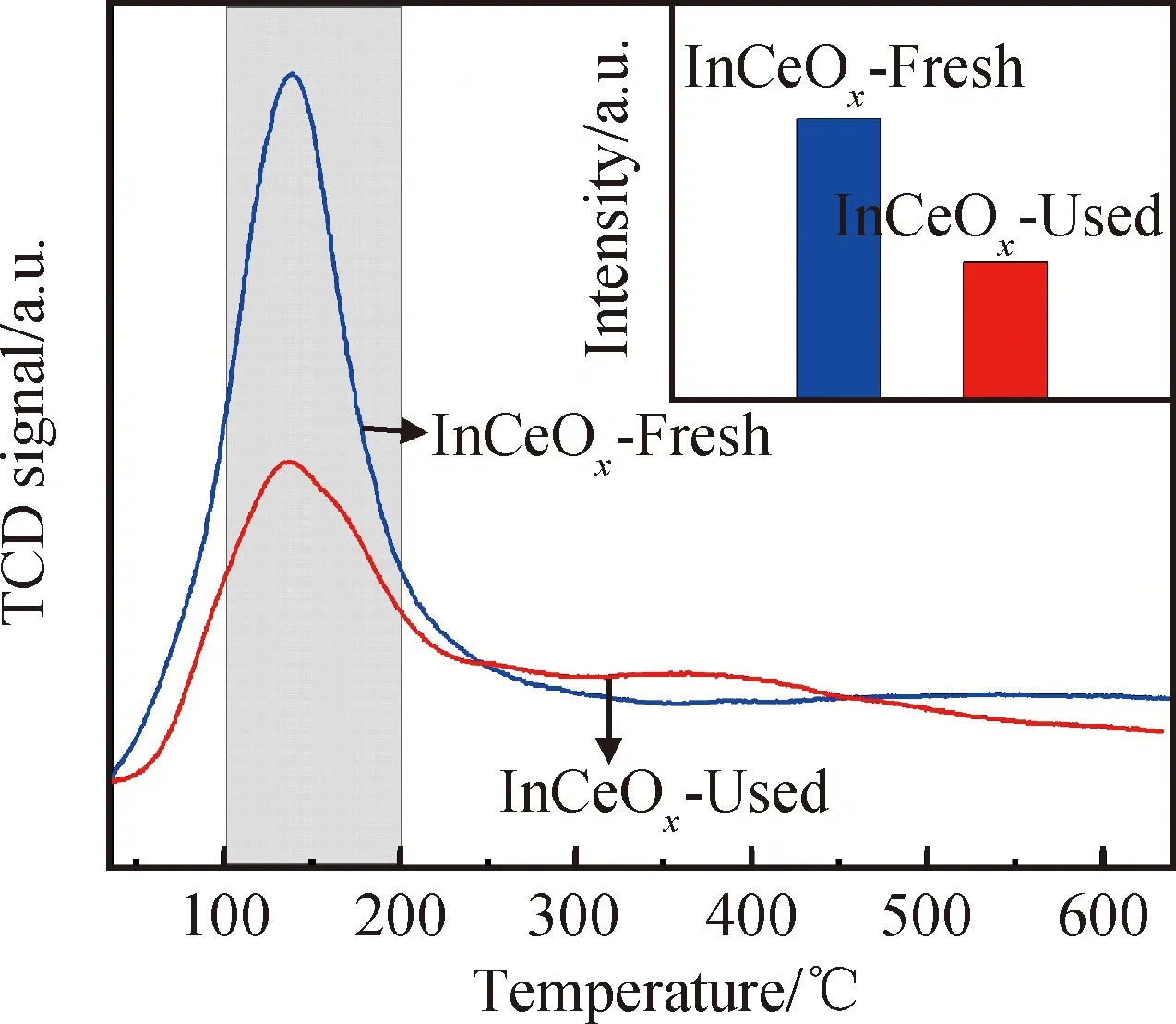
圖10 反應前后催化劑的CO2-TPD圖譜及CO2的相對吸附量

表3 反應前后催化劑的氧空位缺陷濃度
2.4 催化性能及原位反應研究

圖11 不同催化劑的原位FT-IR譜圖
為進一步探尋雙金屬氧化物固溶結構催化機制,利用漫反射傅里葉變換紅外光譜(DRIFTS)原位手段檢測了純CeO2及MeCeOx固溶催化劑反應10 min后的中間產物,結果如圖11所示。由圖可知,1 590 cm-1、1 460 cm-1、1 345 cm-1及1 195 cm-1紅外振動峰表明單齒酸甲酯MMC的出現[21,26],這是合成碳酸二甲酯重要的反應中間體,單齒酸甲酯是CO2在催化劑氧空位上經單齒或雙齒碳酸鹽轉變得到,也進一步表明CeO2、ZrCeOx及InCeOx催化劑氧空位活化CO2催化機制的存在。另外,圖譜中1 109 cm-1處紅外振動峰表明單配位甲氧基的出現,這是由甲醇分子在催化劑表面L堿位點上吸附解離形成,而1 057 cm-1和1 016 cm-1處紅外振動峰分別是雙配位甲氧基和三配位甲氧基引起,這是由甲醇分子在氧空位上吸附解離形成,已有研究證實了單配位甲氧基的形成有利于選擇性生成碳酸二甲酯,而雙配位甲氧基和三配位甲氧基則不利于碳酸二甲酯的選擇性形成[20-21,26]。盡管三個樣品中均出現1 109 cm-1、1 057 cm-1和1 016 cm-1紅外振動峰,但進一步分析可知,與純CeO2和ZrCeOx比較,InCeOx固溶催化劑單配位甲氧基振動峰(1 109 cm-1)強度明顯增強,表明In摻雜CeO2形成豐富氧空位的同時,In與Ce雙金屬界面特殊電子效應也產生了有利于甲醇吸附解離形成單配位甲氧基的L堿活性位點,進而有效抑制了甲醇在氧空位上吸附解離形成雙配位甲氧基和三配位甲氧基,表現出最優的碳酸二甲酯選擇性。
3 結 論
論文圍繞溫室氣體CO2資源化利用,針對基于CO2的甲醇羰基化制碳酸二甲酯反應,以CeO2為研究參考,重點研究了In2O3和ZrO2摻雜CeO2制得雙金屬氧化物固溶催化劑的結構性質和催化性能,利用漫反射傅里葉變換紅外光譜(DRIFTS)原位手段初探了雙金屬氧化物催化機制。得出主要結論如下:
(1)CeO2因獨特的CeO2-Ce2O3自身固溶特性使其經焙燒后出現部分氧空位特征,但In2O3和ZrO2摻雜改性制得MeCeOx(Me=In,Zr)雙金屬氧化物催化劑形成的特殊固溶結構增大了氧空位缺陷濃度,InCeOx固溶催化劑表現出最大氧空位濃度和CO2、CH3OH分子化學吸附量。

(3)In2O3摻雜CeO2改性制得InCeOx固溶結構催化劑不僅形成了豐富的有利于活化CO2的氧空位缺陷濃度,In與Ce雙金屬界面特殊電子效應還產生了有利于甲醇吸附解離形成單配位甲氧基的L堿活性中心,有效抑制了氧空位上雙配位甲氧基和三配位甲氧基的產生,提高了碳酸二甲酯選擇性。

