稀少糖家族新成員—L-木酮糖的生物制備研究進(jìn)展
徐錚,劉雅知,潘森皓,李光耀
(南京工業(yè)大學(xué) 食品與輕工學(xué)院 材料化學(xué)工程國家重點(diǎn)實(shí)驗(yàn)室,江蘇 南京,211816)
稀少糖是指一類在自然界中鮮有發(fā)現(xiàn),僅能通過人工合成獲得的單糖、寡糖或糖醇,例如海藻糖、D-阿洛酮糖、D-塔格糖等[1-3]。稀少糖普遍具有人體益生元的功效,如控制血糖濃度、改善腸道菌群關(guān)系、不導(dǎo)致齲齒等[4]。因此,稀少糖能夠廣泛應(yīng)用于制作功能性飲料、保健食品、原料藥等產(chǎn)品[5]。隨著生活水平的不斷提升,稀少糖類產(chǎn)品在世界范圍內(nèi)受到了愈來愈多的關(guān)注。日韓、歐洲等地均推出了以稀少糖為主要活性成分的食品與保健品商品,消費(fèi)者反響熱烈。然而,現(xiàn)有的稀少糖產(chǎn)品生產(chǎn)成本較高,在發(fā)展中國家難以大規(guī)模普及,降低這類產(chǎn)品的生產(chǎn)成本具有重要意義。生物工程技術(shù)是制備稀少糖的關(guān)鍵技術(shù),利用酶催化或微生物細(xì)胞工廠生產(chǎn)稀少糖具有轉(zhuǎn)化率高、副產(chǎn)物少、綠色環(huán)保等優(yōu)勢[6]。L-木酮糖(L-xylulose,C5H10O5,分子量150.13,CAS:527-50-4)是一種L-型戊酮糖單糖,它是肝臟中葡糖醛酸代謝途徑的中間體,用于合成D-葡糖醛酸和L-抗壞血酸;也是真菌中L-阿拉伯糖代謝途徑的中間體之一[4]。L-木酮糖也是近來研究的新型稀少糖之一,是糖苷酶的天然抑制劑,因此L-木酮糖能夠控制血糖,這表明其可能是潛在的降血糖產(chǎn)品[7-8]。此外,糖的構(gòu)型多是以D-型為主,天然的L-型單糖極少;除L-阿拉伯糖外在自然界中難以尋覓,因此非常珍貴。L-型單糖適用于制作核苷類似物藥物,例如L-木酮糖可進(jìn)一步轉(zhuǎn)化為L-木糖(L-xylose),可用于合成抗乙肝病毒化合物Clevudine(L-FMAU)等藥物,也可以用于制備藥物中間體——L-型核苷酸[9-17]。然而傳統(tǒng)有機(jī)化學(xué)法合成L-木酮糖或其衍生物的難度較大、得率很低,因此使用生物催化如酶催化法是最優(yōu)的工藝路線[18-19],常見的包括木糖醇轉(zhuǎn)化為L-木酮糖或L-阿拉伯糖醇轉(zhuǎn)化為L-木酮糖、利用微生物細(xì)胞工廠合成L-木酮糖等幾種方法,下面分別給予綜述。
1 利用木糖醇制備L-木酮糖
利用依賴于NAD+的木糖醇脫氫酶(xylitol dehydrogenase,XDH)能夠?qū)⒛咎谴贾苯友趸癁長-木酮糖,研究表明多種芽孢桿菌具有合成此類脫氫酶的能力。1985年,DOTEN等[20]發(fā)現(xiàn)1株噬夏孢歐文氏菌Erwiniauredovora突變株能夠?qū)⒛咎谴佳趸癁長-木酮糖,研究表明該菌株能夠合成木糖醇-4-脫氫酶,但不能合成L-木酮糖激酶,因此可以將木糖醇轉(zhuǎn)化為L-木酮糖且后者不會(huì)被微生物消耗。張玉寶等[21]分離篩選了1株產(chǎn)L-木酮糖的芽孢桿菌ZN-14,該菌株以20 g/L木糖醇為底物,在37 ℃、pH 9.0條件下催化24 h的轉(zhuǎn)化率為26.62%,進(jìn)一步16S rDNA基因序列鑒定表明該菌株屬于巨大芽孢桿菌(Bacillusmegaterium),能夠發(fā)酵木糖、乳糖、蔗糖、木糖醇、甘露糖醇、山梨糖醇等碳源,但關(guān)鍵酶的性質(zhì)未得到研究。POONPERM等[22]用蒼白芽孢桿菌BacilluspallidusY25全細(xì)胞催化了2%濃度的木糖醇,在50 ℃條件下的轉(zhuǎn)化率達(dá)到85%。進(jìn)一步純化該菌株體內(nèi)的木糖醇脫氫酶,酶學(xué)性質(zhì)表征結(jié)果表明它的最適反應(yīng)溫度為40 ℃、最適pH為10,需要輔酶NAD+,對D-蘇糖醇、木糖醇、D-艾杜糖醇均有活性。然而,該酶催化高濃度木糖醇時(shí)轉(zhuǎn)化率下降明顯,因此存在一定的缺陷。同一課題組的TAKATA等[23]克隆了B.pallidus的木糖醇脫氫酶編碼基因,全長759 bp,對應(yīng)253個(gè)氨基酸殘基。將該基因連接到pQE60質(zhì)粒后在大腸桿菌表達(dá)并純化,純化的重組酶大小28 kDa,最適反應(yīng)溫度55 ℃、最適pH 11.0,在40 ℃孵育1 h能夠剩余66%的酶活力。反應(yīng)動(dòng)力學(xué)參數(shù)測定表明重組純酶對木糖醇的Km值為2.06 mmol·L-1、kcat值為165 min-1。用表達(dá)有重組酶的靜息細(xì)胞催化5%濃度木糖醇,反應(yīng)24 h的轉(zhuǎn)化率為35%。AARNIKUNNAS等[24]在大腸桿菌中克隆表達(dá)了內(nèi)生細(xì)菌Pantoeaananatis來源的木糖醇-4-脫氫酶,該酶編碼基因長度795 bp,其氨基酸序列與短鏈脫氫酶/還原酶家族有38~51%的相似度。該酶需要NAD+作為輔酶,催化活性隨pH上升而顯著提高,利用靜息重組大腸桿菌細(xì)胞催化木糖醇可以獲得大于80%的轉(zhuǎn)化率,在轉(zhuǎn)化液中未發(fā)現(xiàn)副產(chǎn)物D-木酮糖。USVALAMPI等[25]將P.ananatis來源的木糖醇脫氫酶表達(dá)于大腸桿菌BPT228菌株,并優(yōu)化了重組菌株合成L-木酮糖的能力。結(jié)果表明,最適的反應(yīng)溫度44 ℃、pH為7.5~8.0、底物木糖醇質(zhì)量濃度為250~350 g/L,但此時(shí)摩爾轉(zhuǎn)化率較低,表明高底物濃度和高轉(zhuǎn)化率還無法兼得。朱雯惠等[26]嘗試了將P.ananatis來源木糖醇脫氫酶表達(dá)于枯草芽孢桿菌,由于該菌是食品級(jí)菌株,因此所生產(chǎn)L-木酮糖可用作保健品或食品甜味劑等。結(jié)果表明表達(dá)酶活力為5.183 U/L,在pH 10、45 ℃條件下對20 g/L木糖醇底物的轉(zhuǎn)化率為17.74%;這證明了枯草芽孢桿菌也適用于L-木酮糖制備關(guān)鍵酶的表達(dá)。
2 利用L-阿拉伯糖醇制備L-木酮糖
研究表明,真菌中存在L-木酮糖相關(guān)代謝途徑(圖1),屬于L-阿拉伯糖利用途徑中的一環(huán)[4]。
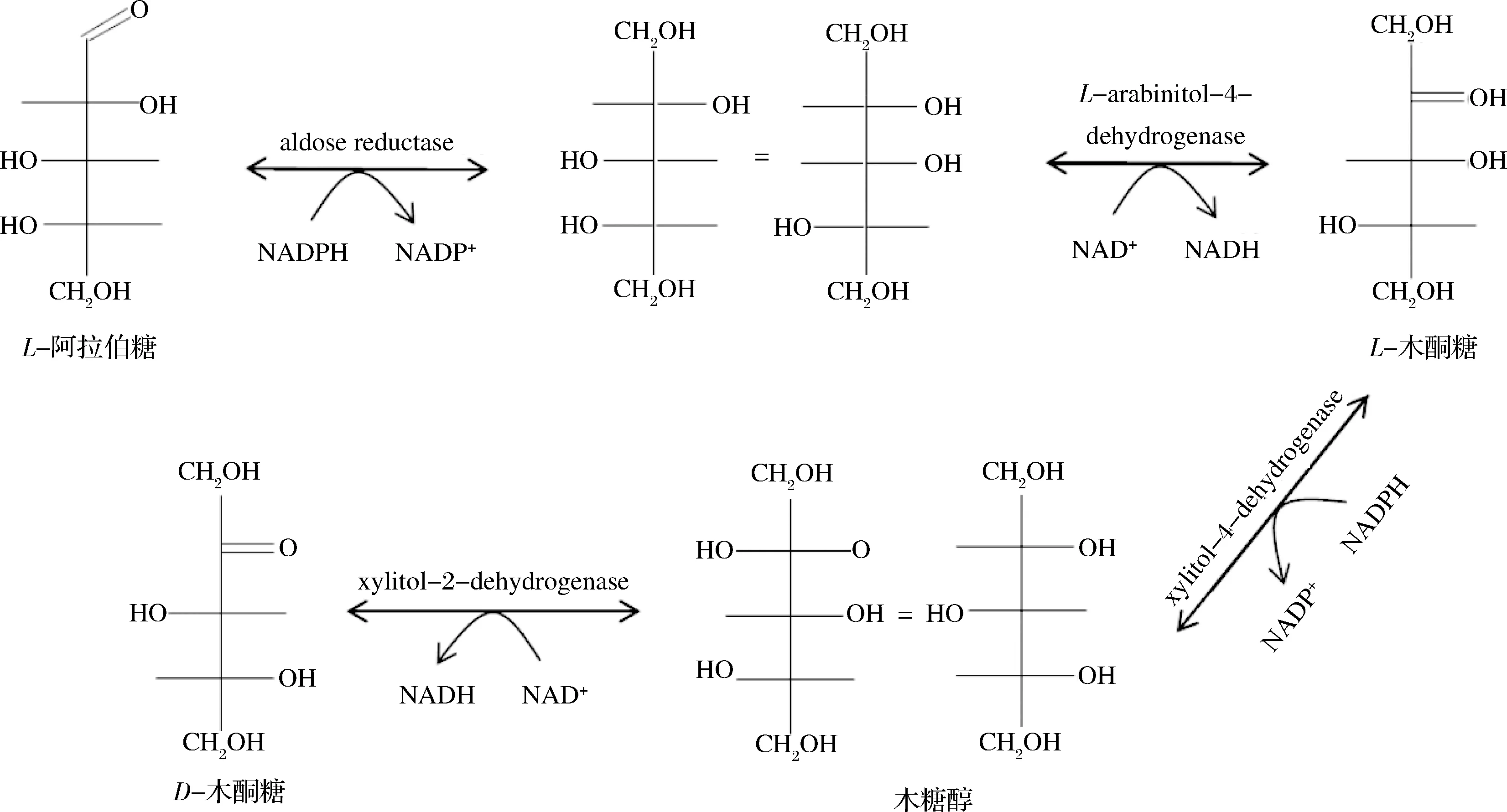
圖1 真菌中L-阿拉伯糖代謝途徑及中間體L-木酮糖Fig.1 The fungal pathway for L-arabinose utilization via L-xylulose
受此啟發(fā),韓國建國大學(xué)的LEE課題組系統(tǒng)研究了L-阿拉伯糖醇-4-脫氫酶(L-arabinitol-4-dehyrogenase,LAD),該酶可以催化L-阿拉伯糖醇為L-木酮糖。例如TIWARI等[27]克隆表達(dá)了紅褐肉座菌Hypocreajecorina來源的L-阿拉伯糖醇-4-脫氫酶(HjLAD)于大腸桿菌BL21(DE3)菌株,重組酶最適反應(yīng)pH為9.5、最適反應(yīng)溫度25 ℃;酶反應(yīng)動(dòng)力學(xué)參數(shù)測定表明kcat值為4 200 min-1,而催化效率kcat/Km值為290 (mmol/L)-1·min-1。該酶催化僅2 h對L-阿拉伯糖醇的最高轉(zhuǎn)化率達(dá)到86%,生產(chǎn)強(qiáng)度為2.2 g/L·h,但底物質(zhì)量濃度較低為5 g/L。SINGH等[28]將L-阿拉伯糖醇-4-脫氫酶(HjLAD)以共價(jià)鍵的方式固定于二氧化硅納米顆粒上得到固定化酶,其固定化效率達(dá)到94.7%。該固定化酶的熱穩(wěn)定性是游離酶的14.2倍,經(jīng)過10輪催化反應(yīng)可以保留94%的初始酶活力;催化L-阿拉伯糖醇為L-木酮糖的轉(zhuǎn)化率達(dá)66%(底物質(zhì)量濃度30 g/L,NAD+濃度20 mmol/L),生產(chǎn)強(qiáng)度為7.9 g/L·h。該研究表明固定化酶生產(chǎn)L-木酮糖在技術(shù)上可行,然而固定化酶體系也存在純酶步驟繁瑣、成本高昂等問題,因此使用固定化細(xì)胞操作簡便且更為廉價(jià)。GAO等[29-30]在大腸桿菌中分別克隆和表達(dá)了HjLAD酶和SpNox酶(NADH氧化酶,Streptococcuspyogenes來源),并將2種大腸桿菌細(xì)胞固定化于海藻酸鈣微球中。結(jié)果表明這種固定化重組細(xì)胞體系可以產(chǎn)生L-木酮糖,其中最優(yōu)的固定化細(xì)胞加載質(zhì)量濃度為3.75 g/L,最高底物轉(zhuǎn)化率64%,反應(yīng)7個(gè)批次后能夠殘留65%的酶活力。某些新型固定化材料也為L-木酮糖的制備提供了方法,如PATEL等[31]將HjLAD酶和SpNox酶制備成雜化納米花無機(jī)-酶固定化體系,該體系需要使用純酶、硫酸銅溶液、磷酸鹽溶液來合成酶與Cu(PO4)2·3H2O共固定化的催化體系。由于雜化納米花材料具有極高的比表面積,因此可以加速酶與底物的反應(yīng)速率[32-33]。該固定化酶在外源添加低濃度NAD+(2 mmol/L)的條件下實(shí)現(xiàn)木糖醇到L-木酮糖的高轉(zhuǎn)化率(90.1%),且使用5個(gè)批次后能夠維持80%的酶活力;然而純酶的獲得較為繁瑣,因此該體系的實(shí)際應(yīng)用還需要進(jìn)一步的優(yōu)化研究。
3 微生物細(xì)胞工廠生產(chǎn)L-木酮糖
微生物細(xì)胞工廠(microbial cell factory,MCF)是近年來興起的生物工程技術(shù),該技術(shù)可以利用廉價(jià)碳源(葡萄糖、工業(yè)甘油、糖蜜、纖維素水解液等)來生產(chǎn)高附加值化工類產(chǎn)品,解決了酶催化反應(yīng)需要酶純化等復(fù)雜步驟的問題,有利于生產(chǎn)總成本的大幅降低[34]。大腸桿菌作為遺傳背景清晰、分子生物學(xué)操作簡便、發(fā)酵培養(yǎng)技術(shù)成熟的微生物宿主,是構(gòu)建微生物細(xì)胞工廠的首選宿主。近年來多個(gè)課題組成功使用大腸桿菌細(xì)胞工廠來制備木糖衍生物或選擇木糖作為出發(fā)底物,例如大腸桿菌合成木糖醇、木質(zhì)酸、乙醇酸等產(chǎn)品[35-37]。HAN等[38]探索了大腸桿菌細(xì)胞工廠合成L-木酮糖的方法,即以葡萄糖或甘油為碳源,將外源木糖醇轉(zhuǎn)化為L-木酮糖。具體方法是利用pZE12和pCS27質(zhì)粒轉(zhuǎn)化大腸桿菌MG1655菌株,共表達(dá)P.ananatis來源XDH酶和肺炎雙球菌(Streptococcuspneumoniae)來源的NOX酶從而實(shí)現(xiàn)胞內(nèi)輔酶循環(huán),以甘油為碳源成功提高了L-木酮糖的產(chǎn)量;實(shí)現(xiàn)了木糖醇轉(zhuǎn)化率65%,得率為0.89 gL-木酮糖/ g 木糖醇,L-木酮糖質(zhì)量濃度14 g/L、總發(fā)酵時(shí)間80 h,初始甘油質(zhì)量濃度12 g/L、木糖醇質(zhì)量濃度22 g/L。研究還發(fā)現(xiàn)胞內(nèi)L-木酮糖與木糖醇的比例與NAD+/NADH比例一致,補(bǔ)料碳源會(huì)導(dǎo)致該比例的下降影響L-木酮糖生成。此外敲除L-木酮糖胞內(nèi)利用途徑的關(guān)鍵酶L-木酮糖激酶基因lyxK以及過表達(dá)甘油通道蛋白基因glpF均不能實(shí)現(xiàn)L-木酮糖產(chǎn)量的進(jìn)一步提高,這也表明大腸桿菌合成的L-木酮糖并不會(huì)被自身所利用。如何檢測發(fā)酵液中木糖醇和L-木酮糖的濃度,避免發(fā)酵液中雜質(zhì)的干擾是利用MCF體系容易遇到的問題。葛馳宇等[39]建立了C18柱(250 mm × 4.6 mm)測定發(fā)酵液中L-木酮糖和木糖醇含量的方法,使用柱溫35 ℃、流動(dòng)相為V(乙腈)∶V(水)=85∶15、流速0.8 mL/min,檢測器為示差檢測器,檢測波長210 nm。該體系的檢測結(jié)果不受發(fā)酵液中其他組份的干擾,木糖醇的濃度檢測范圍為0.5~30 g/L,最低檢出限為0.18 g/L;L-木酮糖的質(zhì)量濃度檢測范圍為0.3~30 g/L,最低檢出限為0.15 g/L,滿足了實(shí)際使用需求。
4 其他制備L-木酮糖的方法
多酶偶聯(lián)催化近年來成為制備稀少糖的一條新途徑,WEN等[40]研發(fā)了以L-阿拉伯糖為初始底物,通過AraA(L-阿拉伯糖異構(gòu)酶)、DTE(D-塔格糖 3-差向異構(gòu)酶)、RhaB(L-鼠李酮糖激酶)三個(gè)酶的依次催化作用(作者稱為scheme 1的路線B)來獲得L-木酮糖的工藝。首先由AraA酶將L-阿拉伯糖部分異構(gòu)為L-核酮糖,再通過DTE酶差向異構(gòu)為L-木酮糖,然而由于這2步反應(yīng)均為雙向可逆的異構(gòu)反應(yīng),因此總轉(zhuǎn)化率很低。作者將RhaB酶用來繼續(xù)催化L-木酮糖,生成L-木酮糖-1-磷酸,最終再脫去磷酸根,這導(dǎo)致該反應(yīng)路線變?yōu)榱瞬豢赡娣磻?yīng),使得反應(yīng)持續(xù)朝著產(chǎn)物生成的方向移動(dòng)。該路線最終以91%的高轉(zhuǎn)化率得到L-木酮糖,產(chǎn)物純度可達(dá)99%以上;但該方法的反應(yīng)體系較小,規(guī)模化應(yīng)用仍有待進(jìn)一步研究。綜上所述,將已發(fā)表的L-木酮糖生物制備方法總結(jié)于表1,L-木酮糖的合成路線則如圖2所示。
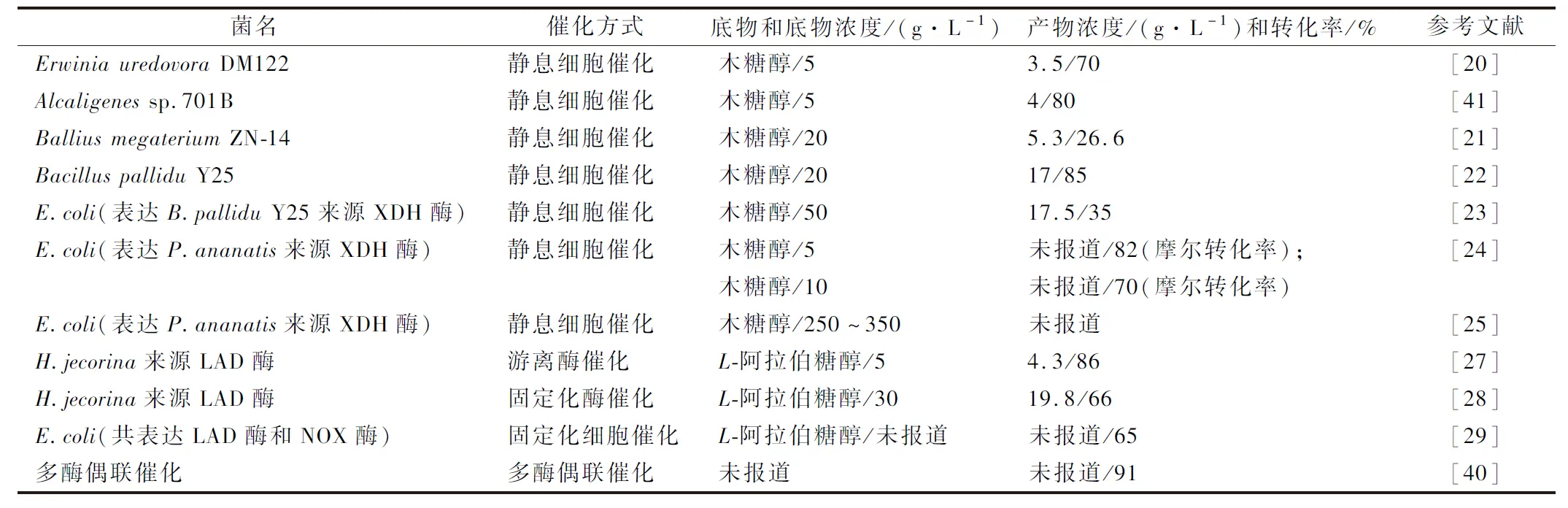
表1 L-木酮糖的生物制備工藝Table 1 Bio-production processes for L-xylulose
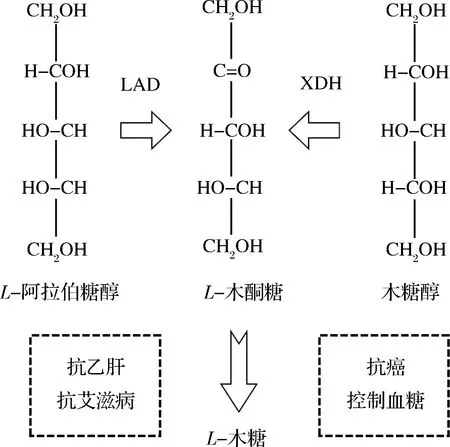
圖2 L-木酮糖與木糖醇、L-阿拉伯糖醇的結(jié)構(gòu)比較及其用途Fig.2 Schematic diagram of structure comparison of L-xylulose,L-xylitol,and L-arabinol and the reported usage
5 關(guān)鍵酶催化機(jī)理
關(guān)鍵酶的催化機(jī)制研究為其改造與增產(chǎn)提供了可能性,然而L-木酮糖制備關(guān)鍵酶的催化機(jī)理研究較為缺乏;目前僅知TIWARI[42]利用分子建模和docking對接手段對紅褐肉座菌(H.jecorina)來源L-阿拉伯糖醇-4-脫氫酶(LAD酶)與底物L(fēng)-阿拉伯糖醇和輔因子NAD+的結(jié)合情況進(jìn)行了研究,結(jié)果表明該酶活性中心內(nèi)部含有一個(gè)四或五配位的鋅離子,和L-阿拉伯糖醇都通過很強(qiáng)的氫鍵作用結(jié)合在活性中心,而NAD+則結(jié)合在一段富含甘氨酸的“GXGXXG”序列上。在催化過程中NAD+首先與酶結(jié)合,在底物結(jié)合后NAD+使得底物去質(zhì)子化,進(jìn)而在鋅離子的幫助下采用氫轉(zhuǎn)移機(jī)制將L-阿拉伯糖醇氧化為L-木酮糖。
6 展望
對于工業(yè)催化而言,產(chǎn)物濃度是極為重要的工藝參數(shù),關(guān)系到下游分離提取的效率及總生產(chǎn)成本。已發(fā)表文獻(xiàn)中涉及的L-木酮糖生產(chǎn)關(guān)鍵酶在催化高濃度底物時(shí)轉(zhuǎn)化率較低,因此不適用于要求更低成本的產(chǎn)業(yè)化應(yīng)用。由于L-木酮糖的生產(chǎn)關(guān)鍵酶均為依賴NAD+的氧化酶,故輔因子NAD+的再生尤為重要,構(gòu)建關(guān)鍵酶利用輔因子的胞內(nèi)循環(huán)為增強(qiáng)底物催化效率提供了可能性,這在已發(fā)表文獻(xiàn)中獲得了初步探索[29]。進(jìn)一步的,挖掘酶活力更高、穩(wěn)定性更好的關(guān)鍵酶有利于底物轉(zhuǎn)化率和產(chǎn)物濃度的提升;而目前已知能夠用于L-木酮糖生產(chǎn)的酶源極少,是一個(gè)顯著的瓶頸問題。解決該問題的辦法有賴于基因信息庫挖掘、酶結(jié)構(gòu)測定、酶工程改造、以及高通量篩選技術(shù)等[43-44]。盡管L-木酮糖的市場較小,但開發(fā)L-型稀少糖的技術(shù)仍有重要意義;尤其是在核苷酸類似物藥物開發(fā)中可以用作合成中間體,這類技術(shù)還可以為其他種類的稀少糖生物合成提供有力借鑒。目前針對L-木酮糖的研究報(bào)道仍然較少,隨著研發(fā)的不斷深入,在不久的將來L-型稀少糖的產(chǎn)業(yè)化制備技術(shù)有望成為該領(lǐng)域的又一個(gè)經(jīng)典案例。

