利用GFP標(biāo)記的Ralstonia solanacearum鑒定馬鈴薯青枯病抗性
陳卓 肖熙鷗 陳曙 李可 鄒華芬 金輝


摘? ? 要:青枯病是危害馬鈴薯產(chǎn)業(yè)的重要病害,選育與推廣抗青枯病品種是防控青枯病最高效的手段。目前已有的人工接種和田間抗性鑒定的方法不能有效區(qū)分處于潛伏侵染與完全抵抗侵染的材料,而利用GFP標(biāo)記的Ralstonia solanacearum能夠有效解決上述問題。筆者通過電擊轉(zhuǎn)化法將廣宿主載體pBBR1MCS2-Tac-EGFP導(dǎo)入青枯菌P2中,成功獲得了能夠穩(wěn)定遺傳且不影響其致病力并帶有綠色熒光報告的青枯菌菌株P(guān)2-Tac-EGFP。通過對感抗材料進(jìn)行接種,結(jié)果表明,P2-Tac-EGFP能夠有效區(qū)分感抗材料,并且P2-Tac-EGFP在感病材料的根部和莖部大量分布,而在抗病材料的根部僅有少量分布。綜上所述,利用GFP標(biāo)記的R. solanacearum能夠快速準(zhǔn)確地鑒定馬鈴薯青枯病抗性。
關(guān)鍵詞:馬鈴薯;Ralstonia solanacearum;GFP;抗性
中圖分類號:S532 文獻(xiàn)標(biāo)志碼:A 文章編號:1673-2871(2021)01-035-07
Identification of potato bacterial wilt resistance using GFP-labeled Ralstonia solanacearum
CHEN Zhuo1, XIAO Xiou2, CHEN Shu2, LI Ke2, ZOU Huafen2, JIN Hui2
(1. College of Agriculture, Heilongjiang Bayi Agricultural University, Daqing 163000, Heilongjiang, China; 2. Key Laboratory of Tropical Fruit Biology, Ministry of Agriculture and Rural Affairs/Key Laboratory for Post-harvest Physiology and Technology of Tropical Horticultural Products of Hainan Province/Institute of South Subtropical Crop Research Institute, Chinese Academy of Tropical Agricultural Sciences? Zhanjiang 524091, Guangdong, China)
Abstract: Bacterial wilt is an important disease that endangers the potato industry. The selection and promotion of bacterial wilt resistant varieties is the most effective means to prevent and control bacterial wilt. The selection of germplasm resistant to bacterial wilt is the basis for the selection of resistant varieties. The current methods of artificial inoculation and field resistance identification cannot effectively distinguish between latent infection and disease-resistant materials, and Ralstonia solanacearum labeled with GFP can effectively solve the above problems. In this study, the broad host vector pBBR1MCS2-Tac-EGFP was introduced into R. solanacearum P2 by the electric shock transformation method, and successfully obtained the R. solanacearum strain P2-Tac-EGFP with stable inheritance without affecting its pathogenicity. Through inoculation of resistant materials, the results show that P2-Tac-EGFP can effectively distinguish the resistant materials, and P2-Tac-EGFP is distributed in a large amount in the roots and stems of the disease-resistant materials, while a small amount is in the roots of the resistant materials.In summary, the use of GFP-labeled R. solanacearum can quickly and accurately identify potato bacterial wilt resistance.
Key words: Potato; Ralstonia solanacearum; GFP; Resistance
馬鈴薯(Solanum tuberosum L.)是我國四大主要糧食作物之一,也是世界上重要的作物之一,在我國的栽培面積僅次于小麥、水稻和玉米[1-2]。由茄科雷爾(青枯菌)式菌(Ralstonia solanacearum)引起的青枯病是馬鈴薯生產(chǎn)中的主要病害之一,能造成馬鈴薯大量減產(chǎn),嚴(yán)重時可減產(chǎn)80% [3-5]。茄科雷爾式菌是一種危害維管系統(tǒng)的病原體,侵入根木質(zhì)部并擴散到莖組織,在那里產(chǎn)生過量的胞外多糖及多種胞外蛋白堵塞和破壞導(dǎo)管,使植物失水萎蔫[6]。目前,使用抗病品種是馬鈴薯生產(chǎn)上最為經(jīng)濟(jì)有效的抗青枯病方式,但目前的馬鈴薯種質(zhì)資源中抗性資源稀少[7],因此,篩選馬鈴薯抗青枯病種質(zhì)資源對馬鈴薯抗病育種起著關(guān)鍵性作用。
傳統(tǒng)的馬鈴薯青枯病抗性鑒定方法一般為傷根接種鑒定,并在供試材料接種后開始持續(xù)觀察其發(fā)病狀況[8-10],通過調(diào)查病情指數(shù)、計算發(fā)病率和防病率[11],鑒定種質(zhì)資源對青枯病的抗性,然而此方法不能有效辨別潛伏侵染,并且不能確定R. solanacearum是否已侵入植株。利用標(biāo)記基因追蹤病原菌在植物體內(nèi)入侵、定殖的侵染途徑,是研究病原菌致病機制的有效手段和方法[12]。已有研究表明,用于R. solanacearum的標(biāo)記基因大多數(shù)為GFP基因[13-16]、GUS基因[17]、LUX基因[18]等,其中GFP作為標(biāo)記基因之一被廣泛應(yīng)用于各類研究中,GFP蛋白最早是從水母中提取的,并且能在藍(lán)光激發(fā)下發(fā)出綠色熒光[19]。GFP作為熒光標(biāo)記分子,既有敏感的標(biāo)記檢測率,又無放射性危害[20]。
筆者將廣宿主載體pBBR1MCS2-Tac-EGFP通過電擊轉(zhuǎn)化法導(dǎo)入R. solanacearum中,得到能夠穩(wěn)定遺傳并帶有綠色熒光報告基因的強致病力菌株P(guān)2-Tacc-EGFP,將其接種感抗馬鈴薯材料,能夠有效區(qū)分材料對青枯病的抗性。本研究可為進(jìn)一步研究R .solanacearum對植物的入侵、定殖提供適宜標(biāo)記載體工具,并為馬鈴薯青枯病抗性評價提供了一個新的思路。
1 材料與方法
1.1 材料
試驗選用華中農(nóng)業(yè)大學(xué)選育的‘華薯12號和加拿大引進(jìn)品種‘Chieftain試管苗。其中,多年田間青枯病抗性鑒定結(jié)果表明,‘華薯12號為高抗青枯病材料,‘Chieftain為感病對照材料。馬鈴薯供試材料試管苗在MS培養(yǎng)基中培養(yǎng)(普通MS培養(yǎng)基附加3%(w,后同)蔗糖和0.7%瓊脂進(jìn)行擴繁和保存)。在光周期為16 h、溫度為22 ℃的組織培養(yǎng)室中培養(yǎng)20 d后,移栽至裝有V基質(zhì)∶V蛭石∶V珍珠巖=3∶1∶1的營養(yǎng)土的塑料營養(yǎng)缽中,植株在室溫24 ℃左右、光周期為16 h的溫室中生長20 d后接種青枯菌。
廣寄主載體pBBR1MCS2-Tac-EGFP由中國熱帶農(nóng)業(yè)科學(xué)院南亞熱帶作物研究所南方熱帶糧食中心保存,該質(zhì)粒在工程菌中具有卡那霉素(Kana)抗性,通過Tac啟動子驅(qū)動EGFP表達(dá),如圖1所示。
1.2 方法
1.2.1 R. solanacearum的分離 試驗于2020年7月在中國熱帶農(nóng)業(yè)科學(xué)院南亞熱帶作物研究所馬鈴薯實驗基地進(jìn)行,采集馬鈴薯青枯病感病植株,帶回南亞熱帶作物研究所綜合實驗樓實驗室分離病原菌,具體分離R. solanacearum的方法參考陳媛媛[21]的方法。其中NA瓊脂培養(yǎng)基為:葡萄糖10.0 g,蛋白胨5.0 g,牛肉浸膏3.0 g,瓊脂粉8.0 g,蒸餾水1.0 L,pH 7.0;TTC培養(yǎng)基為:0.05 g三苯基四氮唑(TTC)溶于10 mL無菌水中以1%體積分?jǐn)?shù)溶于NA培養(yǎng)基中。致病力強的菌落,接種至TTC培養(yǎng)基后形狀不規(guī)則,帶黏性,白色,中間呈粉紅色;非致病性的菌落很小,圓形,呈乳黃色或深紅色,邊緣顏色較淺[22-23]。
1.2.2 R. solanacearum的演化型鑒定 采用多重PCR檢測技術(shù)快速檢測田間采集的R. solanacearum菌株的演化型,根據(jù)PCR擴增產(chǎn)物的片段大小可以確定該菌株的演化型,用于鑒定R. solanacearum演化型地位的引物序列如表1所示[24-25]。
PCR擴增體系為20 ?L,其中包括Mix10 ?L,上下游引物各1 ?L,DNA模板50 ng,ddH2O補足20 ?L。反應(yīng)程序為:96 ℃ 5 min;94 ℃ 15 s,57 ℃ 30 s和72 ℃ 30 s,35個循環(huán);72 ℃延伸10 min。取5 ?L PCR產(chǎn)物于1%瓊脂糖凝膠電泳檢測,根據(jù)PCR擴增片段大小確定R .solanacearum菌株的演化型[26]。
1.2.3 R. solanacearum感受態(tài)的制備和電擊轉(zhuǎn)化及檢測 R. solanacearum的感受態(tài)制備和電擊轉(zhuǎn)化參照張治飛[17]的方法。根據(jù)EGFP最大開放閱讀框抗性基因設(shè)計引物(EGFPF:ATGAGTAAAGGAGAAGAACTTTTC,EGFPR:TTATTTGTAGAGCTCATCCATGCC)并且委托廣州天一輝遠(yuǎn)公司進(jìn)行合成;PCR體系為:2×PCR Mix(康為世紀(jì))12.5 ?L,EGFPF(10 ?mol·L-1)1 ?L,EGFPR(10 ?mol·L-1)1 ?L,無菌水9.5 ?L,菌液1 ?L。PCR 反應(yīng)程序為:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35個循環(huán);72 ℃ 5 min。PCR產(chǎn)物2%瓊脂糖凝膠電泳檢測。
1.2.4 穩(wěn)定性檢測 將電擊轉(zhuǎn)化后的菌株在不含卡那霉素(Kana)的NA固體培養(yǎng)基中連續(xù)轉(zhuǎn)接活化培養(yǎng)20次,分析pBBR1MCS2-Tac-EGFP在R. solanacearum中的遺傳穩(wěn)定性。在第4次、第10次和第20次活化培養(yǎng)時,將菌株用無菌水沖洗,并稀釋至OD600=1.0左右,并用Tecan Spark酶標(biāo)儀測定其熒光強度,激發(fā)波長為485 nm,發(fā)射波長為535 nm,其中Gain值設(shè)定為80。采用Microsoft Excel 2019記錄試驗數(shù)據(jù),采用SPSS 26.0進(jìn)行統(tǒng)計學(xué)分析,采用Duncan極差法進(jìn)行顯著性檢驗。
1.2.5 R. solanacearum的定量分析 電轉(zhuǎn)后的菌株挑單菌落在NA液體培養(yǎng)基中28 ℃ 200 r·min-1過夜培養(yǎng)至OD600=0.8左右,6 000 r·min-1離心10 min收集菌株,使用無菌水進(jìn)行重懸浮至OD600=1.0,然后使用無菌水進(jìn)行4倍梯度稀釋。熒光強度采用Tecan Spark酶標(biāo)儀測定,激發(fā)波長為485 nm,發(fā)射波長為535 nm,其中Gain值設(shè)定為80。
從距地面1 cm處收集莖基部的截面,并用光度計直接測量切割部分的發(fā)光強度[11]。在接種后,取馬鈴薯莖基上1 cm莖段用于R. solanacearum數(shù)量分析。將莖段使用75%酒精消毒后置于0.2 mL的無菌水中浸泡1 h,然后測其熒光強度。使用Microsoft Excel 2019進(jìn)行線性回歸分析。
1.2.6 致病力分析 將P2和P2-Tac-EGFP在NA固體培養(yǎng)基上連續(xù)活化2次后挑單菌落于NA液體培養(yǎng)基中,在28 ℃、200 r·min-1條件下過夜培養(yǎng)至OD600=1.0后,6 000 r·min-1離心10 min,取離心沉淀用無菌水稀釋至OD600=0.1進(jìn)行傷根接種至試管苗,每株接種20 mL菌液,每次接種10株,進(jìn)行3次生物學(xué)重復(fù),并選用無菌水做對照。接種后置于28 ℃光照培養(yǎng)箱,每天調(diào)查植株發(fā)病情況,記錄病株數(shù)和病級。病情調(diào)查與分級標(biāo)準(zhǔn):0級,無任何癥狀;1級,1~2個葉片萎蔫;3級,植株的1/3葉片萎蔫;5級,植株的1/2葉片萎蔫;7級,植株的2/3葉片萎蔫;9級,植株全部葉片萎蔫或死亡。計算病情指數(shù),公式為:DI=Σ(si×ni)/9N×100,式中:DI—病情指數(shù),si—發(fā)病級別,ni—相應(yīng)發(fā)病級別的株數(shù),i—病情分級的各個級別,N—調(diào)查總株數(shù)[27]。運用Microsoft Excel 2019進(jìn)行數(shù)據(jù)整理及統(tǒng)計,繪制圖像。
2 結(jié)果與分析
2.1 R. solanacearum菌株的分離及演化型鑒定
從馬鈴薯青枯病植株中共分離篩選出10株菌株,菌株在TTC固體培養(yǎng)基上為白色不規(guī)則形態(tài),中間呈紅色(圖2)。PCR擴增及瓊脂糖凝膠電泳檢測結(jié)果顯示,1~10號菌株條帶均在280 bp左右,確定為R. solanacearum菌株(圖3)。10株菌株條帶均在144 bp左右,為演化型Ⅰ型菌株。
2.2 pBBR1MCS2-Tac-EGFP成功轉(zhuǎn)入P2菌株
將廣宿主載體pBBR1MCS2-Tac-EGFP電擊轉(zhuǎn)化P2菌株,得到陽性克隆,命名為P2-Tac-EGFP,并進(jìn)行PCR檢測,PCR產(chǎn)物瓊脂糖凝膠電泳檢測結(jié)果如圖4所示,2、3號泳道擴增出750 bp左右的條帶。在440 nm波長的藍(lán)光激發(fā)下,P2-Tac-EGFP菌呈綠色熒光,如圖5所示。以上結(jié)果均表明,pBBR1MCS2-Tac-EGFP已成功轉(zhuǎn)入P2菌株。
2.3 P2-Tac-EGFP穩(wěn)定表達(dá)熒光
將P2-Tac-EGFP菌株在NA瓊脂培養(yǎng)基中連續(xù)培養(yǎng)20次,在第4次、第10次、第20次時測定P2-Tac-EGFP菌株的熒光強度,發(fā)現(xiàn)移植培養(yǎng)的第4次、第10次、第20次的熒光值并無顯著性差異,這說明P2-Tac-EGFP菌株可以穩(wěn)定遺傳(圖6)。
2.4 EGFP熒光值與菌落數(shù)呈線性相關(guān)
利用EGFP熒光定量分析細(xì)菌的克隆數(shù)具有高效快捷的特性。EGFP熒光強度與P2-Tac-EGFP數(shù)量呈線性相關(guān),R?=0.995(圖7)。當(dāng)P2-Tac-EGFP菌液稀釋至約9.0×105 CFU·mL-1時,EGFP熒光值接近于無菌水的熒光值。因此在9×105~1×109 CFU·mL-1范圍內(nèi),可以使用EGFP熒光值計算R. solanacearum菌株數(shù)量。
2.5 pBBR1MCS2-Tac-EGFP的轉(zhuǎn)入不影響青枯菌的致病力
將P2和P2-Tac-EGFP菌株同時傷根接種至‘Chieftain試管苗,以無菌水接種為對照,由圖8可知,病情指數(shù)曲線趨勢一致,表明P2與P2-Tac-EGFP的致病力無顯著差異,只是P2-Tac-EGFP在接種后3~6 d時發(fā)病較快。
2.6 P2-Tac-EGFP可用于青枯病抗性評價
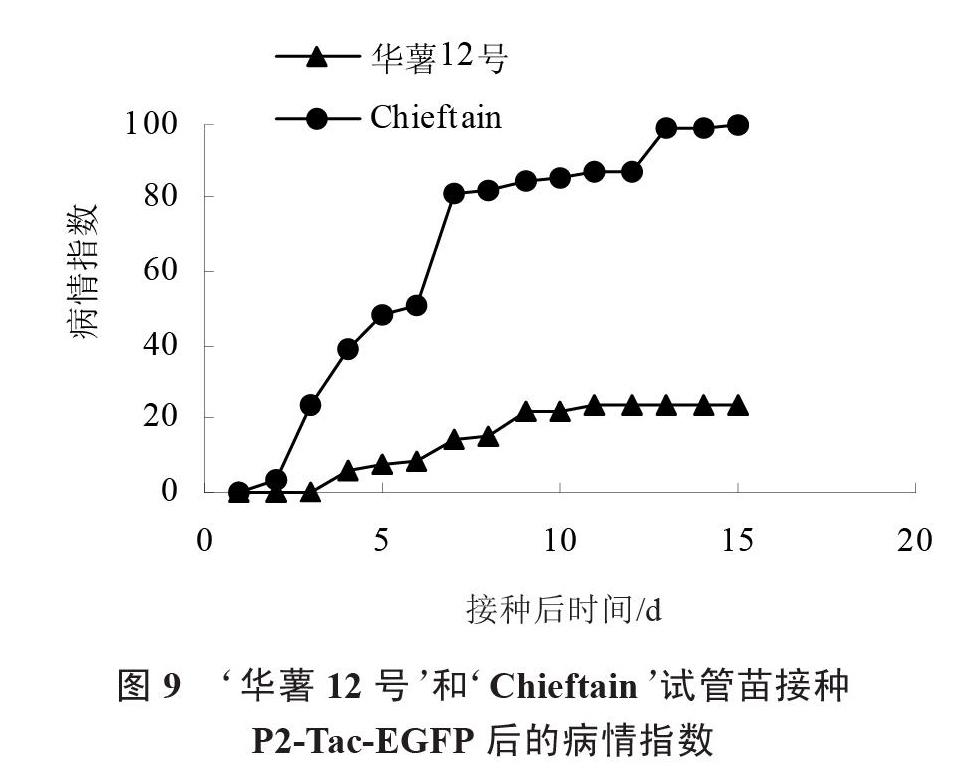
通過連續(xù)15 d的病情指數(shù)調(diào)查,發(fā)現(xiàn)當(dāng)接種15 d時,‘Chieftain病情指數(shù)已達(dá)到最大值,其發(fā)病率達(dá)到100%,而此時‘華薯12號的病情指數(shù)為23.33(圖9),計算出病指相對值為76.67,可證明‘華薯12號為高抗材料。
由圖10可知,在440 nm波長藍(lán)光激發(fā)下,接種1 d后,‘華薯12號和‘Chieftain試管苗均未發(fā)現(xiàn)熒光。接種2 d后,‘華薯12號根部發(fā)出微弱熒光(圖10-a),而‘Chieftain根部熒光更加明顯(圖10-b),表明P2-Tac-EGFP已成功接種至試管苗中。接種4~6 d后,‘華薯12號試管苗中的熒光并沒有向上遷移,葉片也無萎蔫;接種8 d后,熒光上移至莖基部,且植株葉片也無變化;接種15 d后,葉片無明顯變化(圖10-a)。接種4 d后,‘Chieftain試管苗中的熒光上升至植株中間部分,且部分葉片萎蔫;接種6 d后,熒光從維管束繼續(xù)上升;接種10 d后,熒光已上升至植株頂部,全部葉片已萎蔫;接種15 d后,‘Chieftain試管苗全部萎蔫死亡(圖10-b),EGFP熒光分布在整個莖稈的維管束,而‘華薯12號僅在根部有微弱的熒光,表明‘華薯12號為高抗材料。
為進(jìn)一步分析R. solanacearum在根部的數(shù)量,分別在P2-Tac-EGFP菌株接種‘華薯12號和‘Chieftain試管苗的3、5、7、9 d取莖基部莖段在無菌水中浸泡1 h后測其熒光值,運用2.4中得出的公式推算其莖基部R. solanacearum細(xì)菌數(shù)。如圖11所示,在‘華薯12號和‘Chieftain接種3 d和5 d后,莖基部細(xì)菌數(shù)無顯著變化;在接種7 d后,‘Chieftain試管苗莖基部細(xì)菌數(shù)較之前顯著增加;在接種9 d后,‘Chieftain試管苗莖基部細(xì)菌數(shù)趨于穩(wěn)定;而在接種5~9 d后‘華薯12號試管苗莖基部細(xì)菌數(shù)無顯著變化。
3 討論與結(jié)論
筆者共從田間篩選出10株演化型Ⅰ型R. solanacearum菌株,從中選出了致病力最強的菌株P(guān)2,并成功將pBBR1MCS2-Tac-EGFP載體電擊轉(zhuǎn)入P2菌株中,標(biāo)記菌落形態(tài)與普通R. solanacearum菌落形態(tài)相同,并且P2-Tac-EGFP能夠在馬鈴薯試管苗中穩(wěn)定表達(dá),與P2菌株同時接種至感病植株‘Chieftain后發(fā)病情況基本一致,不影響R. solanacearum的致病力,也證實了其能夠用于馬鈴薯抗性鑒定。R. solanacearum中導(dǎo)入EGFP發(fā)光報告基因有助于實時監(jiān)測植物宿主中細(xì)菌的增長情況,能夠更加立體地觀察細(xì)菌定殖情況,為病原菌侵染植物過程的研究提供了可能。另外,發(fā)光報告基因的載入也簡化了細(xì)菌計數(shù)的量化,發(fā)光強度與細(xì)菌定殖數(shù)呈正相關(guān),說明可以通過熒光強度來推測細(xì)菌的定殖數(shù),這大大提高了計算效率,能夠在短時間內(nèi)得出細(xì)菌在植株中的定殖數(shù),這與PMA-PCR方法[28]和稀釋平板計數(shù)法[29]相比更加快速便捷,傳統(tǒng)的平板稀釋培養(yǎng)法檢測不出在逆境脅迫下進(jìn)入VBNC(活的非可培養(yǎng)狀態(tài))的R. solanacearum,會造成一定程度的誤差,PMA-PCR檢測時,濃度若低于PCR檢測限制,易出現(xiàn)假陽性結(jié)果。
GFP基因也被廣泛應(yīng)用于植物青枯病抗性鑒定研究中。Takenu等[16]以絲狀噬菌體φRSS1為載體,構(gòu)建GFP表達(dá)質(zhì)粒,命名為pRSS12,并將其電擊轉(zhuǎn)化進(jìn)青枯菌,在感染番茄組織和土壤樣品后可檢測到強烈綠色熒光。在番茄青枯病抗性機制研究中,Planas等[30]同時將LUX和GFP基因?qū)隦. solanacearum中,對番茄植株進(jìn)行了定殖的動態(tài)分析,共從4個水平上揭示了限制R. solanacearum入侵的主要方式,為番茄抗青枯病鑒定及育種提供了新的思路。車建美等[20]采用電擊法進(jìn)行R. solanacearum遺傳轉(zhuǎn)化,用gfp/luxAB基因標(biāo)記了R. solanacearum,標(biāo)記后的菌體細(xì)胞形狀與親本菌株形狀相同,整個細(xì)胞呈現(xiàn)綠色熒光,在無選擇壓力條件下連續(xù)移植20次,仍然保持均勻而且強烈的綠色熒光,且對宿主的生長特性及致病力無影響,與本試驗結(jié)果一致。
筆者將P2-Tac-EGFP菌株同時接種至‘華薯12號和‘Chieftain后,病情指數(shù)分析結(jié)果表明,‘華薯12號為抗病,‘Chieftain為感病。同時GFP標(biāo)記的P2-Tac-EGFP在抗病材料‘華薯12號根部少量表達(dá),并不向上侵染,而在感病材料‘Chieftain中則蔓延至整個植株。通過對根部R. solanacearum的克隆數(shù)進(jìn)行分析,結(jié)果表明,‘華薯12號的R. solanacearum克隆數(shù)顯著低于‘Chieftain。綜合上述結(jié)果,表明‘華薯12號為抗病材料而不是處于潛伏侵染狀態(tài)。通過調(diào)查馬鈴薯植株萎蔫程度或通過病情指數(shù)進(jìn)行青枯病抗性鑒定時,潛伏感染的材料往往會因環(huán)境條件變化而無法檢測出來[12,18]。筆者將具有EGFP熒光蛋白基因的R. solanacearum應(yīng)用于青枯病抗性鑒定的接種試驗中,能夠有效直觀地區(qū)分抗病、耐病或者潛伏侵染。這種方法具有便捷、成本低的特點,并且能快速實行,不需要復(fù)雜的試劑或設(shè)施,為篩選馬鈴薯抗R. solanacearum種質(zhì)資源提供了新的思路。本試驗中僅選用2個材料,下一步將運用此方法對其他材料進(jìn)行抗性鑒定,進(jìn)一步完善鑒定方法。
參考文獻(xiàn)
[1]蔡興奎,謝從華.中國馬鈴薯發(fā)展歷史、育種現(xiàn)狀及發(fā)展建議[J].長江蔬菜,2016(12):30-33.
[2]VAN HARSSELAAR J K,LORENZ J,SENNING M,et al.Genome-wide analysis of starch metabolism genes in potato (Solanum tuberosum L.)[J].BMC Genomics,2017,18(1):18-37.
[3]PARK S,GUPTA R,KRISHNA R,et al.Proteome analysis of disease resistance against Ralstonia solanacearum in potato cultivar CT206-10[J].The Plant Pathology Journal,2016,32(1):25-32.
[4]CHANG Y N,YU R M,F(xiàn)ENG J L,et al.NAC transcription factor involves in regulating bacterial wilt resistance in potato[J].Functional Plant Biology,2020,47(10):925-936.
[5]李廣存. 馬鈴薯青枯病抗性相關(guān)基因的分離及其功能分析[D].北京:中國農(nóng)業(yè)科學(xué)院,2006.
[6]PRAMOD K S,SHAILENDRA S,AMRITA G,et al.A simplified protocol for reversing phenotypic conversion of Ralstonia solanacearum during experimentation[J].International Journal of Environmental Research and Public Health,2020,17(12):38-46.
[7]BOSCHI F,SCHVARTZMAN C,MURCHIO S,et al.Enhanced bacterial wilt resistance in potato through expression of Arabidopsis EFR and introgression of quantitative resistance from Solanum commersonii[J].Frontiers in Plant Science,2017,8:1-11.
[8]李林章.二倍體馬鈴薯青枯病抗性的分離及分子標(biāo)記鑒定[D].武漢:華中農(nóng)業(yè)大學(xué),2004.
[9]陳琳.馬鈴薯體細(xì)胞雜種及其回交和自交后代遺傳組分分析與青枯病抗性評價[D].武漢:華中農(nóng)業(yè)大學(xué),2013.
[10]李朋.馬鈴薯體細(xì)胞雜種回交后代青枯病抗性鑒定及分子標(biāo)記檢測[D].武漢:華中農(nóng)業(yè)大學(xué),2014.
[11]丁傳雨.生物有機肥對土傳馬鈴薯青枯病的防控技術(shù)及機理研究[D].南京:南京農(nóng)業(yè)大學(xué),2012.
[12]WANG H J,HU J X,LU Y,et al.A quick and efficient hydroponic potato infection method for evaluating potato resistance and Ralstonia solanacearum virulence[J].Plant Methods,2019,15:145.
[13]ALDON D,BRITO B,BOUCHER C,et al.A bacterial sensor of plant cell contact controls the transcriptional induction of Ralstonia solanacearum pathogenicity genes[J].The Embo Journal,2000,19(10):2304-2314.
[14]ZHENG X A,LI X J,WANG B S,et al.A systematic screen of conserved Ralstonia solanacearum effectors reveals the role of RipAB,a nuclear-localized effector that suppresses immune responses in potato[J].Molecular Plant Pathology,2019,20(4):547-561.
[15]MONTEIRO F,SOLE M,VAN D I,et al.A chromosomal insertion toolbox for promoter probing,mutant complementation,and pathogenicity studies in Ralstonia solanacearum[J].Molecular plant-microbe Interactions,2012,25(4):557-568.
[16]TAKERU K,HIDEKI S,MAKOTO F,et al.Monitoring of phytopathogenic Ralstonia solanacearum cells using green fluorescent protein-expressing plasmid derived from bacteriophage ?RSS1[J].Journal of Bioscience and Bioengineering,2007,104(6):451-456.
[17]張治飛.青枯菌的基因標(biāo)記及馬鈴薯青枯病抗性相關(guān)信號途徑探究[D].武漢:華中農(nóng)業(yè)大學(xué),2016.
[18]CRUZ A P Z,F(xiàn)ERREIRA V,PIANZZOLA M J,et al.A novel, sensitive method to evaluate potato germplasm for bacterial wilt resistance using a luminescent Ralstonia solanacearum reporter strain[J].Molecular Plant-microbe Interactions,2014,27(3):277-285.
[19]CHALFIE M.Green fluorescent protein[J].Photochemistry and Photobiology,1995,62(4):651-656.
[20]車建美,藍(lán)江林,劉波.轉(zhuǎn)綠色熒光蛋白基因的青枯雷爾氏菌生物學(xué)特性[J].中國農(nóng)業(yè)科學(xué),2008,41(11):3626-3635.
[21]陳媛媛.廣西植物青枯病菌的演化型和序列變種及葫蘆科植物青枯病菌的特性[D].南寧:廣西大學(xué),2018.
[22]方中達(dá).植病研究方法[M].3版.北京:中國農(nóng)業(yè)出版社,2001.
[23]KELMAN A.The relationship of pathogenicity of Pseudomonas solanacearum to colony appearance in a tetrazolium medium[J].Phytopathology 1954,44(12):693-695.
[24]FEGAN M,PRIOR P.How complex is the “Ralstonia solanacearum” species complex?[M].American Phytopathological Society,2005:449-461.
[25]OPINA N,TAVNER F,HOLLWAY G,et al.A novel method for development of species and strain-specific DNA probes and PCR primers for identifying Burkholderia solanacearum (Formerly Pseudomonas solanacearum)[J].Asia-pacific Journal of Molecular Biology and Biotechnology,1997,5(1):19-30.
[26]王麗.中國馬鈴薯青枯菌致病力和遺傳多樣性研究[D].武漢:華中農(nóng)業(yè)大學(xué),2016.
[27]劉喜才.馬鈴薯種質(zhì)資源描述規(guī)范和數(shù)據(jù)標(biāo)準(zhǔn)[M].北京:中國農(nóng)業(yè)出版社,2006:2-14.
[28]高達(dá)芳,劉霞,楊艷麗.馬鈴薯青枯病病菌PMA-PCR活菌檢測體系優(yōu)化與初步應(yīng)用[J].中國植保導(dǎo)刊,2017,37(10):5-13.
[29]郜剛.青枯菌誘導(dǎo)的馬鈴薯防衛(wèi)相關(guān)基因克隆與表達(dá)[D].北京:中國農(nóng)業(yè)科學(xué)院,2008.
[30]PLANAS M M, KRESSIN J P,KASHYAP A,et al.Four bottlenecks restrict colonization and invasion by the pathogen Ralstonia solanacearum in resistant tomato[J].Journal of Experimental Botany,2020,71(6):2157-2171.

