口腔白斑病癌變相關缺氧應答基因和微小RNA的芯片檢測及表達驗證
施琳俊 楊溪 吳蘇寧 劉偉
1.上海交通大學醫學院附屬第九人民醫院·口腔醫學院口腔黏膜病科,國家口腔疾病臨床研究中心,上海市口腔醫學重點實驗室/上海市口腔醫學研究所,上海200011;2.上海交通大學醫學院附屬第九人民醫院·口腔醫學院口腔頜面頭頸腫瘤科,上海200011;3.江南大學附屬醫院(第三人民醫院)口腔科,無錫214000
口腔白斑(oral leukoplakia)是一種常見的口腔黏膜潛在惡性疾病,是口腔鱗狀細胞癌(squamous cell carcinoma,SCC)的重要來源[1]。白斑的癌變率為4%~18%[1-4]。上皮異常增生是白斑重要的病理特征,從無異常增生、輕-中-重度異常增生到癌變進程各階段較明確,白斑發生發展到癌變是腫瘤發生的良好研究模型。細胞低氧感知與響應的研究提示細胞缺氧微環境是惡性腫瘤發生的重要條件[5]。微小RNA(microRNA,miRNA)是長度在22 個核苷酸左右的非編碼單鏈RNA,參與轉錄后基因調控。研究[6-7]顯示,miRNA 對缺氧應答基因起著重要調控作用,并參與腫瘤發生。本研究利用人轉錄組芯片研究口腔白斑患者病損發生發展中的缺氧應答基因及相關miRNA,并驗證癌變進程中的關鍵基因及其相關miRNA的表達。
1 材料和方法
1.1 材料
納入轉錄組芯片研究的組織包括3例正常口腔黏膜、8 例口腔白斑、6 例口腔早期鱗癌(T1-2N0M0)。收集于2014 年9—12 月上海交通大學醫學院附屬第九人民醫院口腔黏膜科和頜面頭頸腫瘤科。8 例口腔白斑中,4 例無/輕度上皮異常增生,4 例中-重度上皮異常增生,本研究將其分別歸為低危白斑和高危白斑。納入差異基因驗證表達研究的組織包括6 例正常黏膜、12 例口腔白斑、12 例口腔早期鱗癌,收集于2018 年6—12 月上海交通大學醫學院附屬第九人民醫院口腔黏膜科和頜面頭頸腫瘤科。以上組織病理學診斷是依據世界衛生組織腫瘤分類標準[8],由上海交通大學醫學院附屬第九人民醫院口腔病理科醫師確認。組織樣本為活檢或手術后標本,放入裝有RNAlater 液的凍存管,立即置入液氮保存15 min 以上,然后轉入-80 ℃冰箱保存。所有患者術前均未進行化療、放療及激素等治療,且無自身系統性疾病和癌癥史。正常黏膜、口腔白斑和早期鱗癌3組患者的年齡和性別等因素均無統計學差異。研究對象均簽署知情同意書,本研究獲得上海交通大學醫學院附屬第九人民醫院倫理委員會批準(2016-80-T37)。
1.2 總RNA提取和質檢
按照TRIzol 試劑盒常規提取組織中總RNA,利用NanoDrop 2000 分光光度計(Thermo Scientific公司,美國)測定濃度及OD260/OD280,瓊脂糖凝膠電泳檢測RNA 完整性。納入本研究的組織樣本RNA 的OD260/OD280比率均在1.8 和2.1 之間,OD260/OD230值均大于1.8,檢測顯示RNA 質量良好,符合實驗要求。
1.3 轉錄組芯片研究
樣本的標記、轉錄組學芯片的雜交以及洗脫檢測按照Affymetrix GeneChip 人轉錄組芯片(human transcriptome array,HTA)2.0 標準流程執行。首先,總RNA 反轉錄成雙鏈cDNA,再進一步合成cRNA,接著對cRNA進行第2輪反轉錄合成cDNA,片段化并與生物素標記后與芯片雜交,洗脫和染色后掃描得到原始圖像。采用Affymetrix Gene-Chip Command Console 軟件處理提取原始數據和Expression Console 軟件對芯片進行基因水平的標準化。利用Genespring 軟件分析差異基因,根據t檢驗的P值和倍數變化值進行篩選,篩選的標準為上調或者下調倍數變化值≥2.0 且P值<0.05。接著,對差異基因進行基因本體論(gene ontology,GO)功能分析,按照GO 生物學作用分類,篩選出生物學作用為缺氧應答的基因。最后,對差異基因進行非監督層次聚類,展示差異基因在不同樣本間的表達模式。
1.4 實時定量逆轉錄聚合酶鏈反應(quantitative reverse transcription polymerase chain reaction,qRT-PCR)
利用HiScript ⅡQ RT SuperMix for qPCR(+gDNA wiper)將待測RNA 逆轉錄成cDNA。Roche LCPDS2軟件設計引物,缺氧關鍵基因低氧誘導因子1α(hypoxia-inducible factor 1α,HIF1α)、趨化因子配體2(chemokine cc-motif ligand 2,CCL2)、基質金屬蛋白酶3(matrix metalloproteinase 3,MMP3)和miRNA的引物序列見表1。利用QuantiFast?SYBR?Green 聚合酶鏈反應(polymerase chain reaction,PCR)試劑盒(Qiagen 公司,德國)在LightCycler?480 Ⅱ型熒光定量PCR儀(Roche公司,瑞士)上進行反應。體系:2×QuantiFast?SYBR?Green PCR Master Mix,5 μL;10 μmol·L-1Forward primer,0.2 μL;10 μmol·L-1Reverse primer,0.2 μL;cDNA,1 μL;Nuclease-free H2O,3.6 μL。PCR程序:95 ℃5 min;95 ℃10 s,60 ℃30 s,40個循環。循環結束后利用熔解曲線檢測產物特異性:從60 ℃緩慢升溫至97 ℃,每℃采集5 次熒光信號。GAPDH 和ACTB 分別作為mRNA 和mi-RNA 的內參,采用2-ΔΔCt法測定相對表達水平,設置3個重復孔,計算其均數和標準差。

表1 缺氧關鍵基因和miRNA的引物序列Tab 1 Primer sequences of hypoxia key gene and miRNA
1.5 統計學分析
采用SPSS 17.0 統計軟件進行分析。采用方差分析比較各組間基因定量表達的差異,以P<0.05為有統計學差異。利用STRING-蛋白質相互作用線上數據庫對白斑癌變缺氧應答蛋白的相互作用構建網絡關系圖,利用miRWalk 綜合型的miRNA靶基因數據庫預測hsa-miR-21-5p 的靶基因與白斑發生發展缺氧應答相關基因取交集。
2 結果
2.1 口腔白斑病各階段的差異表達基因
轉錄組芯片檢測結果顯示:正常黏膜與低危白斑間有855個差異基因,低危白斑與高危白斑間有399 個差異基因,高危白斑與早期鱗癌間有797個差異基因(圖1)。

圖1 口腔正常黏膜、低危白斑、高危白斑和早期鱗癌組間的差異基因數目Fig 1 The number of differential genes in normal mucosa,lowrisk oral leukoplakia,high-risk oral leukoplakia and SCC
2.2 口腔白斑病各階段的缺氧應答差異表達基因
GO 功能分析結果表明,正常黏膜與低危白斑間有7個缺氧應答差異基因,低危白斑與高危白斑間有10 個缺氧應答差異基因,高危白斑與早期鱗癌間有21 個缺氧應答差異基因(圖2),具體基因名稱和位點見表2。
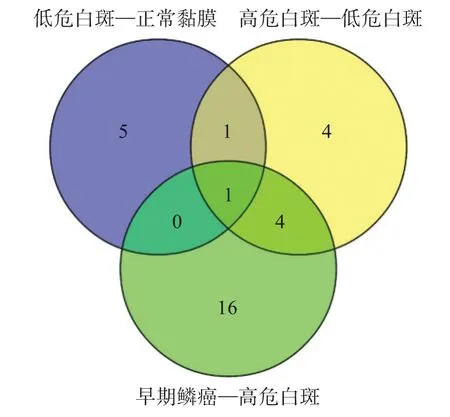
圖2 正常黏膜、低危白斑、高危白斑和早期鱗癌的組間差異缺氧應答基因數目Fig 2 The number of differential hypoxia genes in normal mucosa,low-risk oral leukoplakia,high-risk oral leukoplakia and SCC
2.3 口腔白斑病各階段的差異miRNA
轉錄組芯片檢測結果顯示:正常黏膜與低危白斑間有56 個差異miRNA,差異最大的前3 位是miR-12 (下調18.75 倍)、miR-124 (上調10.19倍)、miR-367(下調4.30 倍);低危白斑與高危白斑間有25 個差異miRNA,差異最大的前3 位是miR-118(上調3.84 倍)、miR-934(下調2.82 倍)、miR-98(下調2.67 倍);高危白斑與早期鱗癌間有68 個差異miRNA,差異最大的前3 位是miR-675(下調8.67 倍)、miR-650(上調4.11 倍)、miR-21(上調3.71倍)(圖3)。
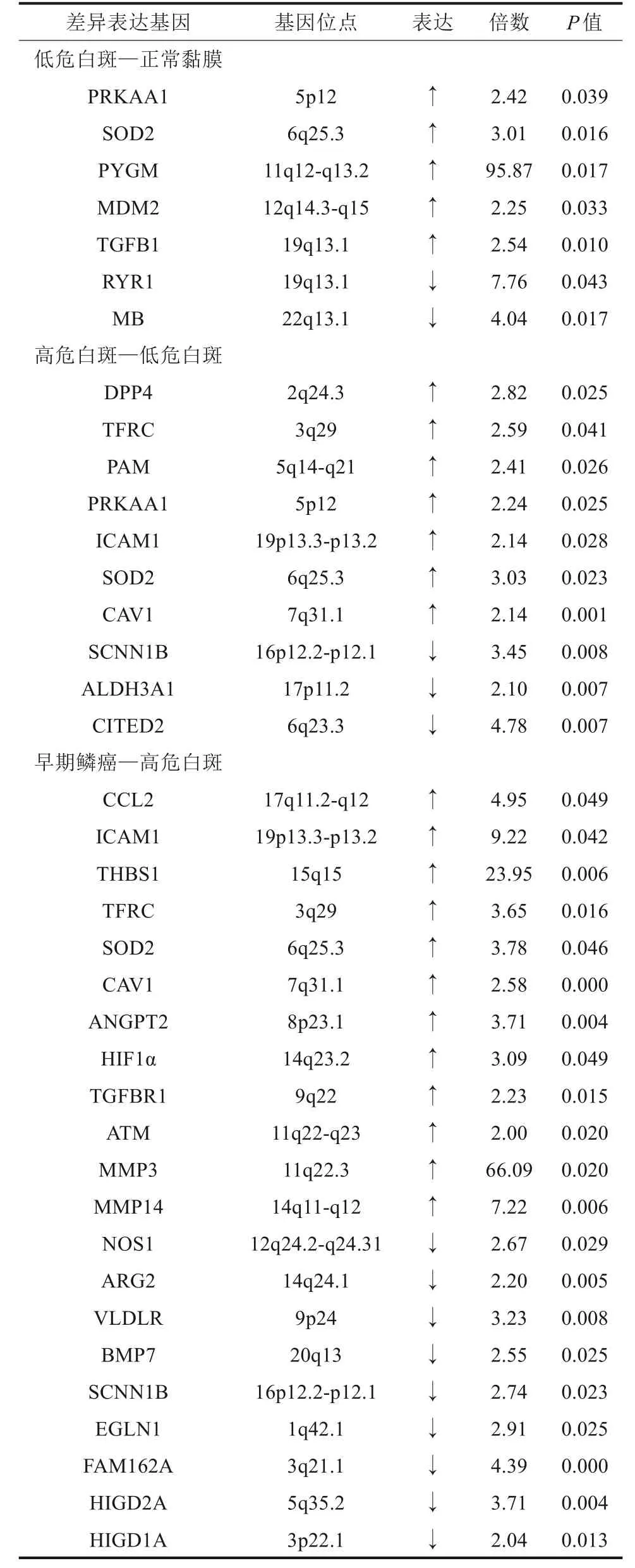
表2 口腔白斑病各階段的缺氧應答差異表達基因Tab 2 Differential hypoxia gene expression in each stage of oral leukoplakia
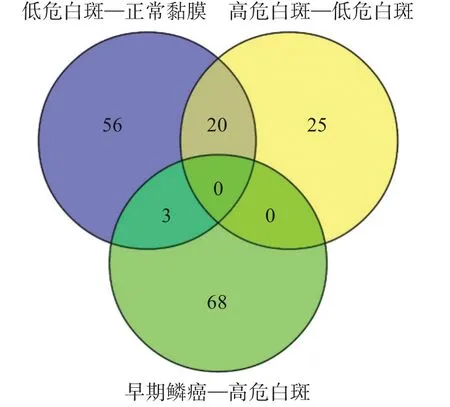
圖3 正常黏膜、低危白斑、高危白斑和早期鱗癌的組間差異miRNA數目Fig 3 The number of differential miRNA in normal mucosa,lowrisk oral leukoplakia,high-risk oral leukoplakia and SCC
2.4 白斑癌變缺氧應答基因和miR-21的網絡關系
高危白斑到早期鱗癌這一關鍵階段的21 個差異缺氧應答基因和miR-21 的網絡關系分析結果顯示:HIF1α、CCL2 和MMP3 位于蛋白質相互作用網絡圖的關聯中心,可視作關鍵基因。miRWalk數據庫預測靶基因顯示:miR-21 的靶基因與其中10個缺氧應答差異基因相關聯。
2.5 白斑缺氧應答基因和miRNA的驗證
qRT-PCR 結 果表明:HIF1α、CCL2、MMP3的mRNA 和miR-21 在正常黏膜、口腔白斑和早期鱗癌中的相對表達量均呈階梯式升高,在白斑與早期鱗癌之間的表達差異均具有統計學意義(圖4),這與轉錄組芯片結果基本一致。
3 討論
口腔黏膜白斑癌變是由多基因異常參與的組織細胞結構和功能改變的多步驟過程,高危白斑的早期診斷及危險評估尤為重要。目前,臨床上常用視診、觸診、常規病理學進行口腔癌前病變的診斷和評估,而細胞基因改變發生于組織形態學改變之前,研究白斑發生發展進程中基因組學改變對癌變早期診斷及分子機制研究具有重要作用。單個或數個分子蛋白不足以闡明白斑與鱗癌之間的差異[9-10],高通量的組學研究可能更具有優勢。本研究選取的Affymetrix GeneChip HTA 2.0 芯片是新一代全轉錄組芯片,該芯片設計了近700萬條探針,可以檢測超過28 萬條全長轉錄本,包括超過24 萬條編碼轉錄本RNA 和超過4 萬條非編碼轉錄本RNA。
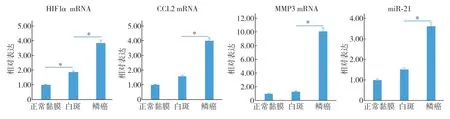
圖4 缺氧應答基因HIF1α、CCL2、MMP3 mRNA和miR-21在正常黏膜、白斑和早期鱗癌中的表達Fig 4 Expression of HIF1α, CCL2, MMP3 mRNA and miR-21 in normal mucosa, oral leukoplakia and SCC
納入轉錄組芯片的梯度式病例設置是本研究的特色。針對口腔白斑的發生發展,本研究設置4種病例,正常黏膜(n=3)、低危白斑(n=4)、高危白斑(n=4)、早期鱗癌(n=6),模擬白斑癌變的多步驟進程,研究結果可反映白斑癌變不同階段的分子生物學特性。回顧文獻,學者們對此也進行過相應研究,如對正常黏膜(n=3)和白斑(n=3)進行Affymetrix U133 plus 2.0 基因芯片研究[11],對正常黏膜(n=10)和白斑(n=10)進行Agilent 基因組學芯片研究[12],對白斑(n=3)和鱗癌(n=3)進行SupperArray基因芯片研究[13]。而本研究的芯片病例設置為白斑發生發展的各階段,這是區別于既往的對白斑的芯片研究的特色之處。由于研究的病例數較少,故又通過qRT-PCR 實驗驗證基因表達。
細胞低氧微環境與腫瘤發生有著緊密的聯系。研究[5]表明,腫瘤超過1~2 mm3須依賴血管生成和氧氣,腫瘤內部由于癌細胞不受控的快速分裂增殖,導致大量細胞聚集在一起,卻沒有血管可以帶來養分和氧氣,腫瘤內部的細胞通常會陷入低氧環境中,從而通過HIF-1α 開啟或增強一系列基因的表達,其中包括促進能量物質無氧酵解的酶,導致癌細胞規避失巢凋亡并啟動遷移機制的信號通路。段寧等[14]對白斑(n=4)和鱗癌(n=4)進行單核苷酸多態性芯片研究,發現異常基因主要位于第3、5~9、11、13~15、17、18染色體。本項目篩選出的缺氧相關基因位點亦多位于這些染色體。
本研究中轉錄組芯片篩選出白斑發生發展各階段的缺氧應答基因,重點關注從高危白斑到早期鱗癌這一階段的關鍵基因。研究表明,HIF1α、CCL2 和MMP3 位于蛋白質相互作用網絡圖的關聯中心,可視作關鍵基因。挑選miR-21 作為關鍵miRNA,其主要原因是miR-21 與缺氧應答關系密切,是調控缺氧應答反應的關鍵miRNA[15]。qRTPCR實驗結果表明,HIF1α、CCL2和MMP3 mRNA和miR-21在白斑發展到早期鱗癌過程中顯著上調。從HIF-1α 和miR-21 在癌癥中的功能研究看:缺氧下的間充質干細胞分泌的胞外囊泡顯著增強肺癌細胞的增殖、存活率、侵襲性、上皮間質轉化以及巨噬細胞M2 偏振,沉默miR-21 可顯著消除缺氧下的胞外囊泡對癌癥和巨噬細胞M2極化,表明缺氧微環境下通過細胞外囊泡中的miR-21 上調可顯著減少肺癌細胞凋亡和促進巨噬細胞M2極化來促進肺癌的發展;miR-21 在放療抵抗的肺癌細胞中上調HIF1α,并促進糖酵解關鍵酶表達,通過HIF1α基因沉默可抑制糖酵解并使肺癌細胞對放療重新敏感,而在miR-21 抑制的放療抵抗細胞中HIF1α過表達可導致肺癌細胞重獲放療抵抗,表明miR-21 通過上調HIF1α 和促進糖酵解增加放療抵抗作用;此外,缺氧微環境可上調人乳腺癌細胞MCF-7 中的HIF-1α 和miR-21 表達,其機制可能是上調的miR-21 通過多個信號通路調控靶基因進而影響癌細胞的增殖及凋亡。
目前,缺氧應答基因與口腔潛在惡性疾病的相關研究較少,本研究的結果提示HIF-1α 等基因和miR-21 導致的缺氧響應在癌變進程中具有重要性,白斑癌變微環境中miR-21 與HIF-1α 的信號通路和分子機制值得進一步研究。本文為白斑發病和癌變的分子機制、尋找白斑早期診斷的分子標記的深入研究提供新依據,為白斑的發生發展機制和標志性癌變基因探針的篩查奠定了基礎。
利益沖突聲明:作者聲明本文無利益沖突。

