癌組織中KLF9、TFAP4基因表達在非小細胞肺癌患者預后中的應用價值
蔡衛(wèi)梅,李偉偉,陸志紅,楊留中
新鄉(xiāng)醫(yī)學院第一附屬醫(yī)院腫瘤科三病區(qū)(河南衛(wèi)輝 453100)
非小細胞肺癌(non-small cell lung cancer,NSCLC)是肺癌主要類型之一,早期易被忽略,大多患者就診時進展至中晚期,常采用姑息性治療,5年生存率<20%,預后較差[1]。而復發(fā)與轉移是NSCLC治療失敗的主要原因,因此研究復發(fā)與轉移的相關機制及預后的影響因素意義重大。Kruppel樣轉錄因子9(Kruppel-like factor 9,KLF9)系基因調(diào)控因子,能通過轉錄激活域或轉錄抑制域與核定位信號發(fā)揮轉錄調(diào)節(jié)因子功能,在黑色素瘤、胰腺癌中表達異常,并能調(diào)控細胞增殖、遷移、侵襲[2-3]。轉錄因子激活增強子結合蛋白4(transcription factor activating enhancer binding protein 4,TFAP4)是堿性螺旋環(huán)-螺旋轉錄因子家族成員,在細胞增殖、分化、凋亡中發(fā)揮重要作用,其水平升高,可促進胃癌細胞遷移和侵襲[4-5]。但現(xiàn)階段關于KLF9、TFAP4在NSCLC患者中與臨床病理特征關系的研究較少,對預后的影響仍不明確,本研究對此進行探討,報告如下。
1 資料與方法
1.1 一般資料 選取我院2014年1月至2016年8月收治的NSCLC患者94例作為研究對象,均符合NSCLC診斷標準[6],入組時首次確診,可耐受活檢,無放化療等相關治療史,無肺結核,并同意配合隨訪,排除合并自身免疫疾病、存在認知、精神障礙者。
1.2 方法
1.2.1 主要試劑、儀器 Trizol總RNA抽提試劑盒、熒光定量PCR試劑盒、第一鏈cDNA合成試劑盒、DNA marker(上海生工生物工程公司);PCR儀(美國ABI公司,7500);恒溫振蕩器(太倉市科教器材廠);高速離心肌(Heraeus公司);電泳儀(北京六一儀器廠);調(diào)速振蕩器(金華市富華儀器有限公司)。
1.2.2 檢測方法 入組者均于入院后治療前,活檢采集NSCLC組織標本,放入液氮冷凍,標本采集前均無NSCLC相關治療史。自液氮中取100 mg標本,研缽中迅速研磨至粉末,加入1 mL Trizol試劑,并轉入1.5 mL EP管中,反復吹打至充分溶解,室溫放置10 min。加入0.2 mL氯仿,低溫充分震蕩10 min,室溫放置5 min,12 000 r/min離心15 min,可見樣本分為3層,小心吸取上層水相至新離心管中,加入等體積的異丙醇,充分混勻后室溫放置10 min,12 000 r/min離心10 min,棄去上清,加入用0.1%DEPC水配的70%乙醇 1 mL,7 500 r/min離心5 min,上清棄去,倒扣EP管吸干水分,空氣干燥10 min。加入40 μL左右0.1% DEPC水溶解沉淀,吹打混勻,-80℃保存。逆轉錄前取2 μL總RNA溶液,采用紫外分光光度儀260與280 nm波長下測定OD值,以驗證RNA純度與濃度,OD260/280介于1.80~2.00為符合要求。取總RNA溶液10 μL,加入1 μL Oligo(dT)(0.5 μg/μL)、1 μL RNase free ddH2O,65℃溫浴5 min,再冰浴30 s,加入5×Reaction Buffer 4 μL、M-MuLV Reverse Transcriptase 1 μL、dNTP Mix(10 mmol/L) 2 μL、RNase Inhibitor(20 U/μL)1 μL,內(nèi)參β-actin上下游引物分別為5′-TGACGTGGACATCCGCAAAG-3′、5′-CTGGAAGGTGGACAGCGAGG-3′(205 kb),KLF9上下游引物分別為5′-AGTACCGACCCATCCAGAC-3′、5′-GCCGTTCACCTGTATGCAC-3′(295 kb),TFAP4上下游引物分別為5′-GCTGAGTCTCGGGGGTTAGT-3′、5′-GTGCCCTCTTTGCAACATTT-3′(128 kb)。反應體系包括引物、4種dNTP、Taq DNA聚合酶、靶序列DNA和PCR反應緩沖液共20 μL,反應條件,95℃預變性3 min,95℃變性5 s,60℃退火/延伸31 s,溶解曲線分析95℃ 15 s,60℃ 1 min,95℃ 15 s,共42個循環(huán),以2-ΔΔCt表示檢測基因相對表達量。
1.3 觀察指標 (1)比較兩組年齡、性別、病理類型、TNM分期、淋巴結轉移、分化程度、腫瘤最大徑。(2)比較兩組癌組織中KLF9、TFAP4 mRNA表達量。(3)分析NSCLC預后的相關影響因素。(4)癌組織中KLF9、TFAP4 mRNA與TNM分期、淋巴結轉移、分化程度、腫瘤最大徑的相關性。(5)比較KLF9、TFAP4 mRNA高危者、低危者生存曲線。
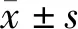
2 結果
2.1 癌組織及癌旁組織KLF9、TFAP4 mRNA表達水平 癌組織KLF9 mRNA表達水平低于癌旁組織,TFAP4 mRNA表達水平高于癌旁組織(P<0.05)。見表1。

表1 癌組織及癌旁組織KLF9、TFAP4 mRNA表達水平比較
2.2 不同KLF9 mRNA表達水平患者臨床病理特征 兩組年齡、性別、病理類型相比,差異無統(tǒng)計學意義(P>0.05);KLF9 mRNA高表達組腫瘤最大徑、TNM分期、淋巴結轉移比例、分化程度與低表達組相比,差異有統(tǒng)計學意義(P<0.05)。見表2。

表2 不同KLF9 mRNA表達水平患者臨床病理特征 例(%)
2.3 不同TFAP4 mRNA表達水平患者臨床病理特征 兩組年齡、性別、病理類型相比,差異無統(tǒng)計學意義(P>0.05);TFAP4 mRNA高表達組腫瘤最大徑、TNM分期、淋巴結轉移比例、分化程度與低表達組相比,差異有統(tǒng)計學意義(P<0.05)。見表3。

表3 不同TFAP4 mRNA表達水平患者臨床病理特征 例(%)
2.4 癌組織中KLF9、TFAP4 mRNA與臨床病理特征的關系 Pearson相關性分析,KLF9 mRNA與TNM分期、淋巴結轉移、腫瘤最大徑呈負相關,與分化程度呈正相關,TFAP4 mRNA與TNM分期、淋巴結轉移、腫瘤最大徑呈正相關,與分化程度呈負相關(P<0.05)。見表4。

表4 癌組織中KLF9、TFAP4 mRNA與臨床病理特征的關系
2.5 生存分析 隨訪期間,脫落5例。KLF9 mRNA、TFAP4 mRNA高表達與低表達患者生存曲線比較,差異有統(tǒng)計學意義(2=6.735、5.833,P=0.009、0.016),見圖1、2。

圖1 KLF9 mRNA高、低表達患者生存曲線

圖2 TFAP4 mRNA高、低表達患者生存曲線
3 討論
NSCLC具有發(fā)病率高、預后差等特點。盡管現(xiàn)有診療技術不斷進步,但NSCLC患者生存率提高程度有限,因此研究NSCLC分子水平相關機制,為靶向性治療提供思路,對改善患者預后至關重要。
3.1 癌組織中KLF9基因表達及與NSCLC患者預后的關系 KLF9羧基末端含有3個由高度保守的氨基酸組成的鋅指結構,鋅指結構內(nèi)部存在核定位信號,具有增強或抑制靶基因轉錄的作用,在機體重要器官發(fā)育、細胞增殖、分化、凋亡中扮演重要角色[7-8]。Kong等[9]研究顯示,KLF9在NSCLC組織和細胞系中呈低表達,采用小RNA技術靶向KLF9,可影響癌細胞增殖和侵襲,提示KLF9與NSCLC臨床病理特征有關,可能會影響患者預后。本研究顯示,KLF9 mRNA高表達組腫瘤最大徑、TNM分期、淋巴結轉移比例、腫瘤最大徑與低表達組相比,差異顯著,與TNM分期、淋巴結轉移、腫瘤最大徑呈負相關,與分化程度呈正相關,提示KLF9 mRNA表達可影響NSCLC患者腫瘤分期、大小、轉移、分化程度,故與預后密切相關,上調(diào)KLF9 mRNA表達可能有助于患者臨床病理特征及預后的改善,為基因靶向治療提供了一個方向。郝登榮等[10]報道顯示,NSCLC組織中KLF9陽性率明顯低于癌旁組織,有淋巴結轉移、TNM分期Ⅲ~Ⅳ期患者KLF9 mRNA水平低于無淋巴結轉移、TNM分期Ⅰ~Ⅱ期患者,本研究結論與之一致。KLF9影響預后的機制可能為:(1)KLF9能通過轉錄特異性結合基質(zhì)金屬蛋白酶28的啟動子區(qū)域,調(diào)控基質(zhì)金屬蛋白酶28表達,從而抑制癌細胞的侵襲和轉移[11]。(2)KLF9能通過調(diào)節(jié)氧化應激,促進癌細胞的凋亡[12]。同時本研究發(fā)現(xiàn),KLF9 mRNA高表達者生存曲線優(yōu)于低表達患者,直接佐證了KLF9 mRNA高表達有利于預后的改善。
3.2 癌組織中TFAP4基因表達及與NSCLC患者預后的關系 TFAP4能識別并結合DNA[13]。Yang等[14]研究顯示,TFAP4在結直腸癌中呈高表達,沉默TFAP4表達可抑制結直腸癌細胞的侵襲與遷移,提示TFAP4與結直腸癌生物學行為有關,但在NSCLC中的報道較少。本研究發(fā)現(xiàn),TFAP4 mRNA高表達組腫瘤最大徑、TNM分期、淋巴結轉移比例、腫瘤最大徑與低表達組相比差異顯著,TFAP4 mRNA與TNM分期、淋巴結轉移、腫瘤最大徑呈正相關,與分化程度呈負相關,提示抑制TFAP4 mRNA表達有助于改善患者臨床特征與預后。Wei等[15]報道顯示,與TFAP4低表達患者相比,TFAP4高表達結直腸癌患者的總生存時間顯著減少,是總生存時間的獨立影響因素,支持本研究結論。結合相關文獻,TFAP4能調(diào)控上皮-間質(zhì)化過程多種基因表達,使細胞連接與極性喪失,為腫瘤細胞侵襲提供便利,且TFAP4參與細胞增殖的調(diào)控,在細胞分裂增殖的G2階段,TFAP4可導致染色體錯聚和多極紡錘體,最終激活DNA損傷反應,導致細胞周期阻斷被去除,細胞增殖持續(xù)進行,從而促進癌細胞的增殖、淋巴結的轉移[16-17]。同時本研究顯示,TFAP4 mRNA低表達患者生存曲線優(yōu)于高表達者,直接證實TFAP4 mRNA低表達可改善預后。本研究不足之處在于,樣本量較小,且癌組織的獲取具有有創(chuàng)性,有待后續(xù)擴大病例數(shù),進行驗證、完善。
NSCLC患者癌組織中KLF9、TFAP4基因表達與TNM分期、淋巴結轉移、腫瘤最大徑、分化程度顯著相關,可影響患者預后,靶向KLF9、TFAP4基因可能有助于預后的改善。

