14株北京地區犬細小病毒分離毒株的VP2、NS1基因序列分析
李少晗,由欣月,范君文,徐 一,郝雲峰,崔尚金,秦 彤*
(1. 中國農業科學院北京畜牧獸醫研究所,北京 100193; 2. 獸用藥物與獸醫生物技術北京科學觀測站,北京 100193; 3. 北京市動物疫病預防控制中心,北京 102629;4. 中國動物疾病預防控制中心,北京 100125)
犬細小病毒病是由犬細小病毒(canine parvovirus,CPV)引起的,以出血性腸炎和心肌炎為主要特征的犬病毒性傳染病。該病在全球范圍內廣泛流行,是危害犬類的重要傳染病之一。CPV是一種無囊膜的單股負鏈DNA病毒,其基因組編碼兩個結構蛋白(VP1和VP2)和兩個非結構蛋白(NS1和NS2)[1]。VP2是CPV主要的衣殼蛋白,抗原性較強,可以誘導產生高水平的中和抗體,且在決定病毒的宿主范圍和組織趨向性方面發揮著重要作用[2-3]。NS1蛋白具有ATP酶和解旋酶的功能,能夠調控其他蛋白的表達,且與病毒DNA的復制、轉錄以及誘導細胞凋亡等過程具有密切聯系[4-5],目前,對NS1基因的研究還不夠充分。
最初的CPV-2型在鑒定后不久就開始產生抗原變異。1978年,兩個新型抗原突變體出現:CPV-2a和CPV-2b型,與CPV-2相比,CPV-2a的VP2包含了5個氨基酸位點的突變(Met87Leu、Ile101Thr、Ala300Gly、Asp305Tyr、Val555Ile);1984年,另一個突變體CPV-2b被發現,其VP2發生Asn426Asp和Ile555Val兩個位點的突變[6]。隨后,CPV-2a和CPV-2b VP2基因發生Ser297Ala的突變,產生了New CPV-2a和New CPV-2b變異株[7-8];2000年,在意大利首次報道了另一種新穎的抗原變體,其特征是Asp426Glu,遂命名為CPV-2c[9],并快速在多個國家傳播流行。相對于最初的CPV-2,抗原突變體CPV-2a、CPV-2b和CPV-2c對犬的致病性更高,且病毒的宿主范圍不斷擴大[10]。
本研究從北京地區采集的犬糞便拭子成功分離鑒定到14株CPV毒株,并對其VP2和NS1基因進行序列分析,以期了解北京地區當前CPV的流行趨勢,為控制該病的傳播提供參考和依據。
1 材料與方法
1.1 樣品采集及處理
從北京地區寵物醫院收集了17份疑似細小病毒感染的犬糞便拭子,樣品信息見表1。將糞便拭子置于1 mL含10%甘油的PBS(pH 7.2)中,待PBS渾濁后,于4 ℃、12 000 r·min-1條件下離心10 min,取200 μL上清液用0.22 μm濾器過濾除菌,制備好的樣品于-20 ℃保存,用于病毒DNA的提取。
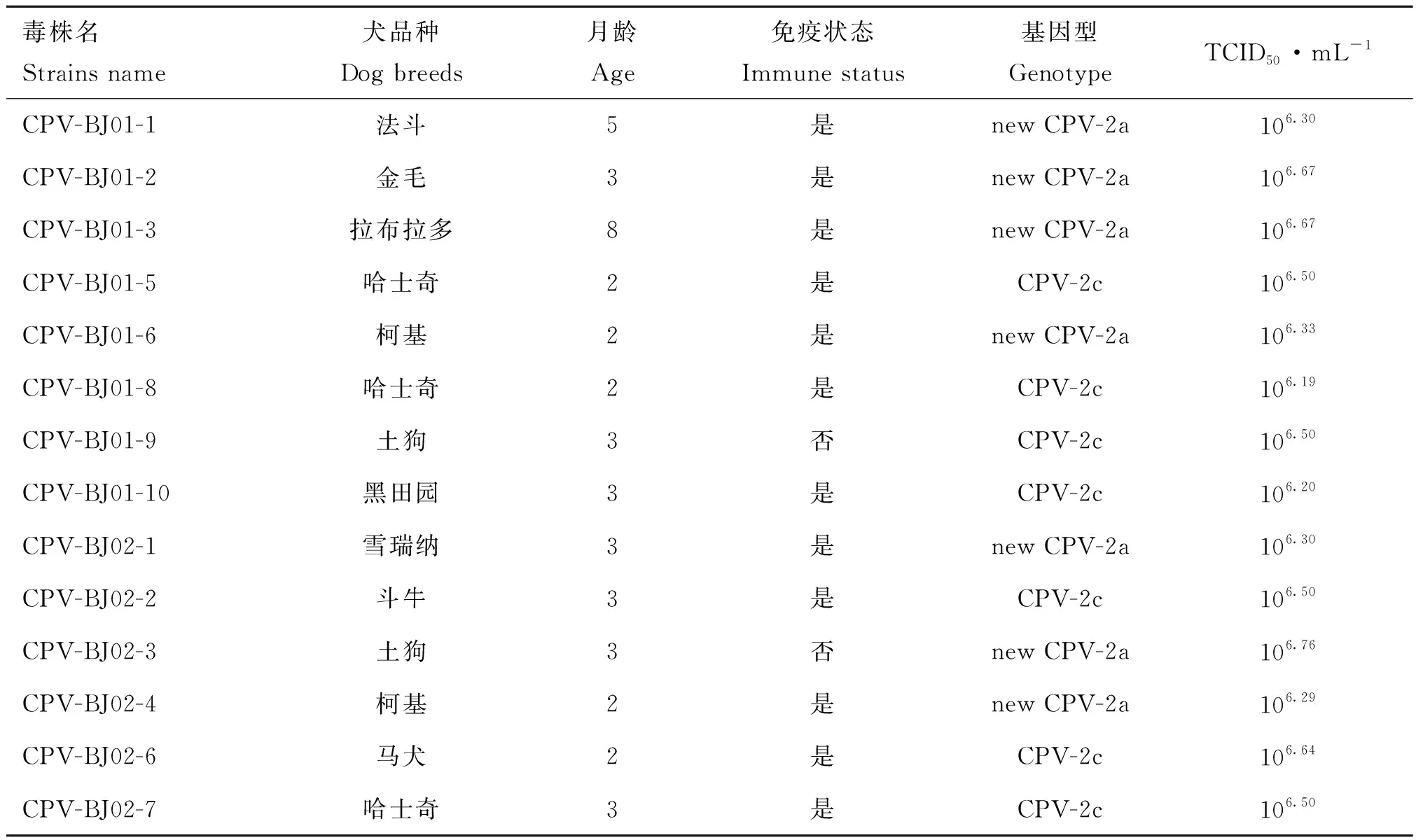
表1 臨床樣品采集的詳細信息Table 1 Details of the isolated CPV strains
1.2 DNA提取及PCR鑒定
采用艾德萊公司的DNA快速提取試劑盒提取樣本DNA。根據VP2基因保守序列設計引物,序列:IdenP1:5′-TGATGGAGCAGTTCAACCAGA-3′,IdenP2:5′-TCAGATCTCATAGCTGCTGGA-3′,擴增片段大小為574 bp。引物由北京華大基因公司合成。PCR反應體系:2×TaqPCR Master Mix 10 μL,IdenP1、IdenP2各1 μL,DNA模板2 μL, ddH2O補足至20 μL。PCR產物經1.0%瓊脂糖凝膠電泳檢測。
1.3 病毒的分離及鑒定
經PCR鑒定為陽性的樣本用于病毒的分離。將樣品上清液接種至剛剛傳代未貼壁的F81細胞懸液中,吹打混勻后,置于37 ℃、5% CO2恒溫培養箱中靜置培養,每隔12 h觀察細胞病變(CPE)。當CPE達到80%時收獲病毒,反復凍融3次后,對病毒進行傳代。待CPE穩定后,按照Reed-Muench方法計算病毒的TCID50。并進行間接免疫熒光(IFA)鑒定。
1.4 分離毒株VP2、NS1全基因的擴增及克隆
利用提取的樣本DNA,對VP2、NS1全基因進行擴增,擴增片段大小:VP2基因1 755 bp,NS1基因2 007 bp。 引物序列:VP2-F:5′-CGGGATCCATGAGTGATGGAGCAGTTCAA-3′,VP2-R: 5′-GG-AATTCTTAGTATAATTTTCTAGGTGCTAGTT-3′;NS1-F:5′-GACCGTTACTGACATTCGC-3′,NS1-R: 5′-CGGCGTCAGAAGGGTT-3′。PCR反應體系:LATaq酶0.5 μL,10×LA BufferⅡ 5 μL,dNTP Mixture 8 μL,DNA模板2 μL,引物各1 μL,ddH2O補足至50 μL。將擴增的VP2和NS1基因克隆到pMD18-T載體(TaKaRa公司)中,并送北京華大基因公司進行測序。
1.5 分離毒株VP2、NS1基因的遺傳進化分析
使用DNAStar軟件對測序結果進行分析,并根據VP2基因中關鍵氨基酸位點對分離毒株進行基因型鑒定。從GenBank中檢索來自世界各地的29個細小病毒序列,在Mega 6.0中使用最大似然法評估VP2和NS1的系統發育關系(重復數n=500)。
2 結 果
2.1 病毒的分離鑒定
經PCR鑒定,17份臨床病料為CPV陽性。將病料接種F81細胞,盲傳3代后,14株毒株能夠引起典型的CPE,PCR和IFA檢測均為陽性(圖略),成功分離到14株CPV,分離株在F81細胞上生長良好,病毒滴度為106.19~106.76TCID50·mL-1(表1)。
2.2 CPV基因型的鑒定及VP2基因氨基酸位點的突變分析
獲得14個毒株NS1和VP2基因完整ORF序列,426位氨基酸的突變被用來區分CPV-2a (426Asn)、CPV-2b (426Asp)和CPV-2c (426Glu),297位氨基酸的差異用來區分CPV-2a/2b與New CPV-2a/2b(Ser297Ala突變被用作“New CPV-2a/2b”的標記)[8, 11]。14個CPV毒株中,7株為New CPV-2a亞型(CPV-BJ01-1、CPV-BJ01-2、CPV-BJ01-3、CPV-BJ01-6、CPV-BJ02-1、CPV-BJ02-3、CPV-BJ02-4),7株為CPV-2c亞型(CPV-BJ01-5、CPV-BJ01-8、CPV-BJ01-9、CPV-BJ01-10、CPV-BJ02-2、CPV-BJ02-6、CPV-BJ02-7),未發現CPV-2a、CPV-2b或New CPV-2b亞型的毒株。
VP2蛋白共有6個突變的氨基酸位點(第5、13、370、426、440、574位),其中,僅有1樣本(CPV-BJ01-9)在第5位和13位氨基酸發生突變(第5位:A→G,13位P→S),有4個樣本(CPV-BJ01-1、CPV-BJ01-3、CPV-BJ01-8、CPV-BJ02-1)在第574位 發生E→K氨基酸突變;此外,VP2基因上15個核苷酸發生同義突變,對氨基酸序列沒有影響。這些結果表明,少數氨基酸突變(殘基5、370和440)被保存下來,隨著CPV不斷傳播,新的氨基酸突變(13和574 aa)頻繁發生。
2.3 NS1氨基酸位點的突變分析
NS1出現12個氨基酸位點的突變(第19、33、60、293、544、545、572、583、588、624、630、656位),其中,第19、33、293、583、588、656位氨基酸僅發生1次突變(CPV-BJ02-6毒株第19位:K→R,CPV-BJ01-10毒株第33位:D→G,CPV-BJ01-9毒株第293位:V→F,CPV-BJ01-2毒株第583位:E→K,CPV-BJ02-4毒株第588位:S→N,CPV-BJ01-6毒株第656位:S→F)。另外,NS1基因上28個核苷酸突變為同義突變,對氨基酸序列沒有影響。
2.4 VP2、NS1基因的遺傳進化分析
VP2基因進化分析表明,大部分的CPV-2c亞型毒株(CPV-BJ01-8、CPV-BJ02-7、CPV-BJ01-5、CPV-BJ02-2、CPV-BJ01-10)與2016年廣西南寧地區分離毒株(MK332001、MK332007)親緣關系密切,CPV-BJ01-9株與2014年吉林地區分離株(KT162005)親緣關系密切,另外1株(CPV-BJ02-6)與2014年黑龍江分離毒株(KT156832)親緣關系密切,分離毒株與國外毒株明顯分離(圖1);大部分的new CPV-2a亞型毒株(CPV-BJ02-1株除外)均與廣西南寧或吉林長春地區的分離株聚集在一起,說明本次分離毒株與廣西或吉林地區分離毒株具有相同的起源。NS1基因系統進化分析發現,雖然14個毒株分別屬于New CPV-2a和CPV-2c亞型,但它們的NS1基因都與New CPV-2a毒株親緣關系較近(圖2)。

圖1 犬細小病毒VP2基因的遺傳進化分析Fig.1 Maximum-likelihood tree based on VP2 gene sequences of canine parvoviruses (CPVs)
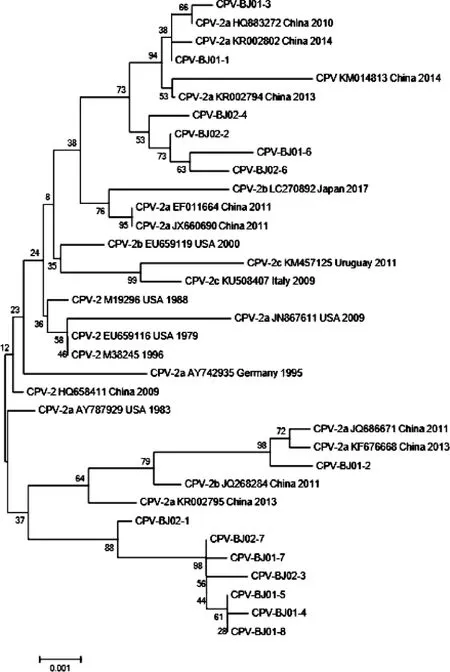
圖2 犬細小病毒NS1基因的遺傳進化分析Fig.2 Maximum-likelihood tree based on NS1 gene sequences of canine parvoviruses (CPVs)
3 討 論
盡管疫苗已廣泛應用,犬細小病毒仍是目前危害犬最重要的腸道病原之一,因此,進行持續的流行病學監測具有重要意義。對NS1和VP2基因的序列分析發現,除了已有報道的突變位點外,本研究首次發現了NS1基因上第19、33、293、588、624、656位氨基酸的突變,以及VP2基因上兩個新的突變位點(13和574 aa)。這可能歸因于新的選擇壓力,隨著CPV的傳播NS1、VP2基因仍在不斷地發生突變,未來有可能會出現新的毒株。然而,這些突變位點是否與NS1、VP2發揮功能有關仍需進一步研究。
在基因系統進化分析中,雖然14個毒株分別屬于New CPV-2a和CPV-2c,但是它們的NS1基因都與New CPV-2a毒株親緣關系密切,這一現象可用于解釋New CPV-2a和CPV-2c之間的重組。混合感染和連續的單向鏈置換復制機制可能有助于重組的發生[12]。從VP2和NS1基因的系統發育分析可以得出兩個結論:1)即使VP2基因相同,NS1基因也可能不同。即擁有相同VP2基因序列的兩種病毒不一定是同一株病毒;這可以解釋CPV-BJ02-2、CPV-BJ02-7和CPV-BJ01-8之間的關系,CPV-BJ01-1和CPV-BJ02-3之間的關系,CPV-BJ01-6和 CPV-BJ02-4以及CPV-BJ01-5和 CPV-BJ01-10之間的關系;2)可能CPV毒株VP2基因間關系不能完全代表NS1基因間的關系。例如,從VP2基因系統進化分析來看,CPV-BJ01-5、CPV-BJ01-8、CPV-BJ01-9、CPV-BJ01-10、CPV-BJ02-2、CPV-BJ02-6、CPV-BJ02-7 7個毒株雖屬于CPV-2c型,但其NS1基因卻與New CPV-2a親緣關系密切,造成這種差異的原因尚不完全清楚,但選擇壓力或重組可能有助于解釋VP2和NS1相互沖突的系統發育樹。對于病毒來說,表面抗原和內部抗原經歷的選擇壓力不同,所以VP2比NS1的變異頻率更快。因此,病毒頻繁變異可能是逃避宿主免疫監視的重要因素[13]。
4 結 論
成功分離鑒定到14株CPV毒株,New CPV-2a和CPV-2c型各7株。基因序列分析表明NS1、VP2基因仍在不斷產生新的突變。分離毒株與廣西或吉林地區分離毒株可能具有相同的起源。

