魏氏檸檬酸桿菌淀粉樣蛋白編碼基因csgA的分子功能
王穎思, 周 剛, 彭 紅, 李素娟, 謝小保, 施慶珊
廣東省微生物研究所, 廣東省科學院, 華南應用微生物國家重點實驗室,廣東省菌種保藏與應用重點實驗室, 廣州 510070
細菌生物膜是一種細菌聚集體,其構成主要包括細菌菌體及其所分泌的胞外多聚物(EPS),以及胞外蛋白、遺傳物質(eDNA)、營養(yǎng)物質和水分子等,生物膜的形成過程可分成三個主要階段:(1) 附著,細菌達到附著表面并粘附其上;(2) 生長成熟,粘附細菌開始生長,并分泌出胞外多糖等;(3) 脫離,細菌呈浮游狀態(tài),可以在其它環(huán)境進行粘附[1]。細菌生物膜的形成會引發(fā)一系列的環(huán)境和醫(yī)療問題。淀粉樣纖維蛋白(Curli)是細菌生物膜的主要成分之一,其產(chǎn)生可增強細菌粘附、定植、侵襲的能力,導致致病力提高,該蛋白常在大腸桿菌和沙門氏菌中產(chǎn)生。Curli由七種亞基參與組裝形成,CsgA是Curli主要的結構亞基,CsgA啟動子的表達需要CsgD的協(xié)助,并且CsgA在膜內形成可溶的蛋白后,CsgE抑制CsgA錯誤折疊,通過CsgF-CsgG形成通道分泌到外膜,與CsgB結合形成不溶聚集的Curli[4-7],但CsgA的分子功能以及對菌體的表型貢獻并不明朗。
魏氏檸檬酸桿菌(Citrobacterwerkmanii)BF-6是從工業(yè)腐敗物中分離得到的高產(chǎn)穩(wěn)產(chǎn)生物膜菌株,其生物膜粘附能力強,難以清除,從而引起許多工業(yè)產(chǎn)品如化妝品、洗滌劑等顏色、氣味變化,給工業(yè)生產(chǎn)帶來嚴重的損失[3],深入研究該菌的生物膜形成規(guī)律,將為以該菌為代表的霉腐細菌的防治提供理論指導。在本實驗室前期的研究中發(fā)現(xiàn)BF-6生物膜中csgA基因與浮游菌相比,其表達量發(fā)生了上調[2],但該基因發(fā)揮分子功能的具體方式未知。本文通過利用同源重組技術構建csgA基因缺失株ΔcsgA,并進行表型分析,研究Curli產(chǎn)生對BF-6生物膜的形成,以及對細菌耐藥性和Ca2+脅迫的效應差異,并且與CsgA生物信息學分析相結合,從而揭示csgA基因在魏氏檸檬酸桿菌中的分子功能。
1 材料與方法
1.1 材料
1.1.1菌株和質粒
魏氏檸檬酸桿菌(C.werkmaniiBF-6)是本實驗室從工業(yè)腐敗產(chǎn)品中分離的高產(chǎn)生物膜菌株,儲藏于廣東省微生物菌種保藏中心,保藏編號為GDMCC 1.1242;大腸桿菌(EscherichiacoliS17-1)和pSRK質粒由華南農(nóng)業(yè)大學王海洪教授饋贈;pYG4質粒由西南醫(yī)科大學附屬中醫(yī)醫(yī)院叢延廣教授饋贈。
1.1.2引物
實驗所使用的引物見表1。

表1 csgA基因敲除和回補所使用的引物
1.2 方法
1.2.1CsgA的生物信息學分析
從NCBI網(wǎng)站下載魏氏檸檬酸桿菌CsgA的蛋白序列(No. WP_042309244.1),用ProtParam在線軟件對該蛋白的基本特點進行分析;用Dictyoglyc分析CsgA蛋白中的糖基化位點;并用在線預測網(wǎng)站SPOMA對CsgA二級結構進行預測。
1.2.2csgA的基因敲除和回補
以BF-6全基因組為模版,用引物csgA-up-F、csgA-up-R和csgA-down-F、csgA-down-R分別PCR擴增csgA基因(No. B2G73_RS09265)上下游同源臂片段;并用BglII和NdeI雙酶切質粒pYG4使其線性化;用In-fusion HD Clong Kit(Takara Bio USA, Inc)重組酶連接線性化pYG4質粒、上游片段和下游片段,構建敲除載體質粒pYG4-Kana-csgA,并熱激轉化到E.coliS17-1感受態(tài)細胞中。敲除載體與BF-6接合轉移,涂布硫酸卡那霉素(100 mg/L)和利福平(20 mg/L)雙抗LB平板,篩選出一次交換菌株,將csgA基因一次交換菌涂布10%蔗糖平板進行反向篩選,挑取單菌落用csgA-QJ-F/R引物PCR篩選和驗證csgA敲除菌株。
以BF-6全基因組為模版,用csgA-com-F和csgA-com-R引物PCR擴增csgA基因回補片段,用BamH I和NdeI雙酶切回補片段和pSRK質粒,并用連接酶Ligation Kit(Takara)連接轉入E.coliS17-1感受態(tài)細胞中;將ΔcsgA和pSRK-GM-csgA接合轉移,涂布慶大霉素(30 mg/L)和利福平(20 mg/L)雙抗LB平板,篩選出csgA-com回補菌株,并用csgA-com-F/R進行驗證。
1.2.3生長曲線測定
將BF-6、ΔcsgA和csgA-com過夜培養(yǎng)菌液調成OD600=1.0,96孔板中每孔加入145 μL LB液體培養(yǎng)基,再加入15 μL稀釋好的菌液,采用Biotak生長曲線測定儀,在30 ℃靜置培養(yǎng),每隔1h測試一次OD600吸光值,試驗重復3次。
1.2.4細菌生物膜實驗
將BF-6、ΔcsgA和csgA-com過夜培養(yǎng)菌液調成OD600=1.0,LB培養(yǎng)液中加1%稀釋好的菌液,加入96孔板中,30 ℃培養(yǎng)箱靜置培養(yǎng);4 d后采用微孔板結晶紫染色法進行染色,并用95%的乙醇脫色,最后用全波長酶標儀分別讀取細菌浮游菌吸光度(OD600)和脫色后生物膜吸光度(OD595)。
1.2.5細菌最小抑制濃度測定
用肉湯微量稀釋法測定6種抗菌藥物對野生菌和敲除菌的最小抑菌濃度(MIC)。將過夜培養(yǎng)的菌液濃度調為1×106CFU/mL,用2倍稀釋法稀釋抗菌藥(包括環(huán)丙沙星(CIP)、頭孢他啶(CAZ)、頭孢噻肟(CIZ)、慶大霉素(GM)、羧芐青霉素(CB)、四環(huán)素(TE)、苯并異噻唑啉酮(BIT)、氯霉素(CL)),每孔加入100 μL MH培養(yǎng)液,首孔加入100 μL抗菌藥,混勻后吸取100 μL加入第二個孔,最后一個孔棄去100 μL培養(yǎng)液。再分別在每孔中加入10 μL菌液,30 ℃培養(yǎng)24 h后進行結果判定。
1.2.6剛果紅平板實驗
用無鹽LB培養(yǎng)基(Tryptone:10 g/L, Yeast extract:5 g/L, Agar:15 g/L)滅菌后加入剛果紅溶液,配置成40 mg/L剛果紅平板,將菌液調至OD600=1.0,取5 μL菌液滴加在平板表面,30 ℃培養(yǎng)2 d。實驗重復3次。
1.2.7剛果紅吸附定量分析
參照Beatable Sobieszczańska的方法[8],并進行一些改進。過夜培養(yǎng)的BF-6、ΔcsgA和csgA-com接種于液體培養(yǎng)基,30 ℃培養(yǎng)2 d后,將菌液濃度調成2×109CFU/mL,離心機12 000 r/min離心5 min,去上清液后,加0.01%剛果紅溶液重懸菌體,室溫孵育90 min,然后12 000 r/min離心5 min,取上清液測OD500。
1.2.8Ca2+脅迫條件下的生物膜形成量測定
將CaCl2加入LB培養(yǎng)基中配置成濃度為0 mmol/L、5 mmol/L、10 mmol/L、20 mmol/L、40 mmol/L、80 mmol/L、100 mmol/L、200 mmol/L、400 mmol/L、600 mmol/L和800 mmol/L溶液,并加入1%菌液,然后,分別加入96孔板中,30 ℃靜置培養(yǎng)4 d,采用微孔板結晶紫染色法進行染色,用全波長酶標儀分別讀取細菌浮游菌吸光度(OD600)和脫色后生物膜吸光度(OD595),并以未外源添加任何CaCl2的培養(yǎng)基作為對照。
2 結果
2.1 CsgA生物信息學分析
用ProtParam對蛋白質基本特點進行分析,發(fā)現(xiàn)CsgA具有149個氨基酸,化學分子式為C656H1032N204O218S2,原子總數(shù)為2112,估計半衰期為30 h,不穩(wěn)定指數(shù)為11.23,判定為穩(wěn)定蛋白質;用Dictyoglyc分析發(fā)現(xiàn)在13、17、19和21位置,CsgA蛋白中存在糖基化位點;用在線預測網(wǎng)站SPOMA對CsgA二級結構進行預測,其二級結構分析結果見圖1,表明:該蛋白多數(shù)為無規(guī)則卷曲,占53.6%,而β-折疊含26.85%,α-螺旋含有17.45%[9],與此同時,研究發(fā)現(xiàn)CsgA具有高度保守的β-折疊序列,Ser X5Gln X1Gly X1Gly Asn X1Ala X3Gln形成β-折疊-環(huán)-β-折疊的結構,在大腸桿菌中有5個重復的保守結構,而在BF-6中的CsgA蛋白序列中只有三個重復的β-折疊-環(huán)-β-折疊結構生成淀粉樣折疊[4,10]。

h: α-螺旋;t: β-轉角;c: 無規(guī)則卷曲;e: β-折疊
2.2 csgA的基因敲除和回補
以BF-6野生菌(WT)和ΔcsgA為模版,用引物csgA-QJ-F/R進行PCR擴增,野生菌擴增出大條帶:1295 bp,ΔcsgA為小條帶:845 bp;回補菌株用csgA-com-F/R進行擴增得到450 bp條帶(圖2);并且將上述條帶送往廣州擎科生物技術有限公司進行測序,結果顯示所擴增的條帶就是目的條帶,進一步證實敲除菌株和回補菌株的構建成功。

圖2 csgA基因敲除和回補菌株鑒定
2.3 csgA的敲除導致菌株形成生物膜的能力降低
將BF-6、ΔcsgA和csgA-com在96孔板中30 ℃分別培養(yǎng)48 h,每小時測量其菌液濃度OD600的變化,發(fā)現(xiàn)csgA敲除后和BF-6野生菌以及回補菌株生長曲線相比,并沒有明顯差異(圖3),說明csgA基因的表達對細菌的生長沒有影響;而Curli的形成影響細菌的粘附性,影響細菌生物膜的形成,csgA敲除后魏氏檸檬酸桿菌的生物膜形成量明顯減少,但對浮游菌的生長沒有影響(圖4)。

圖3 BF-6、ΔcsgA和csgA-com生長曲線

圖4 BF-6、ΔcsgA和csgA-com浮游菌和生物膜形成
2.4 csgA的敲除改變菌體淀粉樣蛋白和纖維素的合成
細菌在30 ℃無鹽培養(yǎng)基培養(yǎng)后結合剛果紅呈現(xiàn)四種形態(tài):rdar(red,dry and rough)產(chǎn)生Curli和Cellulose;pdar(pink dry and rough)只產(chǎn)生Cellulose,bdar(brown, dry, and rough)只產(chǎn)生Curli;saw(smooth and white)Curli和Cellulose均不產(chǎn)生[5,11]。野生菌BF-6菌落呈紅色干燥有褶皺,而敲除后細菌呈白色光滑,回補后細菌呈粉紅色光滑(圖5),說明野生菌產(chǎn)生Curli和Cellulose,敲除菌Curli和Cellulose均不產(chǎn)生,回補菌只產(chǎn)生Cellulose不產(chǎn)生Curli。上述結果表明csgA敲除后細菌Curli和Cellulose無法合成,導致對剛果紅結合能力明顯降低,褶皺消失。

A:BF-6野生菌,B:ΔcsgA敲除菌,C:csgA-com
野生菌BF-6和csgA-com在30 ℃中孵育1 h 30 min后,分別吸附了80.44%和74.26%的剛果紅,而ΔcsgA菌株只吸附了35.01%(圖6),上述結果與csgA基因的缺失導致Curli不能合成相關,也和剛果紅平板實驗結果相符合。

圖6 BF-6、ΔcsgA和csgA-com結合剛果紅定量測定
2.5 csgA的敲除改變菌體對部分殺菌劑的敏感性
選取了8種常見抗生素環(huán)丙沙星(CIP)、頭孢他啶(CAZ)、頭孢噻肟(CIZ)、慶大霉素(GM)、羧芐青霉素(CB)、四環(huán)素(TE)、苯丙異噻唑啉酮(BIT)、氯霉素(CL),測試BF-6、ΔcsgA和csgA-com對抗生素的MIC。結果發(fā)現(xiàn)csgA敲除后對慶大霉素(GM)、羧芐青霉素(CB)、頭孢噻肟(CIZ)的耐藥性升高,其余抗生素影響變化不明顯(表2)。青霉素類抗生素和頭孢噻肟抗生素主要抑制細胞壁的合成,而氨基糖苷類慶大霉素則是通過作用于細菌體內的核糖體,抑制細菌蛋白質合成,破壞細胞膜通透性,最后細菌死亡。csgA基因缺失可能導致抗生素的作用位點缺失,從而導致耐藥性的提高。
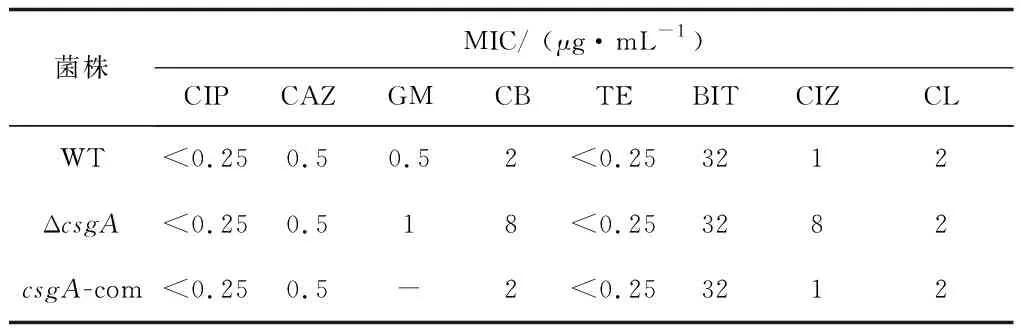
表2 各種殺菌劑對BF-6、ΔcsgA和csgA-com的最小抑菌濃度
2.6 鈣離子對敲除菌浮游菌和生物膜形成影響
不同濃度Ca2+添加到LB培養(yǎng)基中培養(yǎng)野生菌、ΔcsgA和csgA-com,結晶紫染色后發(fā)現(xiàn)添加了Ca2+各菌株的生物膜形成量增加。但在低濃度Ca2+作用下,ΔcsgA生物膜形成隨Ca2+濃度變化幅度比BF-6野生菌和csgA-com小;當Ca2+添加量達到400 mM時,生物膜形成量達到最大,再加大Ca2+濃度,生物膜形成量反而隨Ca2+濃度的增加而減少(圖7),可能是由于Ca2+濃度過高導致滲透壓過高,從而導致細菌破裂死亡和生物膜的形成量降低。
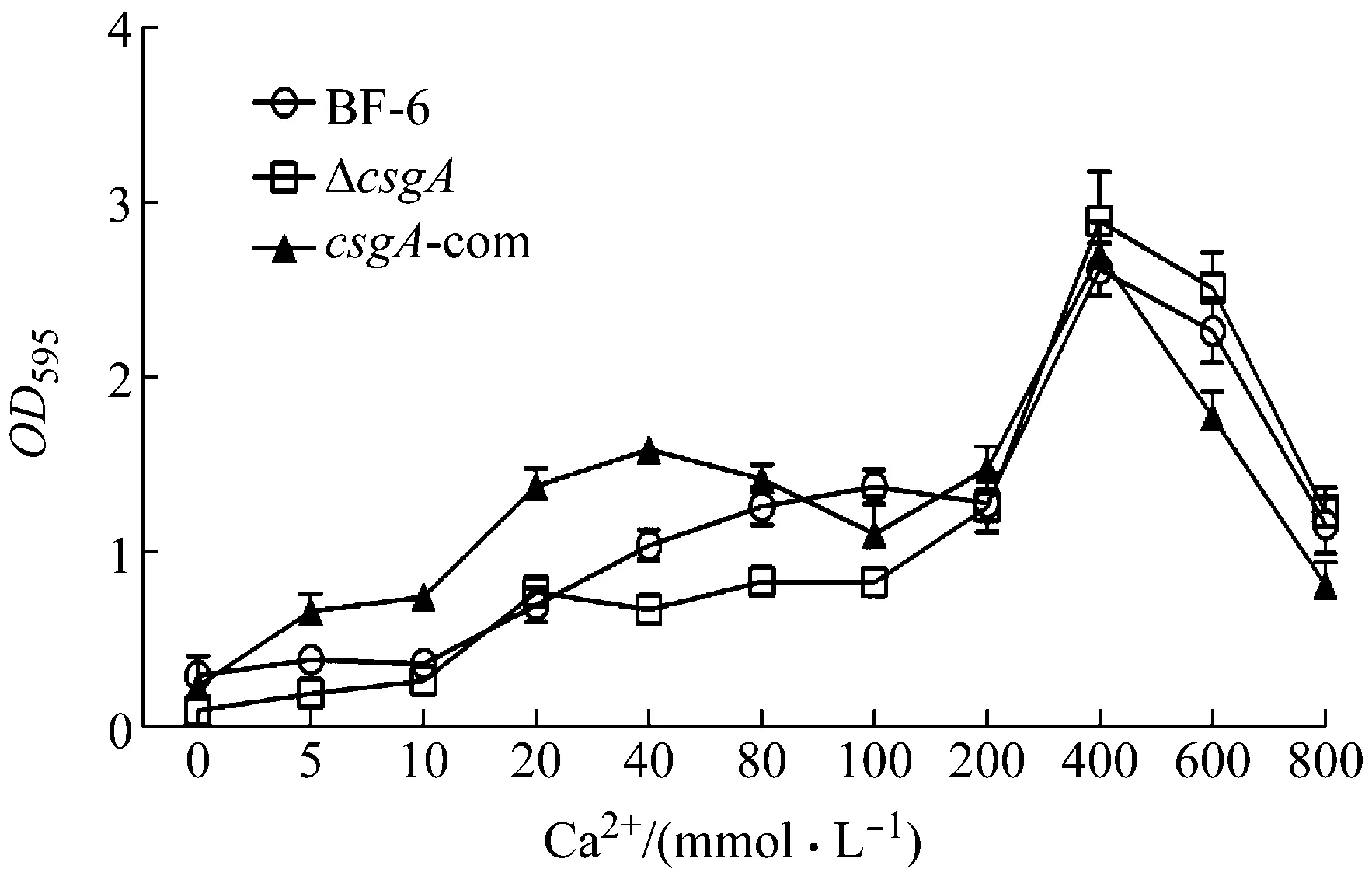
圖7 鈣離子脅迫條件下BF-6、ΔcsgA和csgA-com的生物膜形成量
3 討論
細菌生物膜是由細菌體外分泌的多糖、eDNA、RNA等物質所組成,其形成過程首先要完成對生物或者非生物表面的粘附,Curli參與表面粘附、細胞聚集和生物膜形成等過程,而CsgA作為淀粉樣蛋白Curli主要構成亞基在其中也起到重要的作用。由二級結構可以推測CsgA是β-折疊-環(huán)-β-折疊堆疊形成的立體結構,最終形成盤繞絲狀結構向外延伸[12]。報道發(fā)現(xiàn)CsgA帶極性的氨基酸(賴氨酸、精氨酸、谷氨酰胺)容易與二氧化硅吸附,而芳香族R基氨基酸(酪氨酸、苯丙氨酸)則與石墨烯強烈吸附[13]。鼠傷寒沙門氏菌敲除csgA基因后,對Hela細胞的粘附侵入能力降低[24]。Curli的成型表達可以增加O157:H7的毒力[7]。本研究發(fā)現(xiàn)魏氏檸檬酸桿菌csgA基因缺失導致細菌Curli無法形成,從而導致生物膜形成能力下降。
Ca2+通過以下幾種方式增強細菌生物膜的形成:(1) 作為交聯(lián)橋分子,增強細胞生物膜基質的穩(wěn)定性;(2) 可以調節(jié)生物膜形成相關基因的表達;(3) 通過與EF-handmotif(在1、3、5、7、12位置的殘基提供螯合Ca2+的配體)相結合,與氨基酸中陰離子相結合,介導細胞間粘附等,影響蛋白質構象變化從而影響生物膜點形成能力,促進細菌生物膜的形成[14-15,20-21]。低濃度Ca2+可以誘導Curli基因的表達,從而促進生物膜的產(chǎn)生,而高濃度Ca2+可能與細菌產(chǎn)生沉積效應。通過比對發(fā)現(xiàn)CsgA沒有與EF-handprotein相似的序列,從而無法與Ca2+相結合產(chǎn)生沉積。但在序列中有8個帶負電的氨基酸殘基,殘基可與Ca2+相結合,促進細菌生物膜形成。因此Ca2+脅迫條件下缺乏csgA基因生物膜的形成量小于相同條件下的BF-6野生菌和回補菌形成量。
另外,在陰溝腸桿菌感染病例中分離的細菌中發(fā)現(xiàn),csgA和csgD大量的表達,說明csgA是腸桿菌毒力相關基因[16-18]。加入不同濃度氨基糖苷類抗生素的細菌中,csgA的表達水平發(fā)生變化,說明csgA與細菌耐藥性有關[23],csgA的表達引起腸桿菌耐藥性增強,但本研究中發(fā)現(xiàn)BF-6中csgA敲除后生物膜形成減少,但對頭孢噻肟、慶大霉素和羧芐青霉素的耐藥增強,說明三種抗生素耐藥性的產(chǎn)生與生物膜形成并不相關。與此同時,革蘭氏陰性菌還可以通過外膜低滲透壓以及孔蛋白的低表達而對青霉素和其它親水抗生素具有抗性[19],csgA的缺失會導致脂蛋白Lpp的表達升高[22],而Lpp缺失使大腸桿菌對萬古霉素和利福平敏感[25],可能CsgA表達引起了外膜的變化,導致細菌耐藥性增強,具體作用機理還需要進一步驗證和探究。
本文通過對魏氏檸檬酸桿菌CsgA編碼基因進行敲除,通過生物信息學與生長曲線、生物膜、curli產(chǎn)生量、最小抑菌濃度和添加Ca2+對生物膜影響等表型相結合,對CsgA進行分析。發(fā)現(xiàn)CsgA與curli內在的關系,為以后對清除生物膜的研究提供了理論的基礎。

