靶向CysC基因shRNA慢病毒載體的構建對NSCLC A549細胞增殖的影響及機制初探*
鄭大煒,郭娜
南陽市中心醫院呼吸科(河南南陽 473009)
肺癌是全球發病率和病死率排名靠前的惡性腫瘤之一,我國更是肺癌患病大國,2014年全國腫瘤登記中心的數據顯示我國肺癌發病率為35.23/10萬,在全部惡性腫瘤發病中占19.59%;病死率為27.93/10萬,在全部惡性腫瘤發病中占24.87%[1-2]。而非小細胞肺癌(non-small cell lung cance,NSCLC)在所有肺癌患者中高達85%,5年生存率低至15%[3]。究其原因發現,術后腫瘤復發和轉移是影響NSCLC患者預后的重要原因[4]。研究顯示,手術聯合化療在一定程度上可延長患者的生存時間,但也易對患者造成一定損傷影響其生活質量[5]。因此明確肺癌發病機制,尋找新的NSCLC治療靶點和藥物,為患者提供更好的診療手段,延長患者生命,提高生活質量,是目前甚至將來最主要的任務之一。半胱氨酸蛋白酶抑制劑C (Cystatin C,Cys C)是一種屬于Cys Ⅱ家族的分泌型蛋白,又稱CST3,可抑制包括半胱氨酸蛋白酶在內的多種蛋白水解酶活性,在炎性反應及腎癌、卵巢癌、結直腸癌等惡性腫瘤發生、發展中有一定影響[6-7]。但目前在NSCLC中的研究報道較少。2017年5月至2018年12月,本研究通過構建CysC-shRNA慢病毒載體,探討CysC對NSCLC細胞增殖的影響及可能機制。
1 材料與方法
1.1 材料 NSCLC A549細胞、TOP10大腸桿菌感受態細胞和293T細胞購自中國科學生命院上海細胞研究所;RPMI-1640培養基、胎牛血清(FBS)、胰蛋白酶和青霉素-鏈霉素溶液均購自美國Gibco公司;T4連接酶、限制性內切酶Age Ⅰ和EcoR Ⅰ及連接試劑盒均購自美國NEB公司;慢病毒載體Pglv2-U6-Puro及包裝質粒購自上海吉瑪基因化學有限公司;質粒提取試劑盒、RNA提取試劑盒、逆轉錄試劑盒及轉染試劑盒Lipofectamine購自美國Invitrongen公司;qRT-PCR試劑盒購自美國Thermo Fisher公司;MTT購自美國Sigma公司;細胞總蛋白提取和二喹啉甲酸(bicinchoninic acid,BCA)試劑盒蛋白定量試劑盒購自北京天根生化科技有限公司;兔抗人β-actin、PI3K和Akt單克隆抗體購自美國Abcam公司;二抗購自北京中杉金橋公司。
1.2 方法
1.2.1 細胞培養和分組 將A549細胞和TOP10大腸桿菌感受態細胞接種于RPMI-1640培養基,置于37℃、5% CO2培養箱中,當細胞密度達到80%~90%時用胰酶進行消化傳代。本研究共分為3組:CysC-shRNA組、Ctr-shRNA組和空白對照組,前者須將CysC-shRNA重組慢病毒轉染A549細胞,中間須將Ctr-shRNA重組慢病毒轉染A549細胞,后者無須任何處理。
1.2.2 構建CysC-shRNA重組慢病毒 根據GenBank中人CysC基因序列及shRNA設計原則合成CysC-shRNA序列:5′-GCTCCTGCTGGCCATCCTG-3′,同時設計并合成陰性對照序列Ctr-shRNA:5′-TGCGAACGACTTCTTCGCC-3′;將其與T4連接酶、限制性內切酶Age Ⅰ和EcoR Ⅰ雙酶切后慢病毒載體連接,后將其轉化TOP10大腸桿菌感受態細胞,并將其接種于含青霉素-鏈霉素溶液的LB平板上繼續培養16 h,挑取菌落進行測序,挑選序列正確克隆構建CysC-shRNA重組慢病毒和CysC-shRNA重組慢病毒,并將其轉染293T細胞進行包裝、濃縮及滴度測定,以上步驟均在上海吉瑪基因化學有限公司幫助下完成。
1.2.3 重組慢病毒感染A549細胞 將CysC-shRNA和Ctr-shRNA重組慢病毒分別感染處于對數生長期的A549細胞,繼續培養72 h,后在熒光倒置顯微鏡下觀察各組GFP表達情況。
1.2.4 用qRT-PCR檢測各組CysC mRNA水平 收集轉染后處于對數生長期的各組單細胞懸液進行檢測,參考總RNA提取和逆轉錄試劑盒操作說明書進行總RNA提取和cDNA合成,后采用qRT-PCR法檢測各組CysC mRNA水平,其中CysC上下游引物分別為:5′-GCTCTTTCCAGATCTACGCT-3′和5′-AGGCAGCCGATGCTACTATT-3′;反應體系(20 μL):cDNA產物1 μL、上下游引物各0.5 μL、SYBR Green Master mix液 10 μL和雙蒸水8 μL;反應條件:95℃ 15 s、95℃ 5 s、60℃ 30 s,共循環45次,內參基因是GAPDH,以2-ΔΔCT描述CysC mRNA相對表達水平。
1.2.5 MTT實驗 轉染后,調整各組細胞密度至1×104個/mL,并將其接種于96孔板上,每孔添加100 μL,并設置3個復孔,繼續培養,并分別于第1、3和5天向每孔中避光加入20 μL 5 mg/mL MTT液,混勻,繼續培養4 h,棄孔中廢液,并向每孔加入100 μL DMSO液,搖床振蕩 3 min,放酶標儀上檢測 490 nm處各孔OD值,以OD值表示細胞增殖能力。
1.2.6 細胞克隆形成實驗 轉染后,調整各組細胞密度至1×104個/mL,并將其接種于6孔板上,每組設置3個復孔,繼續培養,每隔2~3 d換液1次,并于倒置顯微鏡下觀察細胞生長狀況,培養10~12 d后,用4%多聚甲醛固定細胞30 min,再用結晶紫染色15~25 min,待其自然干燥后觀察細胞集落生長情況,并拍照。
1.2.7 Western blot實驗 轉染后,收集各組對數生長期細胞,參考總蛋白提取試劑盒提取總蛋白,用BCA蛋白試劑盒進行蛋白定量分析,后進行Western blot實驗:(1)按需要配置不同濃度分離膠和濃縮膠;(2)向槽中填滿2×電泳緩沖液,平穩拔出梳子,按每孔50μg計算上樣量,將不同體積蛋白及蛋白Marker依次加入孔內;(3)設置電流為 120 mA,通電1 h進行電泳;(4)在Marker標示下按不同蛋白大小切膠,再按濾紙-膠-PVDF膜-濾紙結構依次擺放,將蛋白恒流轉至 PVDF膜;(5)加封閉液使其封閉;(6)向每條膜加入稀釋后的β-actin、PI3K和Akt單克隆抗體,4℃過夜;(7)TBST洗膜;(8)再向每條膜上加入稀釋好的二抗,37℃1 h,TBST洗膜;(9)ECL顯影。
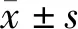
2 結果
2.1 熒光顯微鏡下觀察轉染效果 重組慢病毒感染A549細胞,72 h后于熒光顯微鏡下觀察CysC-shRNA組和Ctr-shRNA組GFP表達情況(圖1),發現CysC-shRNA組GFP表達水平明顯低于Ctr-shRNA組,提示重組慢病毒構建成功。

注:A:Ctr-shRNA組;B:CysC-shRNA組
2.2 重組慢病毒沉默效果鑒定 用qRT-PCR檢測各組CysC mRNA水平評估沉默效果,CysC-shRNA組、Ctr-shRNA組和空白對照組CysC mRNA水平比較差異有統計學意義(P<0.05),CysC-shRNA組CysC mRNA水平明顯低于Ctr-shRNA組和空白對照組(t=31.508、P=0.000,t=29.113、P=0.000);提示沉默效果好。見表1。

表1 各組CysC mRNA水平比較
2.3 各組細胞增殖能力比較 從第1天開始,CysC-shRNA組、Ctr-shRNA組和空白對照組3組OD值比較差異有統計學意義(P<0.05),以CysC-shRNA組細胞增殖能力最差,Ctr-shRNA組和空白對照組無明顯差異。見表2。

表2 各組OD值比較
2.4 各組細胞集落形成能力比較 空白對照組、Ctr-shRNA組和CysC-shRNA組細胞集落形成個數分別為(83±16)個、(80±14)個和(15±3)個,CysC-shRNA組集落形成數量明顯低于Ctr-shRNA組和空白對照組(P<0.05),但Ctr-shRNA組和空白對照組比較則差異無統計學意義(P>0.05)。見圖2。

注:A:空白對照組;B:Ctr-shRNA組;C:CysC-shRNA組
2.5 各組PI3K和Akt蛋白含量比較 CysC-shRNA組PI3K和Akt蛋白明顯低于Ctr-shRNA組和空白對照組,但后兩組比較則差異無統計學意義(P>0.05)。見圖3。

圖3 各組PI3K和Akt蛋白含量比較
3 討論
以手術治療為主、放化療為輔的綜合治療方式是目前NSCLC的治療方案,但多數患者易復發,且轉移率較高,導致病死率居高不下,因此探討NSCLC的具體發病機制對患者預后十分重要[8]。近年,國內外學者對腫瘤微環境研究較多,且發現其與腫瘤發生、發展及預后密切相關,而微環境中蛋白酶異常則是其主要特征之一,主要包括金屬蛋白酶、絲氨酸蛋白酶和半胱氨酸蛋白酶三類,以利于腫瘤細胞進入血液或淋巴循環,并到達特異部位繼續生存[9-10]。研究表明,在乳腺癌、頭頸癌及肺癌等多數惡性腫瘤中存在蛋白酶高水平表達,導致腫瘤預后不良[11-12]。CysC則是一種重要的蛋白酶抑制劑,這是因為該蛋白C端有2個二硫鍵,可抑制半胱酸蛋白酶B、H及L等,保護細胞免受異常蛋白酶水解,同時參與調控細胞內外其他蛋白酶表達[13-14]。研究顯示,半胱氨酸蛋白酶是CysC的主要底物,而半胱氨酸蛋白酶活性紊亂是腫瘤轉化的重要特征之一[15]。研究發現,CysC在惡性腫瘤細胞中過表達,抑制死亡細胞釋放蛋白酶導致不適當降解,調控組織蛋白活性,從而促進細胞增殖、轉移及侵襲等[16-17]。Zhang等[18]和Ohara等[19]學者發現結直腸癌和肺癌中均存在CysC高表達,但均未涉及其具體作用。
shRNA是目前成熟RNA干擾技術之一,已在生物學和醫學生物學等領域得到廣泛運用。本研究基于上述CysC在肺癌中的異常高表達,采用shRNA和慢病毒重組的方式敲低CysC,從而探討其對NSCLC的影響。本研究中熒光顯微鏡下GFP表達情況及CysCmRNA水平均提示CysC-shRNA和Ctr-shRNA設計良好,沉默效率較高,保證了后續實驗結果的真實性。后續研究結果均提示敲低CysC可明顯抑制NSCLC細胞增殖及集落形成能力,與Yan等[20]研究一致,即沉默CysC可在一定程度抑制食管癌細胞EC9706增殖。那CysC是如何發生作用的呢?本研究通過Western blot實驗發現敲低CysC后,NSCLC細胞PI3K和Akt蛋白水平明顯下降,提示下調CysC抑制NSCLC細胞增殖,與PI3K和Akt蛋白有關,PI3K和Akt是PI3K/Akt信號轉導通路的關鍵因子。PI3K/Akt信號轉導通路是PI3K/Akt信號轉導通路的關鍵因子,是大部分細胞生長因子的下游通路,在肺癌、卵巢癌等多種惡性腫瘤中表現活躍,幫助腫瘤細胞逃避免疫,促進增殖[21]。
綜上認為,靶向下調CysC可明顯抑制NSCLC細胞增殖,與PI3K/Akt信號通路相關。

