LAMC1在神經膠質瘤中的表達水平與臨床特征及預后的關系*
唐連剛,張乃崇,賴廷海
茂名市人民醫院神經外一科(廣東茂名 525000)
膠質瘤是最常見的腦腫瘤,約占原發性惡性腦腫瘤的80%,據世界衛生組織(WHO)的分類,膠質瘤可分為低級別膠質瘤(Ⅰ/Ⅱ級)和高級別膠質瘤(Ⅲ /Ⅳ級)[1]。Ⅰ/Ⅱ級星形細胞瘤是緩慢生長的腫瘤,沒有侵襲性特征,而Ⅲ /Ⅳ級膠質瘤表現出與高增殖活性,強侵襲能力和新生血管形成相關的惡性表型。雖然在過去的幾十年中膠質瘤治療取得了不少的進展,但其臨床效果仍不太理想[2]。研究[3]表明,膠質母細胞瘤(GBM,Ⅳ級)的中位生存時間在診斷后持續不到15個月。雖然近年來對膠質瘤中癌基因和腫瘤抑制因子進行了不少的研究,單膠質瘤的發生和發展的分子機制仍未完全明確。基底膜是細胞黏附的細胞外基質,其將神經元、神經膠質、上皮細胞、內皮細胞和來自相鄰結締組織的其他細胞分開。基底膜為細胞提供物理屏障,有助于細胞黏附、增殖、遷移和存活[4]。基底膜的主要結構組分包括層粘連蛋白(laminin)、Ⅳ型膠原、硫酸乙酰肝素蛋白聚糖perlecan和集聚蛋白,層粘連蛋白是異源三聚體家族,各自由α、αβ和αγ亞基組成[5]。目前已經鑒定了5個α,4個β和3個γ亞基鏈。這些亞基的不同組合組裝了16種不同的哺乳動物層粘連蛋白同種型。層粘連蛋白γ1(Laminin subunit gamma-1,LAMC1)由LAMC1基因合成,其在早期和晚期細胞形態發生中起重要作用[6]。LAMC1的C-末端層粘連蛋白型球狀結構域是位于α-亞基C-末端的主要受體結合結構域,其與整聯蛋白、α-肌萎縮蛋白、肝素的硫酸化相互作用,通過N-末端LN結構域的相互作用進行聚合[7]。LAMC1在層粘連蛋白亞基中廣泛表達,主要在基底膜中發現,腦膜瘤中上調的LAMC1表達與腫瘤復發呈正相關[8]。研究[9]表明,上調的LAMC1可能促進腫瘤轉移,因此LAMC1可能是治療人類癌癥的重要治療靶點。但目前LAMC1在神經膠質瘤中的表達水平與臨床特征,以及其對患者預后的影響仍未明確。本研究旨在探討LAMC1在神經膠質瘤中表達及與臨床特征的關系。
1 資料與方法
1.1 一般資料 選取2014年6月至2018年2月因神經膠質瘤于我院行手術治療患者共68例的病理組織石蠟塊資料,納入標準:(1)術后病理確診為神經膠質瘤;(2)患者臨床資料和隨訪資料完整;(3)術前未進行放療、化療和靶向治療;排除合并免疫性疾病,以及合并其他腫瘤或其他腫瘤腦轉移的患者;另外10例正常腦組織標本來自患有創傷性腦損傷且經內部減壓手術治療的患者。本研究獲得醫院倫理委員會審核并批準。68例神經膠質瘤患者中男41例,女27例,確診時平均年齡(42.3±5.7)歲,范圍26~64歲,根據WHO 中樞神經系統腫瘤分類標準,其中Ⅰ級9例,Ⅱ級18例,Ⅲ級21例,Ⅳ級20例。
1.2 臨床標本收集和免疫組化 免疫組化染色檢測均由我院病理科醫師進行,所有的神經膠質瘤或正常腦組織常規固定在10%中性緩沖甲醛溶液,并進行常規石蠟包埋。將石蠟包埋的神經膠質瘤或正常腦組織切成5 μm進行制片。在二甲苯中脫蠟并再水合后,用3%H2O2孵育將切片用過氧化物酶封閉,在1 mmol/L乙二胺四乙酸中進行微波加熱抗原修復。使用5%胎牛血清(FBS)來阻斷非特異性結合位點。然后,將切片與第一抗體孵育,大鼠抗LAMC1單克隆抗體(anti-LAMC1,ab80580,Abcam,Cambridge,UK)在4℃孵育過夜。在第一抗體反應后,將樣品與HRP標記的山羊抗鼠二抗室溫孵育30 min。并使用過氧化物酶底物進行可視化,未與一抗孵育的切片用作陰性對照。由本院2名病理科醫師每個切片隨機選擇5個視野(×200)拍照后進行后續分析。
1.3 免疫組化評估 通過Image-Proplus 6.0軟件通過每張測量組織照片中神經膠質瘤組織和正常腦組織的LAMC1表達水平。先采用軟件對照片進行校正光密度,再根據免疫組化染色選擇特定染色物的顏色,采用平均光密度評估LAMC1的表達水平,具體先測量一下有效測量區域的面積,再測量這個面積范圍內目標染色區域的累積光密度值IOD,兩者相除得到mean density。通過68例神經膠質瘤組織的LAMC1的表達水平取通過取中位數作為cut-off值區分為LAMC1高表達和LAMC1低表達。
1.4 臨床資料收集和隨訪 通過患者病例資料查找納入研究患者的年齡、性別、腫瘤大小、腫瘤周圍水腫情況、患者術后復發情況、IDH1基因突變情況,記錄所有神經膠質瘤患者的臨床WHO分期。所有患者通過電話和網絡隨訪記錄患者的生存時間和復發情況。
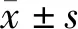
2 結果
2.1 LAMC1在神經膠質瘤組織中的表達情況 LAMC1在正常腦組織和神經膠質瘤組織的表達情況如圖1所示,其中神經膠質瘤組織的平均LAMC1表達水平為0.672±0.094,正常腦組織的平均LAMC1表達水平為0.132±0.041,神經膠質瘤組織的LAMC1表達水平顯著高于正常腦組織,差異有統計學意義(P<0.001)。
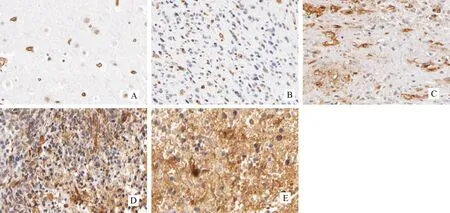
注:A:正常腦組織中LAMC1的表達;B:WHO分級為Ⅰ級的神經膠質瘤組織LAMC1表達;C:WHO分級為Ⅱ級的神經膠質瘤組織LAMC1表達;D:WHO分級為Ⅲ級的神經膠質瘤組織LAMC1表達;E:WHO分級為Ⅳ級的神經膠質瘤組織LAMC1表達
2.2 LAMC1在神經膠質瘤組織表達與臨床特征的關系 其中神經膠質瘤組織中LAMC1表達水平與患者的性別、年齡、腫瘤大小、腫瘤周圍水腫和IDH1突變沒有顯著的相關性(P>0.05),而LAMC1在WHO分期為Ⅲ~Ⅳ期高表達的比例顯著高于Ⅰ~Ⅱ期(P<0.05),且術后復發的患者其LAMC1高表達的比例顯著高于術后未復發的患者(P<0.05),見表1。
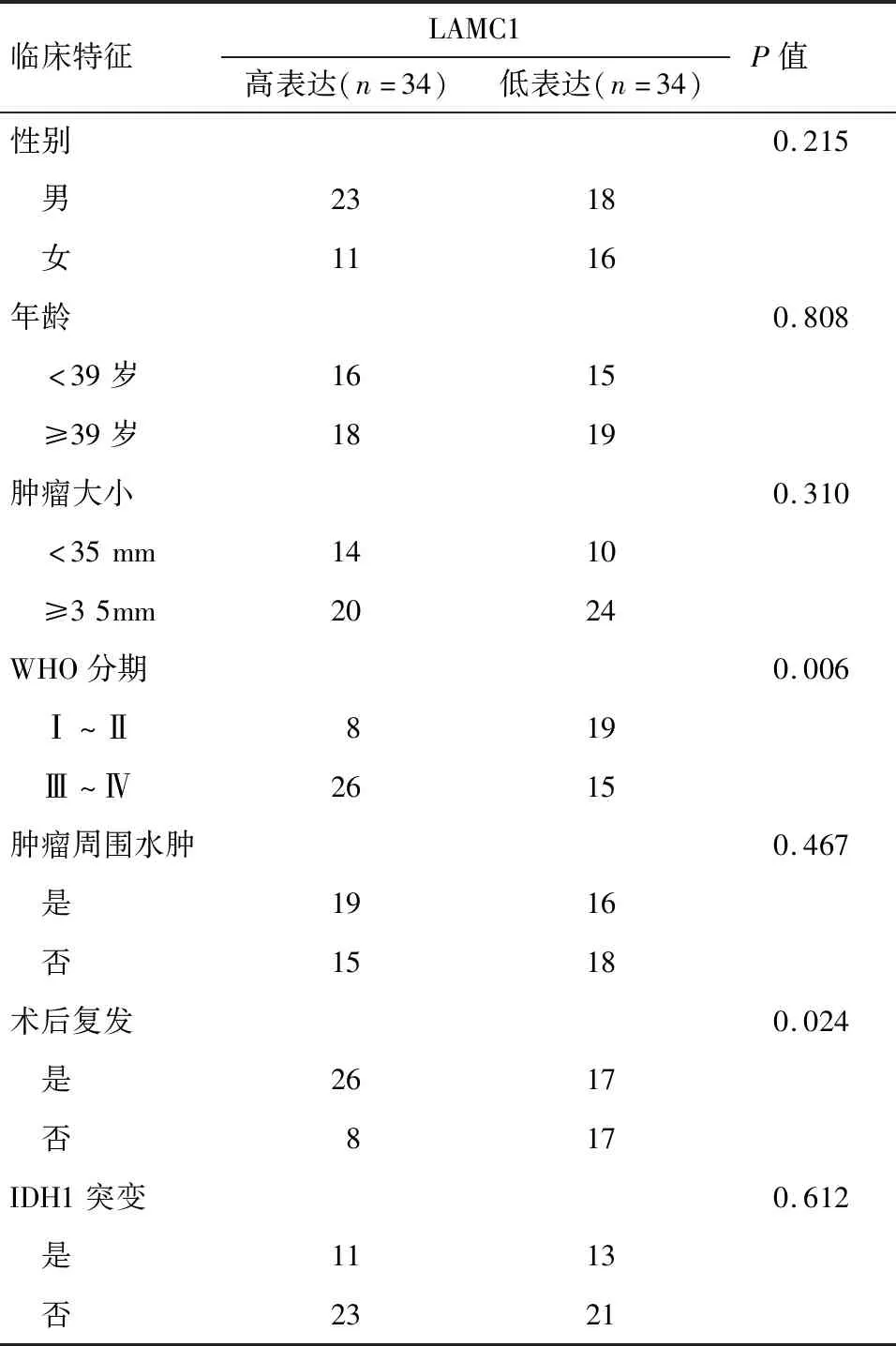
表1 LAMC1在神經膠質瘤組織表達與臨床特征的關系(n=68) 例
2.3 LAMC1在神經膠質瘤組織表達與預后的關系 68例神經膠質瘤患者的隨訪時間為5~36個月,中位隨訪時間為19個月,其中神經膠質瘤組織中LAMC1高表達的患者其總體生存率顯著低于LAMC1低表達的患者,差異有統計學意義(HR=2.035,95%CI:1.113~3.723,P=0.021),見圖2。
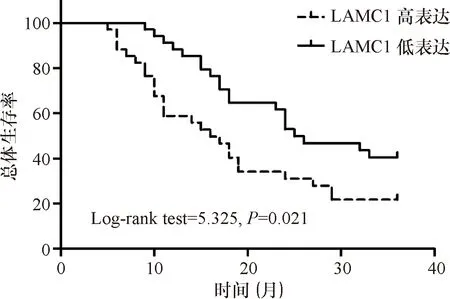
圖2 神經膠質瘤組織的LAMC1表達水平對患者總體生存率的影響
2.4 LAMC1表達與神經膠質瘤臨床預后的多元Cox回歸分析 綜合68例患者的臨床特征進行Cox 多因素分析,結果顯示LAMC1高表達(HR=1.952,95%CI:1.106~2.354,P=0.017)、腫瘤大小≥35 mm、WHO分期為Ⅲ~Ⅳ期、術后復發和合并IDH1突變是影響神經膠質瘤臨床預后的風險因素(P<0.05),見表2。
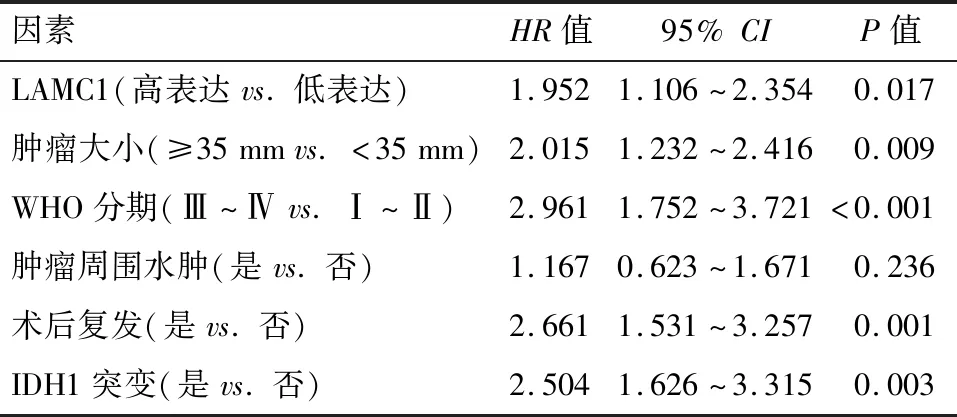
表2 乳腺癌患者COX多因素生存分析 (n=68)
3 討論
膠質瘤是成人中最常見的原發性中樞神經系統腫瘤,并且其腫瘤存在高度異質性和預后不良。盡管結合手術切除、放療和化療的療法取得了一定的進展,膠質瘤仍是最致命的人類癌癥之一,不到5%的患者存活超過5年[10]。目前膠質瘤其具體的分子機制仍未明確,找到膠質瘤的有效治療靶點仍是目前研究的重點。LAMC1是一種對基底膜組裝必不可少的蛋白質,既往報道層粘連蛋白在腫瘤組織中對組織發育、腫瘤細胞侵襲和轉移具有重要作用[11]。層粘連蛋白存在于細胞外基質和細胞膜中,作為檢測的潛在生物標志物。目前LAMC1在膠質瘤中的表達水平及對臨床預后的影響仍未明確。本研究中首次通過組織學檢測了LAMC1在膠質瘤組織中的表達和臨床意義。本研究結果初步表明,在膠質瘤組織中LAMC1的蛋白質表達水平顯著增高,且LAMC1表達水平與WHO分期、術后復發和預后密切相關,表明了LAMC1是影響膠質瘤患者預后的風險因素。
LAMC1編碼層粘連蛋白γ1鏈,其是層粘連蛋白最常見的γ亞基,并參與各種惡性腫瘤的病情進展。本研究中,LAMC1其在膠質瘤中表達水平顯著升高,且與WHO分期密切相關,表明了LAMC1的表達水平隨著腫瘤的惡性程度增加而增高。最近研究[12]證實LAMC1在宮頸癌中上調,其表達與FIGO分期、子宮肌層浸潤、頸/附件受累、血管淋巴管浸潤和淋巴結轉移顯著相關。對247例肝細胞癌患者的轉錄組數據集進行無偏隨機存活森林分析,發現LAMC1表達上調與晚期腫瘤分期呈正相關,LAMC1高表達的患者總體無腫瘤存活率較低[13]。通過微陣列分析研究多發性骨髓瘤,不同類型發現細胞外基質含量在不同的RPMI-8226抗藥性亞系中有所改變,LAMC1基因在潑尼松耐藥亞系中大量過表達[14]。且LAMC1與子宮癌的不同亞型及其臨床分期有關,與正常增殖和分泌性子宮內膜相比,其中LAMC1幾乎檢測不到,在從非典型增生到低級別和高級別子宮內膜樣癌的上皮細胞中觀察到LAMC1表達增加[15]。
本研究也明確了LAMC1高表達的膠質瘤患者其臨床預后不良,且LAMC1是影響膠質瘤患者其臨床預后的風險因素。盡管LAMC1在腫瘤中具有明確的生物學意義,但其異常表達的調節機制及其功能背后的機制仍有待研究。既往研究[16]miRNA在調控LAMC1的表達中具有重要的作用,在前列腺癌中,LAMC1是miR-29s的直接靶標。而在人肝細胞癌中,SP1反式激活LAMC1啟動子,LAMC1的表達受到Wnt信號通路的調節[17]。此外,PI3K/AKT、NF-κB和JAK/STAT3信號通路可能與COL1A1介導的侵襲密切相關[18]。這些研究為LAMC1在膠質瘤細胞中的調控機制提供了新的研究方向。
綜合上述,本研究結果初步表明了LAMC1在神經膠質瘤中表達水平顯著增高,且與膠質瘤的WHO分期及臨床預后密切相關。對于LAMC1在神經膠質瘤中的具體調控機制仍需要進一步深入研究。

