牛瘤胃纖維素酶eg 基因在乳酸菌中的克隆表達及酶學性質分析
鄒愛愛,魏亞琴,楊宇澤,曹 磊,孫康永杰,萬學瑞,王 川
(1.甘肅農業大學動物醫學院, 甘肅 蘭州 730070;2.甘肅省科學院生物研究所/甘肅省微生物資源開發利用重點實驗室 / 厭氧微生物中心, 甘肅 蘭州 730000;3.北京市畜牧總站,北京 100107)
纖維素(cellulose)是植物細胞壁的主要成分,木質纖維素生物質包括農作物和森林殘留物,是地球上最豐富的生物質資源[1]。隨著我國畜牧業的發展,農作物秸稈等的纖維素產量越來越多,為緩解環境污染和促進能源循環利用,纖維素的生物降解現在已經開始被廣泛研究。相比于化學和物理方法降解纖維素,生物降解法更加環保和高效,纖維素酶在生物降解利用纖維素的過程中起著關鍵作用[2]。牛瘤胃液中的微生物能分泌出活性較高的纖維素酶[3]。纖維素酶是纖維素降解的基礎生物酶,主要由外切β-葡聚糖酶(1, 4-β-D-glucan cellobilhydrolase,EC 3.2.1.91)、β-葡 萄 糖 苷 酶(β-1, 4-glucosidase, EC 3.2.1.21, BG)和 內 切β-葡 聚 糖 酶(1, 4-β-D-glucan glucanohydrolase, EC 3.2.1.4)組成[4]。由eg基因所編碼的內切葡聚糖酶作為纖維素酶系的主要成分,其結構包括纖維素結合結構域(cellulose binding domain)、連接橋(linker)和催化結構域(catalytic domain),這3 種結構在纖維素降解中起著至關重要的作用[5],該酶通過切割纖維素分子內部的非結晶隨機水解β-1, 4糖苷鍵,將長鏈的纖維素分子截斷,產生大量含非還原性末端的小分子纖維素,之后在外切葡聚糖酶(由cbh基因編碼)和β-葡萄糖苷酶(BG)的共同作用下將纖維素徹底降解成葡萄糖[6],從而實現纖維素的徹底降解,目前纖維素酶已被廣泛用于許多工業領域[7]。
目前,常見內切葡聚糖酶基因的表達系統有原核和真核表達系統,其中大腸桿菌(Escherichia coli)表達系統具有價格低廉、生長速度快、培養要求簡單、重組子穩定等的優勢,在科研中得到廣泛的應用[8]。但大腸桿菌表達系統存在著表達的蛋白常以包涵體的形式出現,導致蛋白純化困難和活性降低等一些問題[9]。乳酸菌為一種兼性厭氧菌,在厭氧環境下可以大量繁殖,它們產生的乳酸會導致生存環境中的pH 下降從而阻斷有害細菌的生長,將乳酸菌添加至飼料中可以提高飼料的營養價值,同時也可以防止飼料腐敗變質[10]。作為食品級的菌株,具有GRAS (generally recognized as safe)認證資格[10],可被用作表達異源基因和抗原的遞送載體,并且在蛋白表達過程中不以包涵體的形式出現[11]。科研中常利用乳酸菌構建的基因工程菌株在活菌疫苗、活性酶、細胞因子以及各種蛋白和多肽類等生產領域中顯現出獨特的優勢和應用價值[12]。為獲得高產重組內切葡聚糖酶的乳酸菌,本研究通過提取牛瘤胃液全基因組作為模板,克隆纖維素酶eg基因,構建原核表達載體,在乳酸菌中表達內切葡聚糖酶,該工程菌株的構建為重組內切葡聚糖酶乳酸菌在飼料工業上的開發及利用提供了參考。
1 材料與方法
1.1 材料
1.1.1 試驗材料
乳酸菌(L.lactisNZ9000)、大腸桿菌(E.coliDH5α)、載體pMG36e 均為甘肅農業大學動物醫學院微生物實驗室保藏;牛瘤胃液(插管抽取)來源于天祝縣某養殖場雄性黃牛。
1.1.2 培養基
LB 液體培養基:胰蛋白胨10 g,酵母提取物5 g,氯化鈉10 g,加水定容至1 L,121 ℃高壓滅菌30 min;LB 固體培養基添加16 g 瓊脂粉。GM17 液體培養基:胰蛋白胨5 g,大豆蛋白胨5 g,牛肉膏5 g,酵母粉2.5 g,葡萄糖5 g,蔗糖171 g,MgSO4·7H2O 0.25 g,β-磷酸甘油二鈉(索萊寶公司) 19 g,加水至1 L,115 ℃高壓滅菌20 min;GM17 固體培養基加16 g 瓊脂粉。GM17-CMC-Na 固體培養基:在1 L 的GM17 固體培養基中加入10 g 羧甲基纖維素鈉(carboxymethylcellulose sodium,CMC-Na,來源于索萊寶公司),邊加熱邊攪拌,待CMC-Na 溶解后,115 ℃滅菌20 min,用于剛果紅染色。
1.2 試驗方法
1.2.1 牛瘤胃液微生物全基因組的提取及eg基因的克隆及序列分析
采用十六烷基三甲基溴化銨(hexadecyl trimethyl ammonium bromide, CTAB)法提取牛瘤胃液微生物全基因組[13]。根據美國國家生物技術信息中心(National Center for Biotechnology Information, NCBI)數據庫公布的芽孢桿菌屬的內切纖維素酶序列設計引物,采用DNAStar7.1 生物學軟件設計引物:F:5’ -CGAGCAAGAAGGAGATATACATGCAAAAAA AAGATTATCTCAGCTAATGAAACGGTCAATCTCT AA-3’(下劃線為SacⅠ的酶切位點,波浪線為添加的信號肽序列),R:5’-GCTCTAGACTAATTTGGTTC TGTTCCCCA-3’(下劃線為XbaⅠ的酶切位點),將擴增出的eg基因與pMD-18T 質粒連接后送至天津金唯智公司測序后進行Blast 比對并下載同源性相近的序列構建系統發育進化樹。以牛瘤胃液微生物全基因組為模板用Taq 酶(諾唯贊有限公司)擴增目的基因eg,PCR 反應體系為94 ℃ 預變性5 min,94 ℃變性30 s,56 ℃ 退火30 s,72 ℃ 延伸90 s,35 個循環,72 ℃ 延伸10 min;PCR 產物通過1%瓊脂糖凝膠進行電泳檢測,并用DNA 純化回收試劑盒(北京天根生化科技有限公司)回收。
1.2.2 重組表達質粒的構建
使用兩種內切酶SacⅠ和XbaⅠ (TaKaRa 公司)在37 ℃同時酶切eg基因和載體pMG36e 1 h,用T4 DNA 連接酶(Thermo Fisher 公司) 22 ℃過夜連接后轉化至大腸桿菌E.coliDH5α 感受態細胞,挑取單克隆菌落進行菌液PCR 和提取質粒后用SacⅠ和XbaⅠ雙酶切驗證,酶切驗證正確后并送至金唯智公司進行測序分析。
1.2.3 重組質粒轉化乳酸菌及陽性轉化子的篩選
挑取劃線培養的乳酸菌NZ9000 單菌落接種于5 mL GM17 液體培養基中,30 ℃靜止培養2 d,然后參照Holo 和Nes[14]的方法制作乳酸菌的感受態細胞,取測序正確的重組質粒DNA 1 μL (100 ng·uL-1)加入到10 μL 的感受態細胞中混合均勻后轉移至預冷的電擊杯中,電擊條件為2 200 V,200 Ω,25 μF,菌液復蘇3~4 h 后,涂布于GM17 (含2.5 μg·mL-1紅霉素)的固體平板上,置于30 ℃培養48 h 后,挑取GM17 平板上的單個菌落,將菌液煮沸10 min 后進行PCR 驗證,驗證正確的重組乳酸菌NZ9000 用于后續試驗。
1.2.4 重組質粒在乳酸菌中的表達
取驗證正確的菌液按1 ∶ 100 的比例接種在GM17培養液中30 ℃靜止培養48 h 后,將菌液在4 ℃、12 000 r·min-1條件下離心10 min,取發酵上清液用預冷的10% TCA/丙酮沉淀蛋白質,-20 ℃放置3 h 后于4 ℃、12 000 r·min-1離心10 min,用預冷的丙酮洗滌沉淀2 次,室溫放置30 min,晾干徹底去除丙酮后加入1 mL ddH2O 溶解沉淀,分別將重組乳酸菌的菌液、培養液的上清液、菌體超聲破碎后的沉淀及重組蛋白和空質粒重組菌的菌液、培養液的上清液、菌體超聲破碎后的沉淀制樣后進行SDS-PAGE 檢測。
1.2.5 重組內切葡聚糖酶的酶活檢測
采用剛果紅(索萊寶公司)染色法檢測該蛋白酶有無活性[15],用DNS 法測出重組內切葡聚糖酶OD550nm值(分光光度計)并計算出酶活值[16],試驗組為重組乳酸菌發酵上清液濃縮蛋白,對照組為空質粒重組菌發酵上清液的濃縮蛋白,使用濾紙酶活力(FPA)法檢測總酶活[17],利用剛果紅染色法觀察水解圈及其直徑大小。
1.2.6 重組內切葡聚糖酶酶學性質初步研究
最適反應pH:在50 ℃的條件下,以1%羧甲基纖維素鈉(CMC-Na)作為底物,溶解在磷酸鹽緩沖液(購于索萊寶公司)中,在pH 4、5、6、7、8、9、10 的條件下用DNS 法測定重組內切葡聚糖酶酶活值并計算出相對酶活力,最高酶活值記為100%[16]。
最適反應溫度:在pH 為6 的條件下,設置30、50、60、70、90 ℃的溫度梯度,以1% CMC-Na 為底物,溶解在磷酸鹽緩沖液中,用DNS 法在各溫度下測定重組蛋白的酶活力,最高酶活力記為100%[16]。
底物水解能力分析:在pH 為6、反應溫度為50 ℃的條件下分別以CMC-Na、濾紙(FPA)、脫脂棉、微晶纖維素(Avicel)為底物,溶解在磷酸鹽緩沖液中,用DNS 法測定重組蛋白酶活力,分析重組EG 蛋白對不同底物的水解能力[16]。
不同金屬離子對重組內切葡聚糖酶活性的影響:在pH 為6、反應溫度為50 ℃的條件下,以1% CMC-Na為底物,溶解在磷酸鹽緩沖液中,反應體系中添加5 mmol·L-1的 金 屬 離 子(BaCl2、CaCl2、NaCl、HgCl2、FeCl2、MgCl2、MnCl2、CoCl2、ZnCl2、CuCl2、KCl),用DNS 法測定重組內切葡聚糖的酶活力,同時以未加金屬離子的重組乳酸菌粗酶液作為對照組,其酶活力計為100%,以此確定各種金屬離子對重組內切葡聚糖酶酶活的影響[16]。
1.3 數據分析
將以上數據用SPSS 19.0 軟件的ANOVA 進行單因素方差分析,并用Duncan 法進行多重比較后,用Graph Prism 8.0 軟件繪制折線圖和柱狀圖。
2 結果與分析
2.1 eg 基因的克隆及表達載體構建
經PCR 擴增和核苷酸序列測定后可知該基因大小為1 500 bp (圖1);在NCBI 上通過Blast 進行同源性比對,發現該基因序列與枯草芽孢桿菌(Bacillussubtilisstrain SRCM102748)的eg基因相似性達100%;根據基因序列通過MEGA 7.0 軟件構建系統進化樹(圖2),發現試驗所擴增的eg序列是來自Bacillussubtilisstrain SRCM102748 菌 株(登 錄 號 為CP028212.1)。分別用SacⅠ和XbaⅠ內切酶同時酶切重組質粒pMG36e::eg和pMG36e 空質粒進行驗證,pMG36e::eg質粒切出大小為1 500 bp 左右的條帶(圖1),獲得的基因片段大小與預期大小相符,表明表達載體pMG36e::eg構建成功。
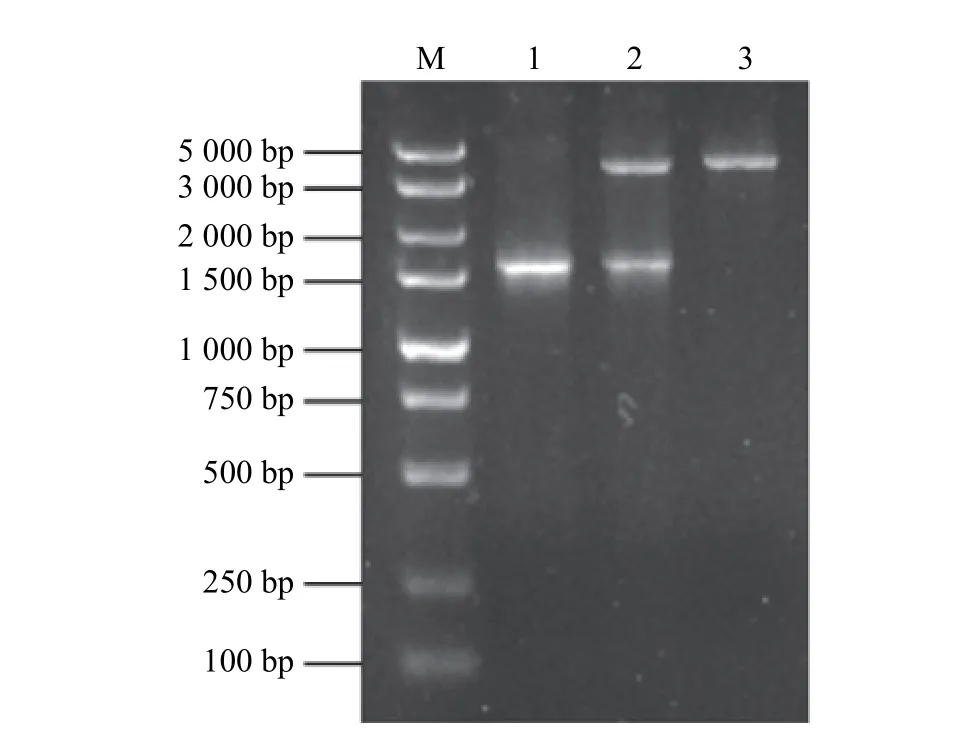
圖1 目的基因的PCR 擴增產物及重組質粒雙酶切鑒定Figure 1 PCR amplification products of the target gene and identification of the recombinant plasmid bydouble enzyme digestion
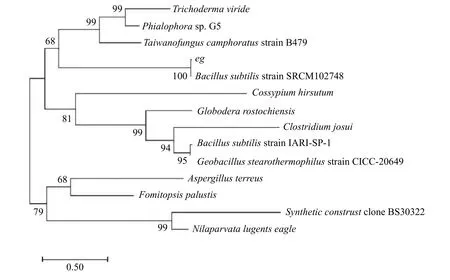
圖2 eg 序列系統發育樹Figure 2 A phylogenetic tree of the eg gene in different microbial species
2.2 eg 基因在乳酸菌中表達的SDS-PAGE 分析
通過10% TCA/丙酮沉淀法濃縮重組乳酸菌發酵上清液中的蛋白后,將重組乳酸菌的菌液、培養液的上清液、菌體超聲破碎后的沉淀及空質粒重組菌的菌液、培養液的上清液和菌體超聲破碎后的沉淀分別制樣進行SDS-PAGE 分析,結果表明:空質粒重組菌的菌液、上清液和沉淀均無目的蛋白出現,而重組乳酸菌培養液的上清液濃縮蛋白在50 kDa附近有明顯的條帶(圖3),表明有目的蛋白表達。
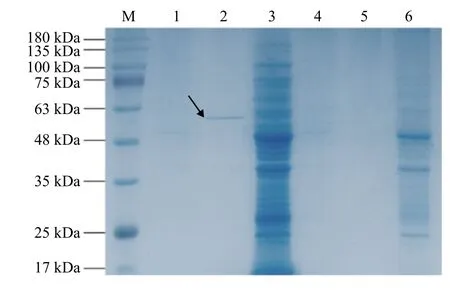
圖3 SDS-PAGE 電泳Figure 3 SDS-PAGE electrophoresis
2.3 重組內切葡聚糖酶酶活力的測定
2.3.1 DNS 法和濾紙法測定重組內切葡聚糖酶的酶活力
用DNS 法測得內切葡聚糖酶酶活為12.401 9 U·mL-1,濾紙法測得總酶活為12.246 9 U·mL-1,通過SPSS 19.0 軟件分析比較重組內切葡聚糖酶和對照組酶活力值發現,試驗組顯著高于對照組酶活(P<0.05) (表1),說明該酶具有良好的酶活性。
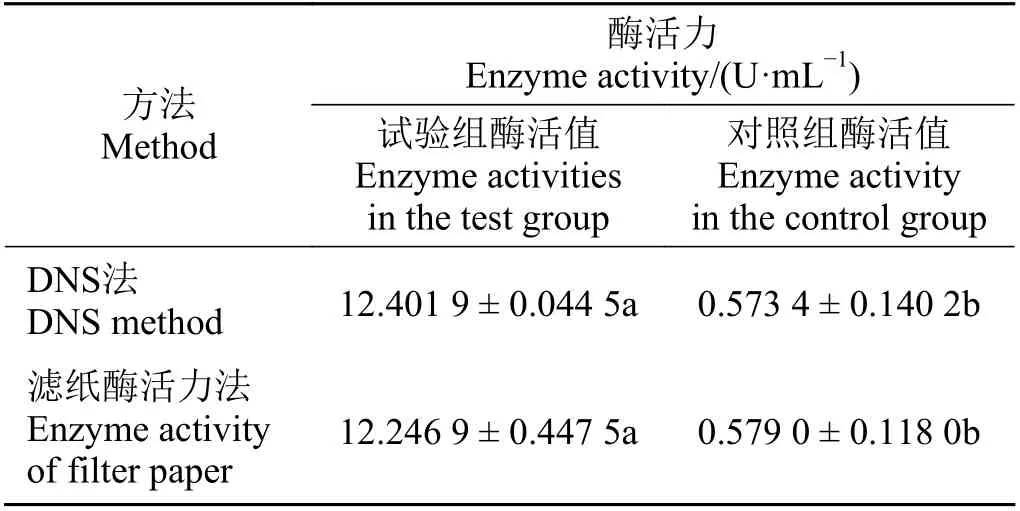
表1 二硝基水楊酸法和濾紙法測定酶活力值Table 1 Determination of enzyme activity using the 3,5-dinitrosalicylic acid (DNS) and filter paper methods
2.3.2 重組內切葡聚糖酶剛果紅染色
分別將經SDS-PAGE 分析的樣品和ddH2O 作為空白對照加入GM17-CMC-Na 固體培養基中30 ℃孵育反應12 h 后,發現空質粒pMG36e 重組菌的菌液、培養液的上清液、菌體破碎后的沉淀和ddH2O空白對照均無水解圈,但重組菌培養液的上清液和重組蛋白酶出現明顯的水解圈,直徑分別為1.98 和2.32 cm (圖4),說明該蛋白為分泌型表達且具有酶活力。
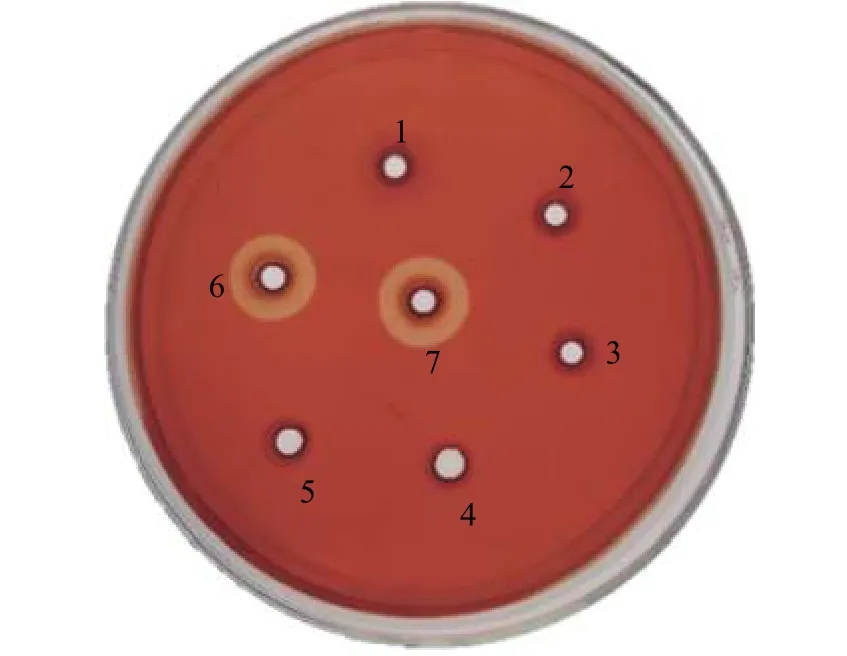
圖4 剛果紅染色水解圈Figure 4 Congo red stain zones of hydrolysis
2.3.3 重組內切葡聚糖酶的酶學性質分析
以CMC-Na 為底物測定重組內切葡聚糖酶在不同pH 下的酶活,結果顯示最適反應pH 為6;在pH為5~7 時耐受性良好;在反應pH 低于5 時,酶活性降到很低(圖5A)。因此在研究重組蛋白酶的最適反應溫度、不同底物的水解能力、不同金屬離子對重組蛋白影響的試驗中反應pH 均為6。
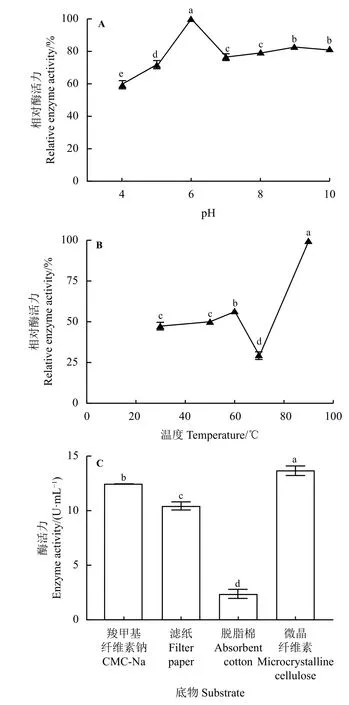
圖5 重組內切葡聚糖酶酶學性質分析Figure 5 Analysis of the enzymatic properties of the recombinant endoglucanase
重組內切葡聚糖酶以CMC-Na 為底物,在反應pH 為6 的條件下,當反應溫度低于70 ℃時,相對酶活力均低于60%,之后隨著溫度不斷升高,酶活力也不斷升高,當溫度達90 ℃時重組內切葡聚糖酶的酶活值達到最高,最適反應溫度為90 ℃(圖5B)。
重組內切葡聚糖酶以CMC-Na、微晶纖維素、濾紙、脫脂棉為底物時均有一定酶活力,但以脫脂棉為底物時酶活力利用能力最低(圖5C)。
重組內切葡聚糖酶以CMC-Na 為底物,在反應pH 為6、溫度為50 ℃的條件下,Cu2+、Mn2+、Ba2+、Zn2+、Co2+、Hg2+、K+等均可以提高重組酶的酶活力,而Fe2+抑制重組內切葡聚糖酶的酶活力(表2)。
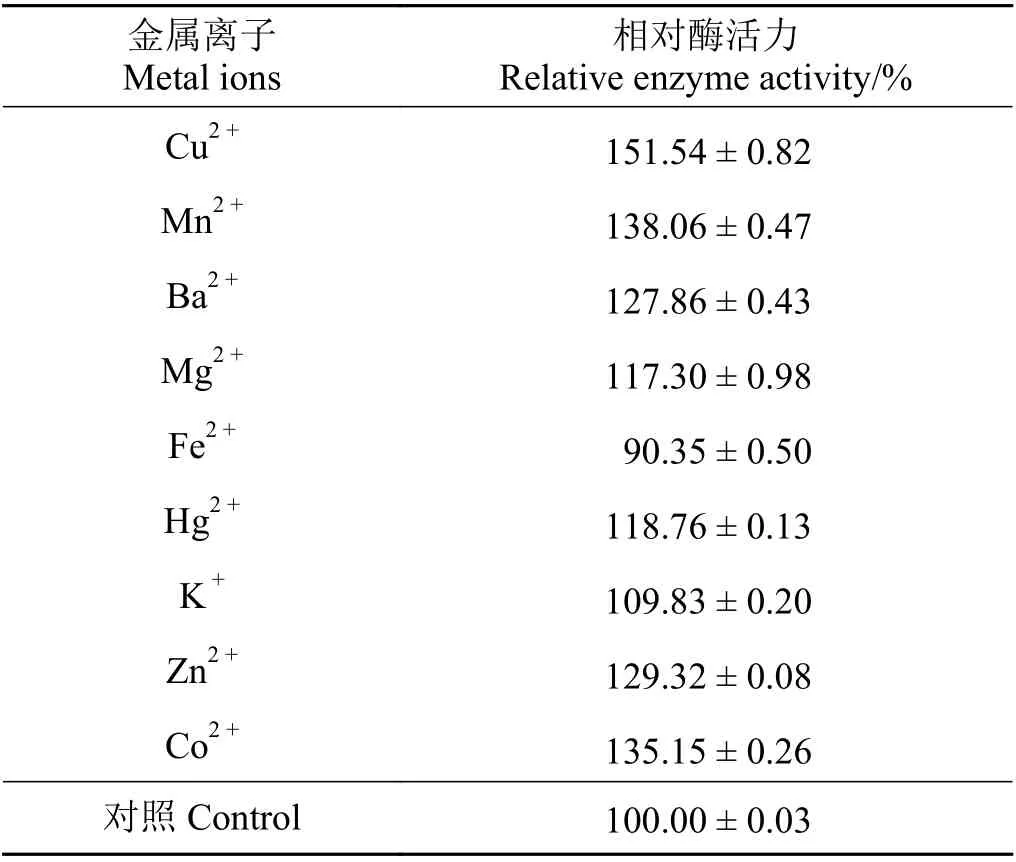
表2 各種金屬離子對重組內切葡聚糖酶相對酶活力的影響Table 2 Effects of different metal ions on the relative enzyme activity of the recombinant endoglucanase
3 討論
研究表明補充酶制劑可提高反芻動物的飼料利用效率,減輕環境污染并控制某些疾病[18]。據報道瘤胃微生物產生的纖維素酶是迄今為止最活躍的酶之一[19],其中瘤胃中的芽孢桿菌(Bacillus)可分泌多種纖維素酶和淀粉酶,本研究成功地克隆到Bacillus的纖維素酶eg基因并在乳酸菌中完成了表達。但因自然來源Bacillus所產內切葡聚糖酶產量低、活性低、難回收等問題,可將內切葡聚糖酶基因在外源宿主中表達來解決這一問題。大腸桿菌表達系統因細胞快速生長、廉價的培養基和相對簡單的培養方法等優點在科研中得到廣泛應用。湯斌等[20]在大腸桿菌系統中表達了eg2基因,酶活值為1.321 U·mL-1,但蛋白不能分泌至胞外;寶力德等[21]通過在大腸桿菌中克隆表達枯草芽孢桿菌(Bacillus subtilis)的eg基因,酶活力值達683 U·L-1,大多蛋白為包涵體表達。劉原子等[22]擴增出多粘類芽孢桿菌(Paenibacillus polymyxa)eg基因,并在大腸桿菌中表達,測得酶活值為2.427 U·mL-1。雖然在該系統中可表達出重組內切葡聚糖酶,然而一些報告描述了重組蛋白在大腸桿菌表達系統中不能正確折疊且純化困難,可能會產生非功能性蛋白質[23],且大腸桿菌易引起動物機體損傷(如腹瀉等),不易達到食品級的標準而難以滿足工業生產需求。乳酸菌作為食品級的菌株,在蛋白表達過程中不以包涵體的形式出現,科研中常利用乳酸菌作為宿主細胞已成功表達出各種外源蛋白。Ozkose 等[24]克隆了來源于牛瘤胃厭氧真菌的Neocallimastixsp.的纖維素酶基因并在乳酸菌中完成表達,并將該重組蛋白酶添加至青貯飼料發現可提高纖維素的降解率。乳酸菌表達系統L.lactisNZ9000 是食品級安全表達系統且已被廣泛應用,本研究所用質粒pMG36e 來源于pWV01 載體,該載體的強啟動子p32 具有可供多種細菌識別的核糖體位點可供表達蛋白,該質粒大小約為3 600 bp,方便宿主菌攜帶[25]已在細菌表達系統中成功表達出各種酶[26-28]。王翠艷等[29]通過克隆綠色木霉(Trichoderma viride)纖維二糖水解酶基因cbhⅡ并利用質粒pMG36e完成在乳酸菌中的表達,測得重組蛋白酶活值達16.7 U·mL-1。本研究設計引物時在引物上游添加了一段信號肽序列,該段序列在基因表達過程中可引導蛋白向胞外持續分泌,實現高表達,將已克隆得到的eg基因序列連接表達質粒pMG36e 后電轉至乳酸菌中,成功分泌表達出內切葡聚糖酶,蛋白分子大小為50 kDa 左右,與預期大小相符,1%羥甲基纖維素鈉GM17 培養基驗證時產生明顯的水解圈,說明成功構建了分泌型表達載體,該內切葡聚糖酶活力值為12.401 9 U·mL-1。而王瑾等[30]擴增出eg基因,并在乳酸菌中表達,但測得蛋白酶無活性。本研究獲得的內切葡聚糖酶的酶活與Nakazawa 等[31]測定的酶活相比,提高了24 倍,具有良好的酶活力。野生型的乳酸菌作為一類益生菌,是動物腸道的正常菌群,將其添加至飼料中可促進動物消化,提高動物免疫力,但無降解纖維素的能力[32]。謝驁李暢等[33]通過構建重組乳酸菌并將其添加至飼料中進行發酵,結果表明重組乳酸菌可對秸稈植物性飼料均發揮一定的降解作用。本研究所獲得的重組內切葡聚糖酶的最適反應pH 為6,在pH 為5~7時耐受性良好,pH 穩定性的結果高于在枯草芽孢桿菌IARI-SP-1 (Bacillus subtilisIARI-SP-1)、地衣芽孢桿菌AU01 (B.licheniformisAU01)、解淀粉芽孢桿菌DL-3 (B.amyloliquefaciensDL-3)等細菌上的報道[34-36];各種金屬離子對該重組內切葡聚糖酶的影響結果與朱涇等[37]試驗結果相一致;該重組蛋白酶對不同底物的水解能力結果與Hakamada 等[38]報道的在Bacillussp.KSM-S237 上的試驗結果相似;該重組內切葡聚糖酶的最適反應溫度可達90 ℃,是一種耐高溫酶,市場潛力巨大,可廣泛應用于多種耐高溫的工業生產中。
4 結論
本研究成功將來源于牛瘤胃微生物的內切葡聚糖酶在乳酸菌系統中進行了克隆和表達,成功構建了分泌型重組內切葡聚糖酶的乳酸菌,并進行了酶學性質分析。重組內切葡聚糖酶的分子量約為50 kDa,所用表達載體pMG36e 不需要添加誘導劑誘導,只需正常培養重組乳酸菌就可在培養基上清液中獲得持續分泌的內切葡聚糖酶,檢測到內切葡聚糖酶活力為12.401 9 U·mL-1;重組內切葡聚糖酶對CMC-Na、濾紙、微晶纖維素和脫脂棉均具有酶活力;最適反應溫度為90 ℃;最適反應pH 為6,在pH 5~7 內具有較好的pH 耐受性;Cu2+、Mn2+、Ba2+、Zn2+、Co2+等均可以提高重組蛋白的酶活力,而Fe2+抑制重組內切葡聚糖酶活力。甘肅農業大學動物醫學院微生物實驗室正在將該重組內切葡聚糖酶作為纖維素酶制劑進行青貯發酵試驗,將其添加至飼料中是否達到提高動物免疫力和飼料消化率的雙重效果,還需要進一步驗證。

