原發性肝癌的分層篩查與監測指南(2020版)
中華預防醫學會肝膽胰疾病預防與控制專業委員會, 中國研究型醫院學會肝病專業委員會,中華醫學會肝病學分會, 中華預防醫學會腫瘤預防與控制專業委員會感染性腫瘤防控學組
原發性肝癌簡稱肝癌,主要由起源于肝細胞的肝細胞癌、起源于肝內膽管細胞的肝內膽管癌(intrahepatic cholangiocarcinoma, ICC)和肝細胞膽管細胞混合癌(combined hepatocellular cholangiocarcinoma, CHC)組成[1],肝細胞癌占85%~90%。近年來,我國的肝癌診療技術取得了較大進步,但年齡標化后的患者總體5年凈生存率僅由2000年—2004年的11.7%提高到2010年—2014年的14.1%,未見顯著提高[2]。但是,接受根治性治療的巴塞羅那肝癌臨床分期(BCLC)0或A期肝癌患者,其5年總生存率可高達69.0%~86.2%,手術切除患者的5年總生存率為56.9%[3]。因此,科學地確定肝癌高危人群、制訂分層的監測方案,是早發現、早診斷和提高肝癌總體生存率最關鍵的環節。
新版的美國肝病學會(AASLD)[4]、歐洲肝病學會(EASL)[5]、韓國肝癌協會-韓國國家癌癥中心[6]、美國國立綜合癌癥網絡(NCCN)[7]、歐洲腫瘤內科學會[8]和亞太肝病學會(APASL)[9]的有關肝癌診治指南中,對肝癌高危人群的定義和篩查監測方案仍存在差異。2019年,國家衛生健康委員會(簡稱衛健委)更新了我國《原發性肝癌診療規范》[10],將慢性病毒性肝炎、酒精性及非酒精性肝炎和各種原因的肝硬化定義為肝癌高危人群,推薦腹部超聲檢查(ultrasonography,US)聯合血清AFP間隔6個月檢查1次,作為肝癌高危人群的監測方案。2014年日本肝病學會[11]將肝癌高危人群進行了分層,對于極高危人群采用AFP、異常凝血酶原(DCP)、甲胎蛋白異質體(AFP-L3)聯合US或增強CT或MRI,必要時同時采用兩種影像學方法,間隔3~4個月檢查1次的監測方案。BCLC A期肝癌占60%~65%,顯著高于全球早期肝癌診斷率的10%~30%[12],這說明分層監測的指導意見更有利于肝癌的早期診斷。
隨著肝病基礎與臨床流行病學研究的進展,人們對肝癌高危人群的認識有了越來越多的新證據。安全、有效的抗病毒藥物被廣泛應用,95%以上HCV被根除,80%~90%的HBV得到有效抑制,這些也導致肝癌風險人群的變遷。因此,中華預防醫學會肝膽胰疾病預防與控制專業委員會、中國研究型醫院學會肝病專業委員會、中華醫學會肝病學分會、中華預防醫學會腫瘤預防與控制專業委員會感染性腫瘤防控學組組織了國內肝病消化、肝臟外科、腫瘤介入、感染病及流行病學等領域的專家共同制訂本指南。本指南的制訂按照循證醫學依據和AGREEⅡ的標準[13],成立了指導組、撰寫組、討論組(包括通信專家)和證據評估組。本指南旨在醫院和社區人群中,篩查有確切病因的肝癌風險的患者,為科學地辨識肝癌高危人群及分層監測提供指導意見;幫助從事肝病或感染病、消化、肝臟外科、疾病預防與控制等專業的醫師,為肝癌高危人群的篩查與監測決策提供參考依據。指南不是強制性標準,不可能包括或解決肝癌高危人群篩查與監測中的所有問題。因此,醫師在面對某一患者時,可遵循本指南的原則,充分了解患者的病情特點和意愿,結合當地醫療資源和臨床實踐經驗,制訂合理的肝癌風險人群分層篩查與監測計劃。
指南中提及的證據和推薦意見基本按照GRADE系統(推薦分級的評估、制訂與評價)進行分級(表1)。

表1 GRADE系統循證醫學證據級別及推薦等級
1 篩查與監測的定義
肝癌的篩查與監測是一項國家公共衛生計劃。通過在社區或醫院人群中進行篩查,發現伴有肝癌風險的患者,并使患者加入到肝癌的終生監測計劃,實現肝癌的早診、早治,旨在降低肝癌相關死亡和總體肝病相關死亡[14]。
1.1 篩查 1951年美國慢性病協會正式推出了篩查的概念,即通過有效、簡便、經濟的檢查方法,將可能有病或缺陷但表面上看似健康或無癥狀的人,與那些無病的人區別開來。篩查既可以發現慢性病中的早期患者,又可辨識發生這些疾病的高危人群。按人群不同分為機會性篩查、目標人群篩查和群體普查3種。機會性篩查是個體主動或自愿到醫療機構進行相關疾病的檢查。目標人群篩查與群體普查是社區或單位有組織地為目標人群提供相關疾病的檢查。值得注意的是,篩查不等于診斷檢查。
1.2 監測 指連續、系統、隨時間縱向推移、定期對高危人群進行檢查。除篩查的指標外,對肝癌高危患者采用超聲造影、增強CT和/或MRI等影像學檢查,以便發現BCLC 0或A期的早期肝癌,也稱加強篩查[15]。監測包括被動監測和主動監測。
1.3 篩查與監測的傷害 篩查與監測存在多種類型的傷害,包括身體、高成本和心理等傷害。在一項單中心隊列研究[16]中,680例肝硬化患者接受了為期3年的肝細胞癌監測,27.5%患者報告了監測相關的身體傷害,其中,9.7%患者接受了多次增強CT或MRI檢查,0.4%接受了侵入性檢測。盡管US和AFP檢查對患者沒有直接的身體傷害,但與診斷相關的潛在傷害仍然存在。
2 肝癌病理學和癌前病變
根據病理學分類,肝癌分為肝細胞癌、ICC和CHC。由于導致肝細胞癌和ICC的發病機制和危險因素暴露等差異,不同國家和地區人群的肝癌病理學類型略有差異。ICC在歐美人群中的發病逐漸上升[17],我國肝細胞癌和ICC變化趨勢尚無確切的報道。我國國家癌癥中心報道了2172例患者的肝癌病理學類型,肝細胞癌約占83.9%,ICC約占11.0%[18]。由于缺乏特異性血清和組織標志物,早期肝癌與癌前病變或癌前疾病的診斷一直是臨床和病理科醫師爭論的難題[19]。肝癌的發生發展是一個多基因突變、多信號通路的癌變過程,大多遵循從慢性肝炎、肝硬化、肝硬化增生結節、低級別不典型增生結節(low-grade dysplastic nodules,LGDN)、高級別不典型增生結節(high-grade dysplastic nodules,HGDN)、早早期肝癌、早期肝癌、進展期肝癌這一過程,這是一個多步驟從分子到臨床的演變過程[20]。日本學者[21]研究顯示,肝硬化增生結節進展為肝癌的1、3、5年累積發生率分別為3.3%、9.7%和12.4%,LGDN(稱為癌前病變)進展為肝癌的1、3、5年累積發生率分別為2.6%、30.2%和36.6%,HGDN(稱為癌前病變)進展為肝癌的1、3、5年累積發生率分別為46.2%、61.5%和80.8%。另外,肝癌也呈現腫瘤大小(通常認為截點值為2 cm)隨時間倍增的生長規律[22]。因此,在監測<2 cm的肝癌前病變或癌前疾病中,臨床上有足夠的機會與肝癌進行鑒別,以實現肝癌早期診斷和治療的目標。因此,加強對肝癌前疾病及癌前病變的認識,對于精準辨識肝癌高危人群和早期肝癌診斷意義重大。
3 流行病學及疾病負擔
85%~95%的肝癌發生在肝硬化基礎上,肝穿刺活檢病理學確診存在較高風險。對伴肝硬化背景患者的肝癌確診應采用放射學診斷標準,而不依賴病理學診斷。因此,全球范圍內,包括我國,通常采用統計學方法對肝癌發病與歸因進行估計,如根據國際疾病分類10(international classification of diseases,ICD-10)和有確切病理學的數據推算,或采用多元估算方法,與人群實際發病可能有一定偏差[23]。
3.1 發病率與死亡率 基于GLOBOCAN 2018年數據,根據ICD-10,全球肝癌新發約792 031例,人口年齡標化率(age-standardized rates, ASR)為8.9/10萬,位居惡性腫瘤發病譜第6位,其中男性ASR為13.4/10萬,位居惡性腫瘤發病譜第5位;女性ASR為4.7/10萬,位居惡性腫瘤發病譜第9位[24]。全球肝癌發病率最高的國家是蒙古,ASR為90.0/10萬,死亡約727 661萬例,ASR死亡率為8.1/10萬,位居惡性腫瘤死亡譜第4位,其中男性位居惡性腫瘤死亡譜的第2位,女性位居惡性腫瘤死亡譜的第6位,全球肝癌死亡率最高的國家仍然是蒙古[24]。歐美地區肝癌發病率和死亡率較低,但近10年來呈逐步上升趨勢;亞洲人群的肝癌發病率較高,但發病率和死亡率均呈現逐年下降趨勢[24]。
GLOBOCAN 2018年報道,中國人群肝癌的ASR發病率為17.7/10萬,ASR死亡率為16.4/10萬,均居全球第9位;2014年中國肝癌新發約364 800例,居全部腫瘤發病第4位,死亡318 800例,居全部腫瘤死亡第2位;每年肝癌總發病和死亡例數約占全球的一半,并具有顯著的城鄉和地區差別;農村地區人口調整發病率為20.07/10萬,死亡率17.52/10萬,高于城市的發病率(16.13/10萬)和死亡率(13.64/10萬)[23]。目前,我國西部地區的發病率(20.85/10萬)、死亡率(16.98/10萬)均高于中部(分別為18.23/10萬和15.97/10萬)和東部地區(分別為15.31/10萬和13.52/10萬)[23]。隨著我國生活環境的改善、乙型肝炎疫苗預防免疫接種和慢性HBV感染的有效抗病毒治療等[25],中國肝癌ASR在2000年—2014年每年下降2.3%,其中<40歲年齡組每年下降3.9%[23]。同時,肝癌發病年齡逐年增大,城市和農村地區男性平均發病年齡由2000年的59.67和56.53歲延遲到2014年的62.66和61.20歲,女性由65.50和60.60歲延遲到69.87和66.07歲[26]。
3.2 疾病負擔 全球范圍內,在惡性腫瘤死亡和致傷殘調整生命年(disability-adjusted life-years, DALYs)中,肝癌位居第2位[24]。2017年在中國所有慢性疾病中,肝癌成為第5位導致早死損失生命年(years of life lost, YLLs),第7位導致DALYs的疾病[27]。1990年—2017年,DALYs和YLLs均呈上升趨勢,在所有年齡組人群中,DALYs增加了43.5%(95%UI:31.2~60.3),YLLs增加了21.2%(95%UI:10.8~35.2)[27]。人口老齡化是肝癌所致疾病負擔增加的主要原因[24,26]。
推薦意見1:肝癌的篩查與監測應納入國家公共衛生計劃,旨在降低與肝癌相關死亡和總體肝病相關死亡(C1)。
推薦意見2:我國肝癌發病年齡逐漸增大;年齡調整發病率呈逐年下降趨勢,但所導致的疾病負擔仍呈上升趨勢(A1)。
4 肝癌的病因
90%以上肝癌病因學較為明確,包括肝硬化、HBV感染、HCV感染、酒精、非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD;現更名為代謝相關脂肪性肝病,本指南仍用NAFLD)和糖尿病等,以及致癌物的長期暴露,如黃曲霉毒素和馬兜鈴酸等,肝癌家族史可顯著增加病毒感染人群的肝癌發病風險。
4.1 肝硬化 各種原因導致的肝硬化是肝細胞癌發生過程中最重要的環節,85%~95%的肝細胞癌具有肝硬化背景[28]。慢性HBV相關肝硬化患者肝癌年發生率為3%~6%,是我國肝細胞癌的首要病因[29],HCV肝硬化年肝癌發生率為2%~4%[30]。HBV和/或HCV相關肝硬化患者,抗病毒治療后獲得持續病毒學應答(SVR),其發生肝癌的風險顯著降低。一項由多病因組成的2079例肝硬化患者隨訪10年的隊列研究[31]顯示,NAFLD和自身免疫性肝硬化患者10年累積肝細胞癌發病率分別為16.3%和4.6%。與HBV和/或HCV相關肝硬化相比,酒精性肝硬化患者發生肝細胞癌的絕對風險低2~3倍[32]。肝硬化進展為肝細胞癌的風險受年齡、性別、病因、肝癌家族史和糖尿病等相關因素影響。在肝硬化患者中,年齡較大、男性、合并血小板計數低(<100×109/L)和食管靜脈曲張者發生肝細胞癌的概率更高。已有研究[33]表明,肝細胞癌發生率與門靜脈壓力或通過瞬時彈性成像測定的肝臟硬度指數(liver stiffness measurement, LSM)相關。慢性膽道疾病、血色病、肝卟啉病以及α1-抗胰蛋白酶缺乏癥等引起的肝硬化可能會增加肝細胞癌的風險,但在世界范圍內占比均很小。
4.2 慢性HBV感染 全球范圍內HBV感染是肝細胞癌的首要病因,尤其是在東亞和非洲國家[34]。我國國家癌癥中心[18]對1823例肝細胞癌患者病因分析結果顯示,86.0%為HBV單純感染,6.7%為HBV和HCV混合感染。研究[35]顯示,HBsAg為陰性的隱匿性HBV感染者,肝細胞癌發生風險較非HBV感染者增加,調整后的相對危險度(relative risk,RR)為2.86(95%CI:1.59~4.13)。具有肝癌家族史的HBV感染者有更高的肝細胞癌風險。一項對22 472名我國臺灣地區居民隨訪(16.12±2.89)年的研究[36]顯示,在HBsAg陰性人群中,無肝癌家族史者肝細胞癌累積發病率為0.62%,伴肝癌家族史為0.65%;但在HBsAg陽性人群中,無肝癌家族史者肝細胞癌累積發病率為7.5%,伴肝癌家族史者肝細胞癌累積發病率高達15.8%。
HBeAg狀態、外周血HBV DNA載量、HBV基因型和相關基因突變等與肝細胞癌風險有關[37-41]。在啟東肝癌高發區,與HBsAg和HBeAg同時陰性者相比,HBsAg陽性但HBeAg陰性、HBsAg與HBeAg雙陽性患者發生肝細胞癌的RR分別為13.25(95%CI:6.67~26.33)和28.05(95%CI:13.87~56.73)[37]。值得注意的是,肝細胞癌累積發病率與HBV DNA水平并非呈線性正相關,HBV DNA載量為104~106拷貝/ml者,發生肝細胞癌的風險比(hazard ratio,HR)最高,而當HBV DNA>106拷貝/ml時,HR值反而有所下降[38]。對于HBeAg陰性,HBV DNA在2000~20 000 IU/ml者,HBV核心相關抗原(hepatitis B core-related antigen, HBcrAg)≥10 KU/ml時,肝細胞癌發生風險顯著增加[39]。對于HBeAg陰性、HBV DNA<2000 IU/ml,但HBsAg≥1000 IU/ml者,肝細胞癌發生風險較HBsAg<1000 IU/ml者增加13.7倍(95%CI:4.8~39.7)[40]。因此,在抗病毒治療時代,HBsAg、HBcrAg定量與HBV DNA互補,可作為預測HBV感染者進展為肝細胞癌的標志物[39,41]。但在50歲后,即使HBsAg消失的HBV感染者,肝細胞癌發生的風險仍較高。HBV基因型和基因的變異可顯著增加肝細胞癌發病風險,包括HBV前S區的變異(OR=3.77,95%CI:2.57~5.52)、增強子Ⅱ區C1653T變異(OR=2.76,95%CI:2.09~3.64)和T1753V變異(OR=2.35,95%CI:1.63~3.40)、核心啟動子區A1762T/G1764A雙突變(OR=3.79,95%CI:2.71~5.29)等,是肝細胞癌風險的獨立預測因子[42]。并且,這些突變在肝細胞癌的發展過程中具有不斷積累的趨勢[43-44]。
在抗病毒治療時代,核苷(酸)類似物[nucleos(t)ide analogues,NAs]一線抗病毒藥物——恩替卡韋(entecavir,ETV)、富馬酸替諾福韋二吡呋酯(tenofovir disoproxil fumarate,TDF)及富馬酸丙酚替諾福韋酯(tenofovir alafenamide fumarate,TAF)的應用顯著降低了HBV患者進展為肝硬化及肝細胞癌的風險[45-47]。α干擾素(IFNα)是另一類抗病毒藥,也可降低慢性HBV患者進展為肝癌的風險[48]。但是,無論NAs或IFNα治療后,均不能完全消除慢性HBV感染進展為肝癌的風險。
4.3 其他病因
4.3.1 慢性HCV感染 HCV感染發生肝細胞癌歸因于HCV所致的肝硬化。在北美地區,59%(95%CI:3%~79%)的肝細胞癌歸因于HCV感染;北歐地區為28%(95%CI:10%~55%),歐洲其他地區為40%(95%CI:32%~49%);非洲中北部為79%(95%CI:69%~86%)[49]。在我國,HCV單獨感染僅占肝細胞癌全部病因的1.7%~2.5%,HCV合并HBV感染者占6.7%[18]。在HCV感染者中,肝細胞癌風險增加的因素包括男性、年齡較大、合并HIV或HBV感染、糖尿病和長期飲酒等[9,50-54]。肝癌家族史也能增加HCV感染者的肝細胞癌發病風險。一項對西方人群進行的薈萃分析[50]顯示,具有肝癌家族史但HBsAg和抗HCV抗體雙陰性人群,發生肝細胞癌風險OR=2.94(95%CI:0.94~9.21),但在病毒感染陽性人群中,肝細胞癌在無家族史人群的風險為OR=38.19(95%CI:21.97~66.39),具有肝癌家族史人群的肝細胞癌風險OR=72.48(95%CI:21.92~239.73)。研究[51]顯示,聚乙二醇干擾素(PEG-IFN)或直接抗病毒藥物(direct-acting antivial drug,DAA)均能降低HCV相關肝硬化及肝細胞癌發生的風險。
4.3.2 酒精性肝病、NAFLD或伴糖尿病 酒精性肝病是歐美國家肝細胞癌的主要病因,僅次于HCV或HBV感染。一項法國多中心652例酒精性肝硬化隊列研究[52]顯示,肝細胞癌的年發生率為2.9%,酗酒(乙醇≥80 ml/d)顯著增加肝硬化發生肝細胞癌風險。一項病例對照研究[53]顯示,單純酒精性肝硬化、HCV或HBV肝硬化進展為肝細胞癌風險的OR值分別為4.5(95%CI:1.4~14.8)、15.3(95%CI:4.3~54.4)和12.6(95%CI:2.5~63.1),而酒精肝伴有慢性HCV或慢性HBV感染等2個或以上因素者OR高達53.9(95%CI:7.0~415.7)。吸煙、肥胖和糖尿病等與酒精之間存在交互增強肝細胞癌風險的關系[52]。一項薈萃分析[54]顯示,戒酒后肝細胞癌患病風險每年可下降6%~7%,但降至非飲酒者的風險等級則需23年(95%CI:14~70)。
NAFLD是目前全球最常見的肝臟疾病,正在成為肝細胞癌的重要病因[55]。一項涉及歐洲地區4個隊列約130 000例NAFLD或非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)患者的研究[56]顯示,NAFLD或NASH患者的肝癌風險較普通人群提高了3.51倍(95%CI:1.72~7.16),在沒有肝硬化背景的肝細胞癌患者中,NAFLD患者比例高達26.3%。我國一項社區人群前瞻性隊列研究[57](US診斷為NAFLD)中,只有肝功能異常即ALT≥80 U/L的NASH患者,發生肝細胞癌的風險較對照組增加了4.41倍(95%CI:1.40~13.96)。由于部分NAFLD同時也合并酒精性肝病,因此NAFLD對肝細胞癌的確切風險度還有待進一步明確。NAFLD伴糖尿病患者,其發生肝細胞癌的風險比正常人高1.8~2.5倍,在各種族中均是肝細胞癌發病和預后的獨立因素[58-59]。
4.3.3 致癌物暴露 飲食中黃曲霉毒素B1(aflatoxin B1,AFB1)暴露是造成撒哈拉以南非洲、東南亞和中國部分農村地區肝細胞癌高發的重要原因,國際癌癥研究署(International Agency for Research on Cancer,IARC)于1987年將其列為Ⅰ類致癌物。AFB1本身的直接致癌作用存在爭議,但研究[60-61]顯示,AFB1與HBV感染之間存在很強的交互作用。一項病例對照研究[60]顯示,在HBsAg陰性人群中,單純AFB1暴露增加致肝細胞癌的風險為非暴露者的1.9倍(95%CI:5~7.5),當疊加慢性HBV感染時,肝細胞癌風險可增高至60.1倍(95%CI:6.4~561.8)。隨著我國政府改水改糧措施的實施,AFB1在我國肝癌高發區人群中的暴露水平已有顯著下降,其在我國肝細胞癌病因學中的貢獻度也正在逐漸減弱[61]。
馬兜鈴酸(aristolochic acid,AA)存在于馬兜鈴屬及細辛屬等植物中,是很多中草藥方的常見成分。2012年AA被IARC列為Ⅰ類致癌物。通過對肝細胞癌的基因組特征分析提示,亞洲人群肝細胞癌中具有AA特征性突變的比例遠高于歐美,尤其是我國臺灣地區高達78%[62]。在乙型肝炎患者中,AA暴露與肝細胞癌風險之間存在劑量反應關系[63]。
4.4 肝癌病因的變遷 隨著新生兒乙型肝炎疫苗預防接種,致癌物黃曲霉毒素暴露的有效控制,青壯年人群中HBV所致肝細胞癌發病顯著下降[25,61,64]。HBV和HCV感染的篩查與及時有效地抗病毒治療,也導致HBV和HCV相關肝細胞癌比例將逐漸下降[65],而酒精、NAFLD等非傳染性肝病所占比例逐漸增加,其肝細胞癌發病率也增加。慢性肝病的病因變化引起全世界范圍肝細胞癌的病因也逐漸發生變遷。
推薦意見3:慢性乙型肝炎是肝細胞癌的主要病因(A1)。酒精、代謝相關性疾病患者肝癌的發病率逐年增加(B1)。黃曲霉毒素B1增加HBV感染、酒精性肝病患者肝癌的發生風險(A1)。
推薦意見4:各種原因導致的肝硬化是肝癌發生的重要環節,慢性HBV相關肝硬化是我國肝細胞癌的首要病因(A1)。
5 肝癌高危人群的辨識與分層
肝硬化及未抗病毒治療或未獲得SVR的慢性HBV或HCV感染者,是我國肝細胞癌的主要高危人群。
5.1 肝硬化患者肝細胞癌風險分層 肝硬化患者是全球各指南公認的肝細胞癌高危人群。但肝硬化發生肝細胞癌的風險,因病因等不同而異。根據這一特性,多倫多肝細胞癌風險指數(Toronto HCC risk index,THRI)納入了年齡、性別、肝硬化病因(自身免疫性肝病0分,獲得SVR的丙型肝炎0分,其他肝病36分,脂肪性肝炎54分,未治療的慢性丙型肝炎或慢性乙型肝炎各97分)以及血小板計數5項變量,構建了總計366分的THRI模型(表2)。低危組(<120分)、中危組(120~240分)和高危組(>240分)5年肝細胞癌累積發病率分別為1.2%、4.4%和15.4%,10年肝細胞癌累積發病率分別為3%、10%和32%[31]。THRI模型在我國也得到較好的驗證,歸類于低、中和高危組的肝硬化患者,5年肝細胞癌累積發病率分別為0、13%和34%,預測模型曲線下面積(area under the ROC,AUC)為0.707[66]。THRI模型意義是,即使在肝細胞癌高危的肝硬化患者中,仍有進一步風險分層的必要,即能區分出肝細胞癌的極高危人群。除肝硬化病因外,具備以下特征的肝硬化患者,發生肝細胞癌的風險更大:(1)US發現肝臟結節(1~2 cm)或病理學為LGDN、HGDN。研究[21]顯示,LGDN、HGDN進展為肝癌的年發生率約分別為10%和20%。(2)肝硬化合并糖尿病的患者,其肝細胞癌發生風險較不伴糖尿病的患者增加2~3倍[67]。(3)肝硬化結節(≤1 cm),未接受抗病毒藥物治療或治療后仍持續存在低病毒載量HBV DNA患者,肝癌發生率顯著增加[68]。
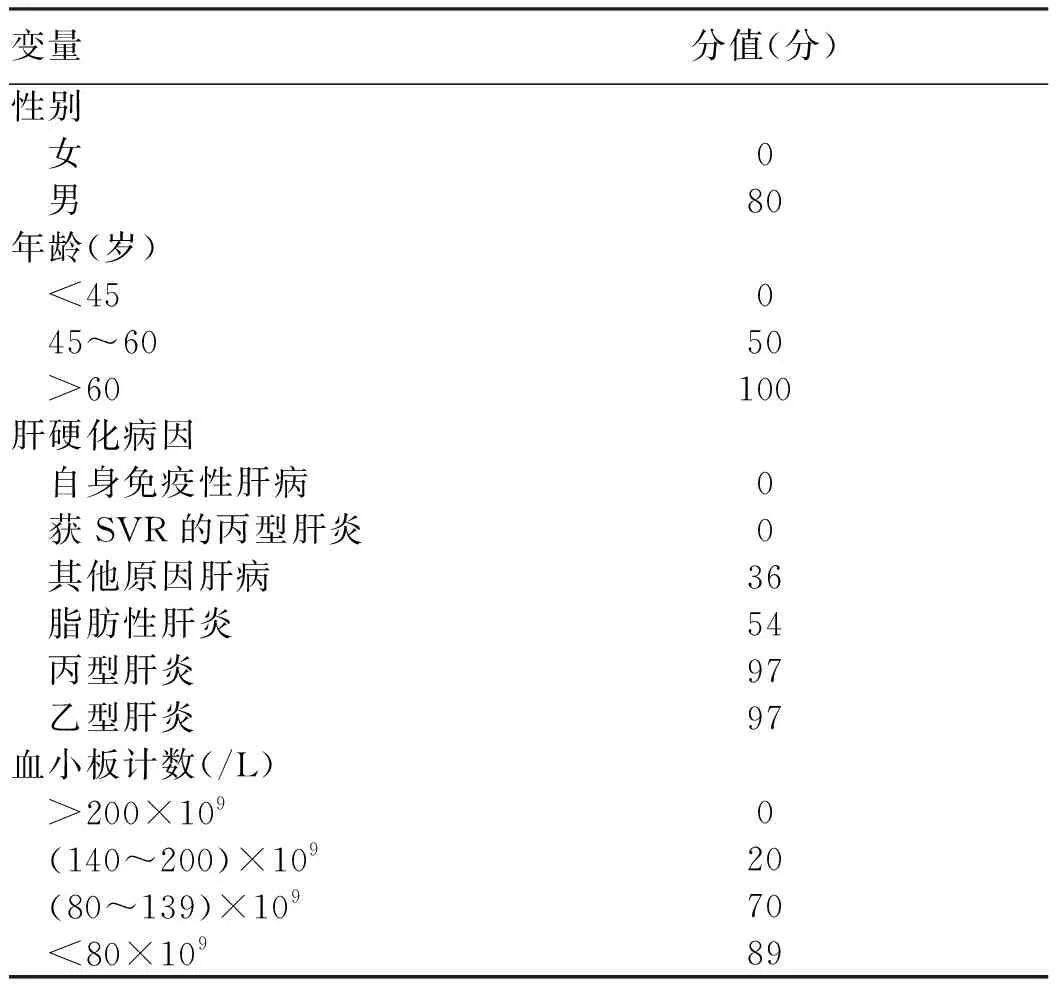
表2 多倫多肝細胞癌風險指數模型參數與賦值
近年來,作為無創檢查肝硬化手段的LSM在肝細胞癌風險分層中的價值也逐漸顯現。韓國一項前瞻性研究[34]顯示,在HBV感染者中,LSM為8.1~13 kPa、13.1~18 kPa、18.1~23 kPa和>23 kPa的患者,發生肝細胞癌的HR值分別為3.07、4.68、5.55和6.60。在我國臺灣地區HCV感染者中,當LSM<12.0 kPa時,肝細胞癌的5年累積發病率僅有0.9%,而當LSM處于12.0~24.0 kPa和>24.0 kPa區間時,肝細胞癌的5年累積發病率則可分別上升至9.5%和45.1%[69]。因此,在所有原因所致的慢性肝病患者中,要重視肝硬化的早期診斷與篩查。
5.2 HBV感染者肝細胞癌風險分層 盡管HBV感染是肝細胞癌的主要病因,但在沒有肝硬化的情況下,一生中僅6.2%~9.5%的HBV感染者進展為肝細胞癌。免疫耐受期HBV感染者中(ALT和AST持續正常,HBeAg陽性,HBV DNA>107IU/ml;肝臟病理確認無明顯炎癥或纖維化),10年肝癌累積發生率僅為1.7%[70]。我國臺灣學者[38]模型針對未接受抗病毒治療的HBV感染者發生肝細胞癌的危險分層,構建了包括性別、年齡、ALT、HBeAg狀態和HBV DNA水平5個參數、總計17分的REACH-B模型(表3),評分為0~5分、6~11分和12~17分,分別歸于低危、中危和高危。最低分組(0分)和最高分組(17分)患者在3、5、10年內肝細胞癌發生率分別為0和23.6%、0和47.4%以及0和81.6%。在我國啟東地區肝癌高發區,以性別、年齡、HBeAg狀態和HBV DNA水平4個參數構建了AGED模型(共12分)[37],其高危組(≥10分)20年內發生肝細胞癌的風險是低危組(≤4分)的20.3倍。尤其重要的是,低危組發生肝細胞癌的風險與無HBV感染的普通人群已經基本一致,這提示對于低危組的HBV感染者,并無必要和高危組一樣接受相同的肝細胞癌監測方案。

表3 REACH-B模型參數與賦值
基于歐洲9個前瞻性隊列1815例慢性乙型肝炎患者、口服ETV或TDF抗病毒治療5年結果,構建了包括年齡、性別和血小板計數3個參數、總計25分的PAGE-B模型(表4),用于評估抗病毒治療后HBV感染患者發生肝細胞癌的危險度[71]。PAGE-B評分為低危(0~9分)、中危(10~17分)和高危(18~25分)3組患者,在發現隊列和驗證隊列人群中,肝細胞癌的5年累積發生率在評分為低危者均為0,評分為中危者為3%~4%,評分為高危者為16%~17%。韓國隊列[72]驗證了PAGE-B模型在亞洲人群中同樣有效,5年肝細胞癌預測力的AUC為0.77。最近,PAGE-B研究團隊[73]又構建了用于抗病毒治療5年后,重新評估肝細胞癌發病風險的SAGE-B模型,包括抗病毒5年后的年齡和LSM 2個參數,共計15分。SAGE-B評分為低危(≤5分)、中危(6~10分)和高危(≥11分)的3組患者,12年肝細胞癌累積發生率分別為0、4%和13.8%。總之,即使在抗病毒治療的慢性HBV感染者中,5年肝細胞癌累積發病率總體上仍有5.7%~8.4%,尤其是歸為高危組的患者,但值得指出的是,低危組患者5年[72]和12年[73]肝細胞癌陰性預測率高達97.5%~100%,提示這些患者可免于每年2次的常規肝癌監測。
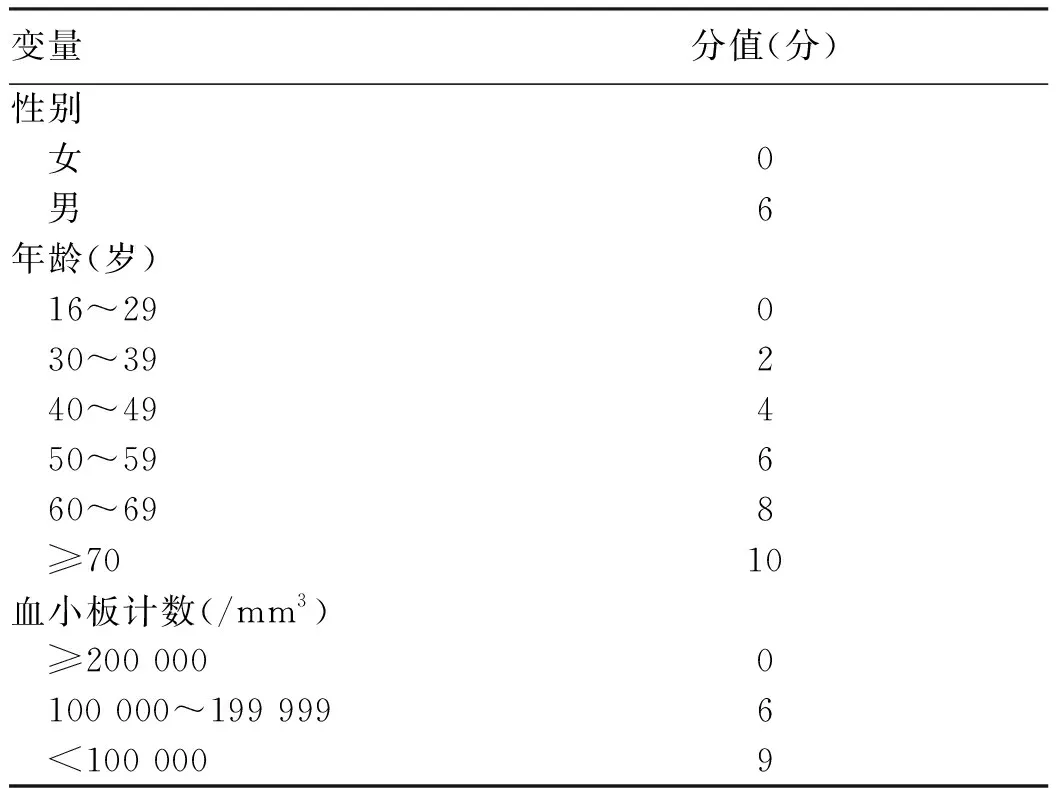
表4 PAGE-B模型參數與賦值
總之,男性、年齡>40歲、一級親屬肝癌家族史、糖尿病等因素都會增加HBV感染者發生肝細胞癌的風險。此外,抗病毒治療失敗或耐藥,如rtA181T、rtL80I、rtN236T突變或存在低病毒血癥(low-level viremia,LLV)等,也會增加肝細胞癌的發生風險[74]。
5.3 其他人員肝細胞癌風險分層
5.3.1 HCV感染者中肝細胞癌風險分層 在未經治療的HCV感染者中,血清HCV RNA、ALT以及HCV基因型1b是肝細胞癌的獨立預測因子[30,75]。在HCV感染治療患者中,年齡和肝纖維化程度是肝細胞癌發生的主要因素。PEG-IFN或DAA治療后獲得SVR慢性HCV感染患者,肝細胞癌風險雖可明顯下降,但并不能徹底消除,尤其是肝硬化患者[51,76]。因此,前期已被納入肝細胞癌監測的患者,目前并無停止監測的參考指標,應按原計劃繼續進行肝細胞癌監測。
5.3.3 肝癌家族史人群 在HBV或HCV感染人群中,一級親屬伴肝癌家族史顯著增加肝細胞癌發生風險[36,50,78]。我國臺灣學者[36]對22 472名居民隨訪總計362 268人/年,共發生374例肝細胞癌,在HBsAg陽性患者中,肝癌家族史增加肝細胞癌風險2.54倍。對我國江蘇地區總計2011例肝癌和7933例非肝癌對照分析[78]顯示,HBV陰性但伴肝癌家族史的肝細胞癌風險增加的OR=2.76(95%CI:1.88~4.05),但在HBV陽性、伴一級肝癌家族史的人群中,肝細胞癌風險的OR=41.34(95%CI:23.69~72.12)。因此,一級親屬伴肝癌家族史,使HBV感染者[36,78]或HCV感染者[50]在各階段患肝細胞癌風險顯著增加,需引起特別注意。
盡管HBV或HCV感染是肝細胞癌的主要病因,但由非病毒因素導致的肝細胞癌比例逐年上升。近來,我國學者[79]應用全球11個前瞻性隊列(n=17 374)的數據,構建了由年齡、性別、血小板、白蛋白和膽紅素等5個參數組成的總分為100分的aMAP模型,用于不分病因的肝病患者肝細胞癌風險預測。歸于低危組(<50分)患者,3、5年肝細胞癌累積發生率僅為0和0.8%,由于這些患者中肝細胞癌年發病率已<0.2%,認為可免于每6個月1次的肝細胞癌監測。而歸于中危組(50~60分)和高危組(60~100分)患者的3年肝細胞癌累積發生率分別為1.5%和4.8%,5年肝細胞癌累積發生率分別為8.1%和19.9%。但該研究發現低危組患者占45%,高危組患者僅占17.9%。因此,aMAP模型對高危人群及非病毒性肝病患者進展為肝細胞癌的辨識作用尚需要進一步評估。
總之,對肝癌風險人群實施分層管理,可能是提高早期肝癌診斷率和成本效益最重要的策略。肝癌高危人群的辨識與分層推薦意見見表5。

表5 肝癌高危人群的辨識與分層
6 篩查與監測工具
6.1 腹部US US由于其操作簡便、靈活、無創和價格低,被很多國家的指南推薦作為肝癌的篩查方法[80]。US可較靈敏地發現肝內占位性病變,準確區分囊性或實性病變。直徑>2 cm的肝臟腫瘤,根據病灶血供等特征,US有助于鑒別其良惡性。總體來講,對于直徑<2 cm、2~3 cm、4~5 cm和>5 cm的肝癌,US診斷的敏感度分別為39%~65%、76%、84%和90%[81]。超聲多普勒不僅可以看到病變內的血液供應,還可以識別病變與血管之間的關系。超聲造影使肝臟占位內的血流動力學變化可視化,并有助于鑒別診斷各種肝臟占位性病變的性質,提高US診斷肝癌的敏感度和特異度[82-83]。但是,US容易受到檢查者經驗、手法和細致程度的影響,也受患者肥胖的影響。不管早期肝癌US敏感度低的原因是什么,US仍是肝癌篩查與監測最重要的工具。
6.2 多排螺旋CT、MRI 多排螺旋CT和MRI是診斷肝癌及臨床分期最重要的工具,但設備價格高,難以在基層醫院應用。動脈期明顯的異質性增強,門靜脈期和/或實質平衡期顯示出腫瘤增強程度降低,快速洗入和洗出的增強模式是肝癌的CT影像特征[79]。MRI組織分辨率高,采用特異性對比劑釓塞酸二鈉(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid, Gd-EOB-DTPA)增強掃描,可顯著提高早期肝癌的診斷敏感度和特異度[84]。肝硬化結節≤2 cm,采用Gd-EOB-DTPA增強MRI檢查,其敏感度、特異度分別為96.0%和96.6%;MRI增強掃描對HGDN具有高敏感度(94.7%)和特異度(99.3%),可較準確鑒別早期肝細胞癌和HGDN[85]。有學者[86]對407例肝硬化進行了前瞻性監測(4~6個月1次)顯示,在發現的43例肝癌患者中,增強MRI檢出率為86%,明顯高于US(27.9%);而假陽性的比例明顯低于US(分別為3.0%和5.6%);74.4%(32/43)的患者為早早期肝癌(單個結節<2 cm)。因此,與US相比,在極高肝細胞癌危險的肝硬化患者中,Gd-EOB-DTPA增強MRI監測,可提高早早期肝細胞癌的檢出率[84]。但是,直徑≥2 cm肝癌,CT與MRI診斷的敏感度相似[81]。增強MRI是否能取代US檢查作為肝癌極高危人群監測工具,還需要深入研究。
6.3 AFP、DCP、AFP-L3 20世紀70年代,由于中晚期肝細胞癌比例較多,AFP的敏感度可達72%~87%。但隨著醫學影像學的發展,早期肝癌診斷比例不斷增加,AFP診斷肝細胞癌的價值也有所下降。AFP水平與腫瘤大小有關,部分良性肝病、肝母細胞瘤和胃腸道惡性腫瘤患者血清AFP也會升高[87]。腫瘤直徑<2 cm、2~5 cm 和>5 cm的肝癌中,AFP正常(<20 ng/ml)的比例為50%~70%、30%~50%和20%~30%[81]。總體上看,AFP診斷肝細胞癌的敏感度為25%~65%,特異度為80%~94%[81]。因此,2010年AASLD、2018年EASL已不再將AFP作為肝細胞癌診斷的必備指標。但是,AFP與US聯合檢查,可提高肝細胞癌診斷的敏感度。由32項研究組成的薈萃分析(13 367例)[16]表明,單獨US發現肝細胞癌的敏感度低于US聯合AFP(RR=0.88,95%CI:0.83~0.93)。一項對1487例HBV感染者的研究[88]顯示,僅用AFP監測,就能發現早期肝細胞癌,并延長患者的生存時間;在超聲設備或檢測經驗有限地區,AFP作為肝細胞癌監測的工具仍有意義。同時,在抗病毒治療時代,AFP可提高HBV相關肝細胞癌發生的早期預警,如果抗病毒治療未能使患者的AFP水平下降,則應警惕肝細胞癌風險[89]。因此,US聯合AFP可提高早期肝細胞癌的敏感度,特別是非病毒性肝炎相關的肝硬化患者[90]。
DCP也稱維生素K缺乏癥或拮抗劑Ⅱ誘導的蛋白質(protein induced by vitamin K absence or antagonist Ⅱ,PIVKA-Ⅱ),1984年首次報道在肝細胞癌患者血清中升高。包括31個研究的薈萃分析[91]顯示,臨界值為40 mAU/ml時,PIVKA-Ⅱ診斷肝細胞癌診斷敏感度為66%,特異度為89%。PIVKA-Ⅱ在不同腫瘤大小、不同人群以及不同病因中,診斷肝細胞癌的能力均優于AFP。我國多中心研究[92]也顯示,PIVKA-Ⅱ在區分肝細胞癌與對照之間的正確率比AFP高6.2%~20.7%。PIVKA-Ⅱ和AFP的形成機制不相同,兩者之間無相關性,在AFP陰性的肝細胞癌患者中,PIVKA-Ⅱ診斷肝細胞癌的AUC為0.86。因此,AFP與PIVKA-Ⅱ聯用,可提高對肝細胞癌早期檢出率。
AFP-L3是AFP的巖藻糖基化變異體,慢性肝炎和肝硬化患者AFP主要成分為AFP-L1,肝癌患者AFP主要成分為AFP-L3。薈萃分析[93]顯示,AFP-L3診斷肝細胞癌的總體敏感度和特異度分別為48.3%(45.9%~50.7%)和92.9%(91.6%~94.0%)。基于性別、年齡和AFP、AFP-L3、DCP 3種血清標志物構建的GALAD模型,診斷早期肝癌的敏感度與特異度分別為85.6%、93.3%,區別肝癌與慢性肝病AUC>0.9,且該模型不受病因及抗病毒治療的影響[94-95]。
6.4 其他血清蛋白標志物 肝細胞癌蛋白標志物還包括:α-L-巖藻糖苷酶、血清鐵蛋白、骨橋蛋白、Glypican-3、熱休克蛋白90α、高爾基體蛋白73、熱激蛋白27和Dickkopf1等。由于這些生物標志物在其他惡性腫瘤、肝硬化或慢性肝炎患者中也會增高,限制了其作為肝癌標志物的應用價值[96]。
6.5 新的血清生物標志物
6.5.1 微小RNA(microRNA,miRNA) miRNA是一種由20~25個核苷酸組成的非編碼RNA,在轉錄后水平調控目的基因的表達。由外泌體包裹的miRNA在血循環中穩定性較高,具有血清學標志物的應用前景。薈萃分析[97]顯示,診斷肝細胞癌的敏感度和特異度均>80%的單一miRNA,包括miR-130b、miR-150、miR-182、miR-215和miR-96。尤其重要的是,在BCLC 0期的早早期肝癌中,miRNA組合檢測的診斷敏感度和特異度也可分別達到86.1%和76.8%。由7種miRNA(miR-122、miR-192、miR-21、miR-223、miR-26a、miR-27a和miR-801)組成的肝癌診斷試劑盒,其區分肝癌患者和正常人群的正確率達94.1%[98]。miRNA作為一種新的標志物,存在的主要問題是重復性欠佳,仍有待大樣本、多中心臨床驗證其應用價值。
6.5.2 液體活檢 液體活檢作為精準醫學時代檢測的標志物,包括循環腫瘤細胞、循環腫瘤DNA(circulating tumor DNA, ctDNA)、外泌體、腫瘤相關甲基化、循環游離DNA(circulating cell-free DNA,cfDNA)、長鏈非編碼RNA等[99-100]。ctDNA相關基因的改變,例如p15、p16、APC、SPINT2、SFRP1、p16INK4a、TFPI2、GSTP1和RASSF1A與肝細胞癌發生和發展有關。研究[101]顯示,cfDNA甲基化,在診斷肝癌方面具有高敏感度和特異度,且與腫瘤大小、腫瘤分期和治療應答等密切相關。目前液體活檢的成本高,不適宜用于肝癌的篩查和監測。
總之,除AFP外,包括AFP-L3和PIVKA-Ⅱ以及其他血清蛋白標志物、液體活檢在內所有新的標志物,均需要經過EDRN提出的腫瘤標志物發現和驗證的5個臨床階段的充分評估[102],才能將其作為肝癌篩查、監測或診斷的指標。
推薦意見9:腹部US聯合血清AFP是肝癌監測的一線工具(A1)。
推薦意見10:血清AFP聯合AFP-L3及PIVKA-Ⅱ檢測,可提高早期肝癌的檢出率(B2)。
推薦意見11:肝癌極高危險人群中,Gd-EOB-DTPA增強MRI可提高對肝硬化增生結節、LGND和HGND的鑒別能力,顯著提高早早期肝癌的檢出率(B1)。
推薦意見12:液體活檢等新的肝癌血清標志物,無論是單獨還是聯合,作為肝癌篩查與監測的血清指標,仍缺乏臨床充分評估與嚴格驗證,不推薦用于常規篩查與監測(C1)。
7 肝癌的監測
在有肝癌風險的人群中,終生監測有助于肝癌的早診早治,降低其病死率。對47項研究(包括15 158例肝硬化患者)的薈萃分析[103]顯示,監測可顯著提高早期肝癌診斷率(OR=2.08,95%CI:1.80~2.37)和肝癌根治率(OR=2.24,95%CI:1.99~2.52),與肝癌患者總生存率有關(OR=1.90,95%CI:1.67~2.17),監測組患者的3年累積生存率為50.8%,而在非監測組患者僅為27.9%。另一項由17 820名HBV感染者隊列[104]顯示,AFP聯合US監測6個月1次,監測組肝癌患者1、2年生存率分別為88.1%和77.5%,而非監測組肝癌患者的1年生存率為0。因此,科學地確定監測目標人群及分層監測方案,是提高肝癌患者整體生存率及成本效益最關鍵的環節。
7.1 目標人群 關于肝癌監測的目標人群,認為以下幾個條件是必要的:(1)監測目標人群肝細胞癌的發生危險足夠高。不同病因的肝病患者進展為肝癌的危險有差別;在抗病毒治療時代,不同臨床階段HBV或HCV感染發生肝癌的危險差別也很大。不論是否存在肝硬化,HBV感染者進展為肝癌的年危險度>1.5%,或肝癌發生率>0.2%,才適合監測。(2)監測目標人群的肝細胞癌診斷率高于由癥狀、體征或偶然影像學檢查的早期肝細胞癌診斷率。(3)監測目標人群中,肝癌治療后的長期生存率要比未監測人群高[105-106]。一項8900例慢性病毒性肝病患者(HBV感染15%,HCV感染80%,混合感染5%)的前瞻性隊列研究[107]顯示,每6個月1次US聯合AFP監測肝癌,隨訪中位數10年,8.6%的患者進展為肝細胞癌,其中47.3%的肝硬化患者進展為肝細胞癌。無肝硬化的慢性HBV或HCV感染者中,肝癌年發生率低,特別是有效抗病毒治療后肝細胞癌發生風險降低達70%[107],達不到需要監測肝癌的閾值。但是,在HBV相關肝硬化患者中,抗病毒治療后肝細胞癌年發生率仍高達1.5%~2.5%[76,108]。Singal等[109]前瞻性分析了446例Child-Pugh A/B級肝硬化患者, US聯合AFP監測6個月1次,中位隨訪3.5年,在這些肝硬化患者中,肝癌年發生率為2.8%,3、5年累積發生率分別為5.7%和9.1%,其中早期肝癌占73.2%。另一項多中心研究[110]顯示,慢性乙型肝炎患者ETV或TDF治療后,前5年和第2個5年期間,無/肝硬化患者的肝細胞癌年發生率分別為0.49%和0.47%,但在有肝硬化患者中,肝細胞癌年發生率則為3.22%和1.57%。結果表明,接受抗病毒治療的HBV相關肝硬化患者,肝細胞癌的發生率仍高于監測的閾值。而抗病毒治療后,獲得SVR的HBV非肝硬化患者,似乎沒有監測肝癌的必要。因此,肝硬化是必須監測肝癌的高危人群。但迄今尚無針對肝硬化患者的多中心、大樣本、隨機對照的肝癌分層監測的研究。
值得指出的是,失代償期肝硬化(Child-Pugh B或C級)發生肝細胞癌的風險更大[111]。但是,由于這些患者存在肝功能衰竭或難控制的并發癥,不能接受肝癌根治性治療,因此,AASLD指南推薦,除非這類患者有條件進行肝移植,從成本效益角度考慮,沒有必要進行肝癌的監測。不過,隨著肝癌綜合治療技術的提高,如果早診早治能使患者延長3個月以上的壽命,在失代償期肝硬化患者中監測肝癌還是必要的。對于失代償期HBV相關肝硬化患者來說,經有效抗病毒治療后,可以出現肝硬化逆轉或“再代償”,動態監測肝癌,對于降低肝病整體病死率仍很重要[46,108]。在等待肝移植的患者中也有必要進行監測,因為肝癌可能會改變患者的優先等候級別和預后。
7.2 監測間隔 全球各指南推薦肝癌監測間隔不一致。新版的AASLD、EASL、LI-RADS、NCCN、APASL指南以及2019年國家衛健委發布的《原發性肝癌診療規范》推薦,肝癌高危人群間隔6個月監測1次。日本肝病學會將肝癌高危人群進行了分層,對于極高危人群間隔3~4個月監測1次,低危人群間隔6個月1次。有學者[112]比較了慢性肝炎合并血小板減少患者,間隔4個月和12個月監測1次,結果顯示,3年累積肝細胞癌發生率在兩組間無顯著差異。但是,間隔4個月監測1次的患者中,早早期肝癌及接受根治性治療的患者最多。也有學者[113]回顧性研究分析了52 823例臨床診斷為肝細胞癌患者的臨床資料,診斷前間隔6、12、24、36個月監測1次US,監測和未經監測組人員中,可接受根治性治療分別占24.3%(95%CI:23.7%~24.9%)、26.9%(95%CI:25.7%~28.2%)、22.9%(95%CI:21.8%~24.1%)、21.3%(95%CI:19.9%~22.8%)和18.3%(95%CI:17.8%~18.8%),總體來看,間隔6個月1次監測肝癌,可接受根治性治療的患者比例仍很低。在失代償期HBV相關肝硬化患者中,間隔3個月1次US聯合AFP監測肝癌,在發生肝癌的患者中,BCLC A期占66.7%;而間隔6個月監測組,BCLC A期占15.4%,兩組可根治性治療的患者分別占76.2%和36.5%[114]。一項多中心隨機對照研究[115]發現,在1278例肝硬化患者中間隔3、6個月監測肝細胞癌,共123例患者進展為肝細胞癌;監測間隔縮短至3個月,兩組患者在早期肝癌(直徑<3 cm)診斷率(79%和70%)以及局灶性結節發現率(20.4%和13.2%)中無差異,但是,3個月監測組<1 cm結節的比例為41%,顯著高于6個月1次監測組(28%)。因此,縮短監測間隔,非惡性病變檢出率較高,也可能增加了不必要的回訪。基于社區與醫院HBV或HCV感染隊列,肝硬化3~6個月監測1次,慢性肝炎6~12個月監測1次,均可延長肝癌患者的長期生存率[116]。在肝癌高發地區,50歲以上普通人群,間隔2年1次US監測比二步篩查法(第一步篩查高危人群,第二步監測肝癌)有更好的成本效益[117]。
因此,科學地對肝癌高危人群進行分層管理,采取分層的監測間隔和監測工具可能具有更高的成本效益(圖1)。
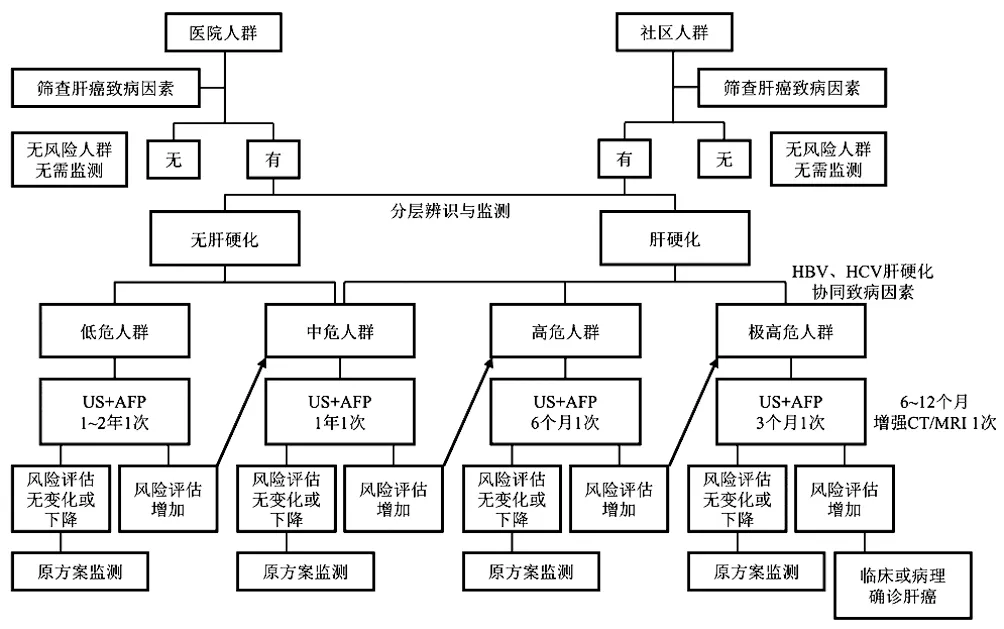
圖1 肝癌高危人群的分層篩查與監測路線圖
7.3 依從性 有研究[118-119]顯示,中晚期肝癌最主要原因是患者沒有接受肝癌篩查和監測、未接受肝癌危險因素的干預或未識別潛在的肝硬化。總的來看,在臨床實踐中僅有52%的患者有較好的依從性,能夠遵循指南或專家意見進行肝癌篩查與監測。有學者[120]分析了多中心1020例肝硬化患者肝癌監測的依從性,大部分患者如果常規檢查正常或無癥狀,無需進行監測。73.1%的患者接受了1次以上的監測;其中,1年2次監測者占37.7%,且與肝病專科醫師有關(OR=30.1,95%CI:為17.5~51.8),50%患者報告了監測的困難,包括費用(28.9%)、時間(24.1%)和交通(17.8%)。同樣,對慢性丙型肝炎患者長期治療的隊列[121]也顯示,在發生晚期肝癌患者中,13%的患者無篩查,17%的患者無隨訪,70%的患者無監測。因此,肝癌早期診斷取決于對肝癌高危患者的全病程管理、規范的監測。
7.4 召回 召回是肝癌監測過程中,提高早期診斷率最重要的策略。對US檢出≤1 cm結節患者,可在3~6個月內重復US檢查。US發現1~2 cm結節患者,采用Gd-EOB-DTPA增強MRI檢查,可提高早期肝癌與HGND的鑒別能力[84]。對于不確定的病變,仍需要進行診斷性肝活檢。
7.5 成本效益 在肝癌高危人群中,US聯合AFP監測具有較好的成本效益[122]。盡管在肝癌低危患者(年發生率<1%)6個月1次US和/或AFP監測,可發現早期肝癌,但成本效益顯著高于肝癌高危患者(年發生率>3%)[123]。因此,對肝癌高危人群進行分層管理,采取分層的監測方案是必要的[124]。但其成本效益尚需基于隨機對照或大樣本隊列研究進行評價。
推薦意見13:肝癌低危人群,1年或以上1次常規篩查監測(C2);肝癌中危人群,1年1次(C1);肝癌高危人群,6個月1次常規監測(A1);肝癌極高危人群,3個月1次常規監測,6~12個月增強CT或MRI檢查1次,以提高早期肝癌診斷率(B1)。
推薦意見14:失代償肝硬化患者肝癌風險更高,在這些患者中監測肝癌,也可延長生存時間及提高肝移植優先等候級別和預后,降低肝硬化總體病死率(C2)。
推薦意見15:肝癌篩查與監測仍存在一定程度的障礙,在慢性肝病進展為肝癌的全病程管理中,科普教育、微信或電話訪視均可提高篩查與監測的依從性(C1)。
推薦意見16:只有在足夠肝癌發生危險度、足夠樣本量的目標監測人群中,實施肝癌的分層監測方案,才可能顯示其成本效益(C1)。
8 肝癌根治術后的監測
肝癌切除術、肝移植和局部消融治療(射頻消融、微波消融、冷凍消融和高強度超聲聚焦消融等)是目前指南推薦的肝癌根治方法,是肝癌患者獲得長期生存最重要的手段[5-10]。但遺憾的是,患者術后5年肝癌復發轉移率高達40%~70%[125]。肝癌根治術后的監測是早期發現其復發轉移最重要的措施。
8.1 監測間隔 研究[126]顯示,肝癌根治術后最早復發可在術后2個月,大部分患者術后1~2年復發或轉移。肝癌復發轉移的危險因素是多方面的,包括術前存在微小的播散病灶或者是多中心的肝癌發生、肝癌致病因素未根除、HBV突變、患者心理及肝功能狀態等[127-128]。一旦早期發現肝癌復發,可以選擇再次手術切除、局部消融等,以延長患者的生存時間,提高生活質量。根治性治療后肝癌監測間隔及適宜的監測工具尚無統一的意見,也缺乏高質量的臨床證據。
8.2 肝癌復發轉移的防治 肝癌復發轉移的防治仍是臨床未解決的難題。高HBV DNA載量及肝臟炎性可導致肝細胞壞死及殘余肝細胞再生,導致較高的HBV相關肝癌的復發率[125]。有研究[129]顯示,TDF可顯著降低HBV相關肝癌患者術后5年腫瘤復發、肝移植以及死亡的風險。因此,國內外指南也推薦,NAs可用于防治HBV相關肝癌患者術后復發轉移。盡管抑制血管生成的分子靶向藥物預防根治術后肝癌復發的證據不足,但是對不符合手術切除適應證的進展期肝癌或肝癌復發,仍可以選擇索拉菲尼、侖伐替尼、安羅替尼等小分子靶向藥物,或選擇聯合治療方案(如免疫檢查點抑制劑聯合小分子靶向藥物、免疫檢查點抑制劑聯合抗血管生成靶向藥物)等,可延長患者的總體生存時間[130-131]。詳細藥物方案可參考2019年衛健委發布的《原發性肝癌診療方案》。
推薦意見17:肝癌根治性治療后的患者,2年內可參考肝癌極高危人群監測,3個月常規監測,采用增強CT或MRI檢查可發現肝癌早期復發轉移(C1);超過2年,可參考肝癌高危人群監測,6個月常規監測(C1)。
推薦意見18:有效抗病毒治療可降低HBV相關肝癌的復發與轉移(B1),ETV、TDF和TAF作為慢性乙型肝炎的一線抗病毒藥物,可防治HBV相關肝癌的復發與轉移(B1)。
推薦意見19:小分子抗血管生成等靶向藥物單藥或聯合免疫檢查點抑制劑,用于不可手術切除肝癌的治療(A1)以及根治性治療術后肝癌復發與轉移的預防(C2)。
9 尚待研究和解決的問題
(1)肝癌前疾病及癌前病變的演變規律:在肝硬化→肝硬化再生結節→LGND→HGND→早早癌→早期癌→進展期肝癌的進展過程中,缺乏特異性的早期肝癌及臨床分期的生物標志物。需要進一步研究基于人工智能的影像學大數據標志物,鑒別肝硬化再生結節與HGND及早期肝癌的臨床價值。
(2)肝癌不同危險人群的監測間隔與適宜監測工具:研發肝癌高危人群的簡便分層辨識模型,如自我監測APP。肝癌監測間隔仍需要隨機對照或大樣本隊列研究,特別是肝癌根治術后患者的監測間隔與監測工具,尚無高質量的臨床證據。
(3)在肝癌高危及極高危人群中,需要開展肝癌監測的衛生經濟學評價,以驗證在這些目標人群中,肝癌監測的公共衛生策略及長期的成本效益。
(4)無論是醫務人員還是患者,依從性仍是肝癌監測的主要障礙。
執筆專家:丁惠國(首都醫科大學附屬北京佑安醫院肝病消化中心)、屠紅(上海市腫瘤研究所癌基因與相關基因國家重點實驗室)、曲春楓(國家癌癥中心 國家腫瘤臨床醫學研究中心 中國醫學科學院北京協和醫學院腫瘤醫院分子腫瘤學國家重點實驗室免疫室)、曹廣文(海軍軍醫大學基礎醫學部流行病學教研室)、莊輝(北京大學醫學部基礎醫學院病原生物學系)、趙平(中國癌癥基金會學術部)、徐小元(北京大學第一醫院感染科)、楊永平(解放軍總醫院肝病醫學部肝癌診療中心)、盧實春(解放軍總醫院肝膽胰外科醫學部)
以上執筆專家對本文有同等貢獻。
討論專家(按姓氏漢語拼音字母排序):安紀紅(內蒙古自治區人民醫院感染科)、蔡建強(國家癌癥中心 國家腫瘤臨床醫學研究中心 中國醫學科學院北京協和醫學院腫瘤醫院肝膽外科)、蔡守旺(解放軍總醫院第一醫學中心肝膽外科)、陳國鳳(解放軍總醫院第五醫學中心肝硬化中心)、陳紅松(北京大學人民醫院肝病中心)、陳京龍(首都醫科大學附屬北京地壇醫院腫瘤介入科)、陳立剛(廈門大學附屬中山醫院消化科)、陳永鵬(南方醫科大學南方醫院感染中心)、陳煜(首都醫科大學附屬北京佑安醫院肝病中心四科)、段鐘平(首都醫科大學附屬北京佑安醫院肝病人工肝及疑難肝病中心)、鄧國宏(陸軍軍醫大學第一附屬醫院感染科)、高沿航(吉林大學第一醫院感染科)、高艷景(山東大學齊魯醫院消化科)、高月求(上海中醫藥大學附屬曙光醫院肝病科)、韓濤(天津市第三中心醫院消化科)、韓英(空軍軍醫大學第一附屬醫院消化科)、何清(深圳市第三人民醫院肝病二科)、胡瑾華(解放軍總醫院第五醫學中心肝衰竭中心)、黃緣(清華大學附屬北京清華長庚醫院肝膽胰中心)、賈繼東(首都醫科大學附屬北京友誼醫院肝病中心)、江應安(武漢大學人民醫院感染科)、姜小清(海軍軍醫大學東方肝膽外科醫院外科)、李非(首都醫科大學宣武醫院普外科)、李磊(首都醫科大學附屬北京佑安醫院肝病消化中心)、藺淑梅(西安交通大學第一附屬醫院消化科)、劉福全(首都醫科大學附屬北京世紀壇醫院介入中心)、劉景豐(福建醫科大學孟超肝膽醫院肝膽胰外科)、陸倫根(上海市第一人民醫院消化科)、陸偉(天津市腫瘤醫院消化科)、羅新華(貴州省人民醫院感染科)、閭軍(首都醫科大學附屬北京佑安醫院腫瘤內科)、馬紅(首都醫科大學附屬北京友誼醫院肝病中心)、南月敏(河北醫科大學第三醫院中西醫結合肝病科)、任萬華(山東第一醫科大學附屬省立醫院感染科)、譚林(阜陽市第二人民醫院肝病二科)、陶開山(空軍軍醫大學第一附屬醫院肝膽胰脾外科)、魏來(清華大學附屬北京清華長庚醫院肝膽胰中心)、汪靜(西南醫科大學附屬中醫醫院感染科)、王鳳梅(天津市第二人民醫院消化科)、王宏光(國家癌癥中心 國家腫瘤臨床醫學研究中心 中國醫學科學院腫瘤醫院肝膽外科)、王磊(山東大學第二醫院感染科)、溫志立(南昌大學附屬第二醫院消化科)、文天夫(四川大學華西醫院肝臟外科)、吳彪(海南省人民醫院感染科)、肖寧(中國疾病預防控制中心寄生蟲病預防控制所)、謝雯(首都醫科大學附屬北京地壇醫院肝病中心)、辛紹杰(解放軍總醫院第五醫學中心肝衰竭中心)、邢卉春(首都醫科大學附屬北京地壇醫院肝病中心)、楊積明(天津市第二人民醫院肝病科)、楊麗(四川大學華西醫院消化科)、楊玲(華中科技大學同濟醫學院附屬協和醫院消化科)、楊尹默(北京大學第一醫院肝膽外科)、易永祥(南京市第二醫院肝病中心)、尤紅(首都醫科大學附屬北京友誼醫院肝病中心)、余祖江(鄭州大學第一附屬醫院感染科)、張大志(重慶醫科大學附屬第二醫院感染科)、張國(廣西自治區人民醫院消化科)、張紅光(鎮江市第三醫院肝病科)、張明香(沈陽市第六人民醫院肝病科)、張躍新(新疆醫科大學第一附屬醫院感染科)、趙鴻(北京大學第一醫院肝病中心)、趙景民(解放軍總醫院第五醫學中心病理科)、周儉(復旦大學附屬中山醫院肝腫瘤外科)、周永健(廣州市第一人民醫院消化科)、祖紅梅(青海省第四人民醫院肝病一科)
指導專家:莊輝(北京大學醫學部基礎醫學院病原生物學系)、董家鴻(清華大學附屬北京清華長庚醫院肝膽胰中心)、賈繼東(首都醫科大學附屬北京友誼醫院肝病中心)、段鐘平(首都醫科大學附屬北京佑安醫院肝病人工肝及疑難肝病中心)、謝渭芬(海軍軍醫大學長征醫院消化內科)、趙平(中國癌癥基金會學術部)、蔡建強(國家癌癥中心 國家腫瘤臨床醫學研究中心 中國醫學科學院北京協和醫學院腫瘤醫院肝膽外科)、南月敏(河北醫科大學第三醫院中西醫結合肝病科)、魏來(清華大學附屬北京清華長庚醫院肝膽胰中心)
秘書:韓瑩(首都醫科大學附屬北京佑安醫院肝病中心二科)、高竹清(首都醫科大學附屬北京佑安醫院肝病消化中心)、杜旻(上海市腫瘤研究所癌基因與相關基因國家重點實驗室)、張雯雯(解放軍總醫院肝膽胰外科醫學部)
利益沖突:所有作者均聲明不存在利益沖突。

