缺氧誘導因子1α對肝癌細胞HepG2干細胞特性及表阿霉素敏感性的影響
趙金金, 張海光, 崔非非, 汪 磊, 莫清江, 焦路陽
新鄉醫學院第一附屬醫院 a.檢驗科, b.婦產科, 河南 新鄉 453100
肝癌在我國一直是高發性腫瘤,其致死率位居第二,僅次于肺癌[1]。干細胞具有無限增殖和多向發育的特性[2],腫瘤干細胞具有干細胞的特性,且在腫瘤的發生發展及藥物耐受方面發揮重要作用[3],目前靶向腫瘤干細胞的腫瘤治療已經成為研究的新熱點。CD133是一種細胞表面糖蛋白,與多種癌癥(包括腦、前列腺、肝癌、胰腺和結腸癌)中的腫瘤干細胞相關[4-5]。
腫瘤由于生長迅速局部通常呈現出缺氧狀態,此時缺氧誘導因子(hypoxia inducible factor,HIF)1α高表達[4]。HIF-1α對腫瘤的增殖、遷移都發揮著重要的作用[6],同時研究[7]顯示耐藥的腫瘤細胞其HIF-1α的表達水平顯著高于非耐藥細胞。缺氧時HIF-1α促進腫瘤細胞高表達CD133,以提高干細胞的比例從而使其對化療藥物耐受,這一機制已在神經膠質瘤和乳腺癌中得到證實[4-5]。但是,HIF-1α在肝細胞癌耐受化療藥物方面的研究較少,HIF-1α能否通過誘導肝癌干細胞增強其對化療藥物的耐受仍未知,因此本研究擬探討HIF-1α對肝癌細胞HepG2干細胞特性及其對表阿霉素耐藥性的影響。
1 材料與方法
1.1 細胞株、試劑與儀器 人肝癌細胞株HepG2購自中國科學院典型培養物保存委員會細胞庫,培養于5% CO2、37 ℃培養箱中,DMEM高糖培養液購自Gibco,胎牛血清購自杭州四季青,LipoFiterTM3.0 轉染試劑購自漢恒生物科技有限公司,人CD133抗體購自BioLegend,凋亡試劑盒購自eBioscience,MTT、表阿霉素購自Sigma。HIF-1α抗體購自CST,HRP標記的二抗購自Proteintech,超敏型ECL發光液購自Millipore。
1.2 實驗方法
1.2.1 細胞培養 HepG2采用含10%胎牛血清的DMEM培養液培養于5% CO2、37 ℃培養箱中,細胞生長至90%密合度時消化細胞鋪板進行實驗。
1.2.2 細胞轉染 細胞生長至90%密合度時細化鋪6孔板,每孔1×106細胞,第2天使用LipoFiterTM3.0試劑按照說明書對細胞進行轉染。實驗分為3組:不轉染質粒的HepG2組,轉染空質粒pcDNA3.0的對照組及轉染HIF-1α質粒的實驗組。
1.2.3 實時熒光定量PCR(real-time qPCR)法檢測HIF-1α基因表達 細胞轉染后48 h,吸棄培養液,每孔中加入1 ml TRIzol試劑(Invitrogen)按照說明書提取總RNA并測定RNA濃度,用反轉錄試劑盒PrimeScriptTMRT reagent Kit with gNDA Eraser(TaKaRa)進行反轉錄;將所得cDNA用TB GreenTMPrimix Ex TaqTMⅡ(TaKARa)試劑盒按照說明書進行熒光定量PCR;所用引物為HIF-1:上游引物,CCACAGGACAGTACAGGATG,下游引物,TCAAGTCGTGCTGAATAATACC;GAPDH:上游引物,GTCAACGGATTTGGTCGTATT,下游引物,ATCACTGCCACCCAGAAGACT。
1.2.4 Western Blot檢測HIF-1α表達 轉染后48 h,PBS清洗細胞,加入含有蛋白酶抑制劑的細胞裂解液,BCA法測濃度后加入5×loading buffer,SDS-PAGE電泳90 min,將蛋白條帶轉至PVDF膜,5%脫脂奶粉封閉2 h,HIF-1α抗體1∶1000稀釋后覆膜過夜,第2天TBST洗膜5次,加入二抗孵育1 h,加ECL發光液后于凝膠成像系統(Amersham Imager 600,美國GE)下拍照。
1.2.5 流式細胞術檢測CD133表達 取HepG2組、對照組、實驗組細胞各1×106個,PBS洗滌后加入含有CD133抗體的PBS 100 μl,避光染色20 min,PBS洗滌后流式細胞儀進行檢測。
1.2.6 MTT法檢測細胞活性 3組細胞消化計數后鋪96孔板,每孔1×104個細胞,第2天加入0、 6.25、 12.5、 25、 50 μmol/L的表阿霉素作用24 h后,加入20 μl 0.5 mg/ml的MTT溶液,37 ℃孵育4 h后,吸棄培養基加入200 μl DMSO,孵育10 min后測定A490。
1.2.7 流式細胞術檢測細胞凋亡 3組細胞消化計數后鋪6孔板,每孔1×106個細胞,第2天加入50 μmol/L的表阿霉素作用48 h后,收集細胞,PBS洗滌2次,加入AnnexinV-FITC抗體染色20 min,PBS洗滌后加入5 μl PI,流式細胞儀收集細胞并分析。
1.3 倫理學審查 本研究方案經由新鄉醫學院第一附屬醫院倫理委員會審批,批號:2020255。
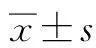
2 結果
2.1 HIF-1α成功轉染至HepG2細胞 real-time qPCR結果顯示,對照組與HepG2組相比HIF-1α mRNA表達水平無差異,實驗組HIF-1α的表達水平明顯高于HepG2組和對照組(P值均<0.001);Western Blot結果顯示,HepG2組和對照組HIF-1α蛋白基本不表達,實驗組HIF-1α高表達(圖1)。
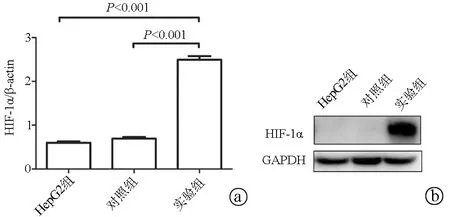
注: a,real-time qPCR檢測HIF-1α質粒在HepG2細胞的表達;b,Western Blot檢測HIF-1α質粒在HepG2細胞的表達。
2.2 3組細胞CD133表達的比較 流式細胞術檢測顯示,HepG2組及對照組細胞表面CD133陽性率分別為0.040% ± 0.003%和0.030%±0.010% ,實驗組CD133的陽性率(20.110%±0.600%)明顯高于HepG2組及對照組(P值均<0.001)(圖2)。
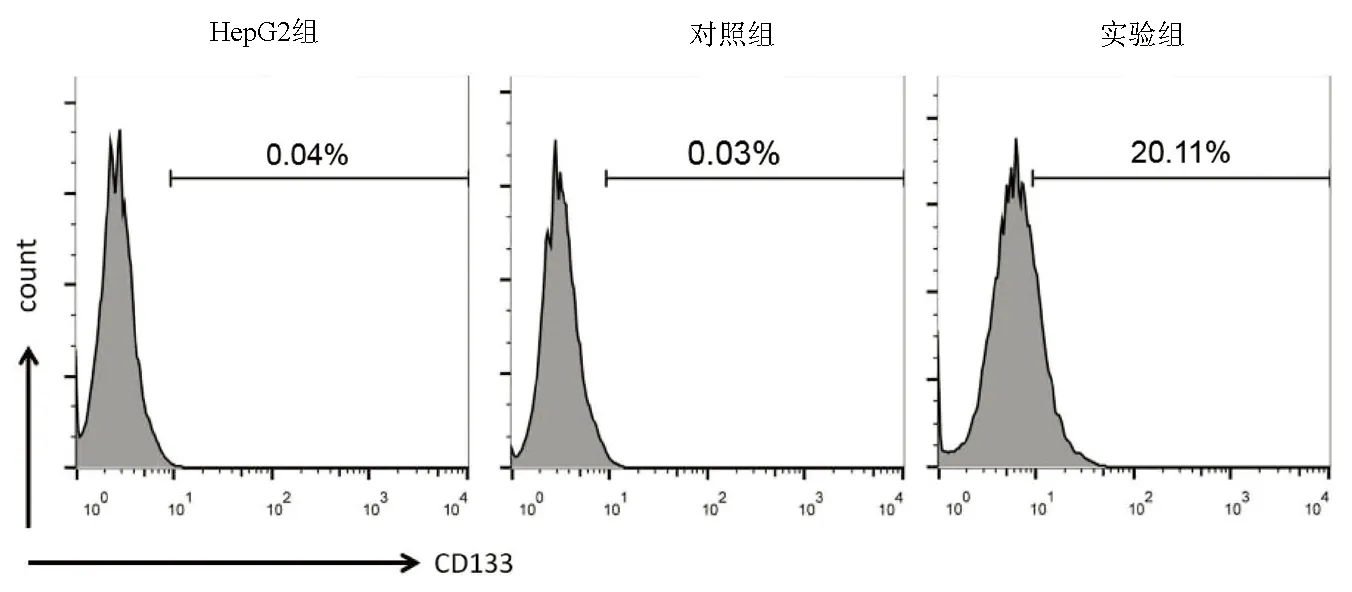
圖2 流式細胞術檢測HepG2細胞CD133表達
2.3 表阿霉素對3組細胞活性的影響 不同濃度的表阿霉素作用于3種細胞24 h后細胞活性如表1所示。低劑量的表阿霉素(6.25、12.5 μmol/L)對細胞活性影響不大,且3組細胞間差異無統計學意義(P值均>0.05);高劑量的表阿霉素(25、50 μmol/L)能夠顯著抑制HepG2組及對照組的細胞活性,但是對實驗組細胞活性影響不大,實驗組細胞活性均顯著高于對照組和HepG2組(P值均<0.05)。
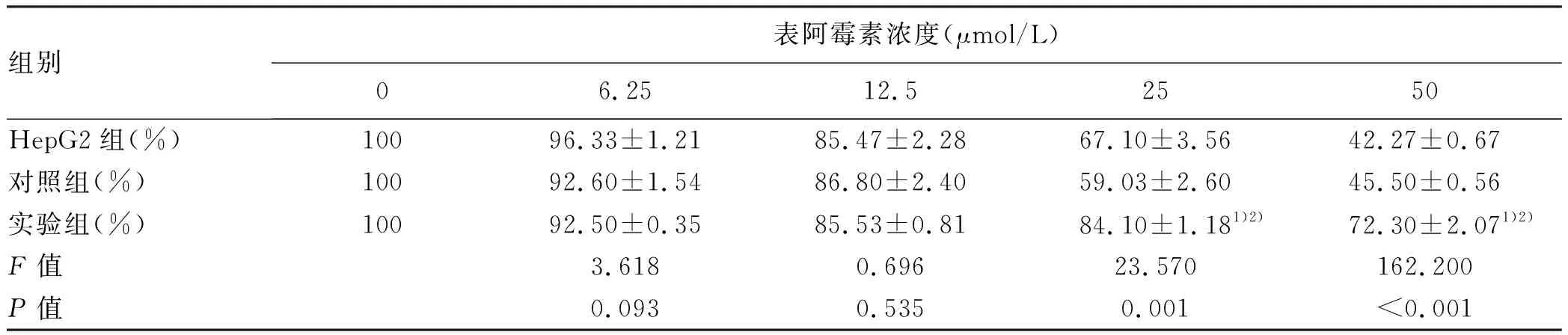
表1 不同濃度表阿霉素作用24 h的細胞活性
2.4 表阿霉素處理后3組細胞凋亡比較 50 μmol/L的表阿霉素作用于3組細胞48 h后,HepG2組及對照組的細胞凋亡比例分別為93.6%±1.5%和93.0%±1.2%,實驗組的細胞凋亡比例(67.9%±2.5%)較HepG2組及對照組明顯降低(P值均<0.001)(圖3)。
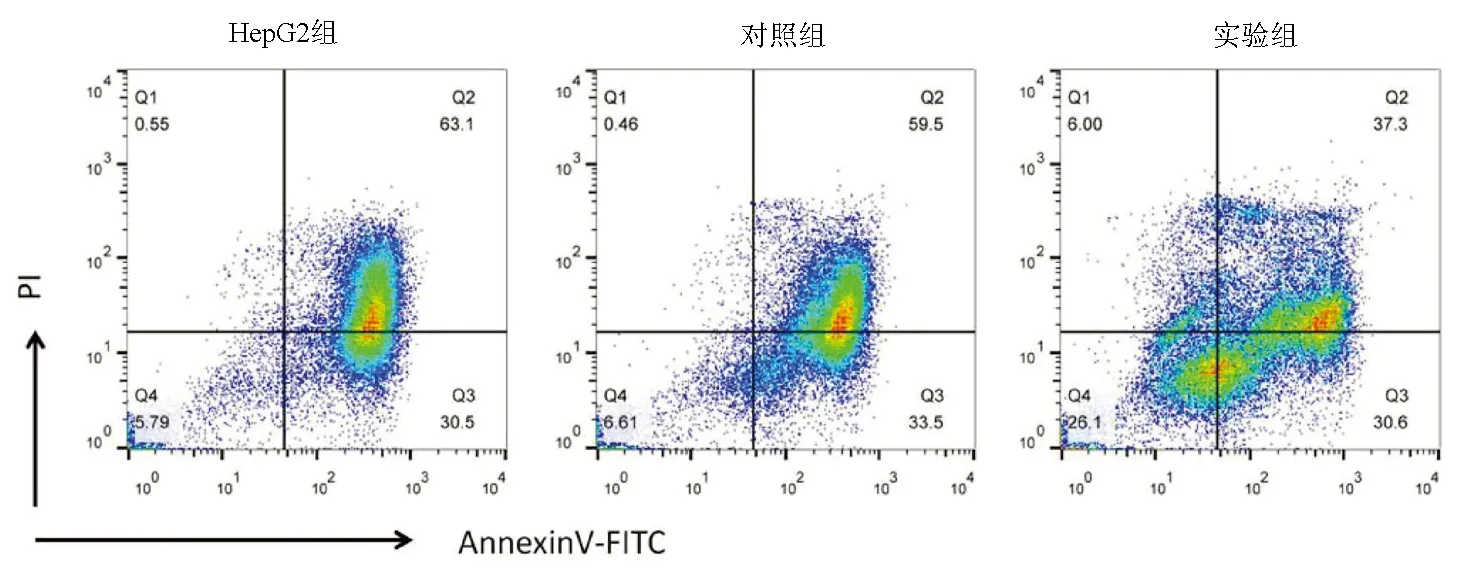
圖3 流式細胞術檢測細胞凋亡情況
3 討論
HIF-1α是細胞內重要的轉錄因子,在正常狀態下細胞表達的HIF-1α分子很快的通過泛素-溶酶體途徑被降解[8-9]。當細胞處于應激狀態,特別是缺氧時HIF-1α能夠避免降解從而發揮多種生物學功能[10]。已有研究[4-5]證明HIF-1α與腫瘤細胞的能量代謝、內皮間充質轉化、對化療藥物的耐受等過程息息相關。但是HIF-1α誘導腫瘤細胞耐藥的具體機制仍不清楚。
腫瘤干細胞被認為是腫瘤中一類能夠自我更新,維持腫瘤生長的細胞群[3]。目前公認的腫瘤干細胞標志物有CD133、CD44、CD24等[11]。腫瘤干細胞對化療藥物具有耐受性已經得到共識。缺氧時HIF-1α可以誘導Sox2、Oct4等干細胞標志物的表達[12],這些蛋白進一步調控CD133的表達,因此CD133被認為是新的干細胞標志物。在神經膠質瘤和乳腺癌中HIF-1α誘導的CD133表達同化療藥物耐受已經得到證實,并有研究[4-5]闡述了其具體機制。
表阿霉素是治療肝細胞癌的常用化療藥物,其可通過抑制細胞增殖、促進細胞凋亡進而起到抑制腫瘤發展的作用[13-14]。然而腫瘤細胞對表阿霉素的耐藥性通常使其療效降低。筆者前期研究[15]結果顯示,HIF-1α高表達時肝癌細胞的干細胞比例和對表阿霉素的耐藥性同時增加,這表明HIF-1α提高了腫瘤細胞干細胞特性并且促進其對化療藥物耐藥。通常確定腫瘤干細胞的方法有軟瓊脂實驗、克隆形成實驗、小鼠成瘤實驗以及干細胞標志物的檢測等[16]。本研究僅檢測了一種干細胞標志物,實驗結果雖略顯單薄,但也證明了干細胞比例的增加。
干細胞比例增加與表阿霉素耐受性的關系在本實驗中并未得到充分的證實,后期將對高表達HIF-1α的肝癌細胞進行CD133分子的敲低,進一步研究HIF-1α、CD133與耐藥性的關系。
本研究中選用了CD133作為肝癌干細胞的標志物,流式細胞術顯示過表達HIF-1α后CD133的陽性率顯著增加。細胞活力實驗和凋亡實驗均顯示HIF-1α能夠降低肝癌細胞對表阿霉素的敏感性。
利益沖突聲明:本研究不存在研究者、倫理委員會、受試者監護人以及與公開研究成果有關的利益沖突,特此聲明。
作者貢獻聲明:趙金金負責課題設計,資料分析,撰寫論文;張海光負責實驗操作,參與數據分析;崔非非、汪磊參與實驗操作;莫清江參與收集數據,修改論文;焦路陽負責擬定寫作思路,指導撰寫論文并最后定稿。

