TAT-E4orf4 融合蛋白對胃癌細胞增殖、遷移和凋亡的影響
殷潔烽 徐統球 張 喆 孫元水
胃癌是消化系統最常見的腫瘤之一,其發生與幽門螺桿菌感染和長期攝入腌制食品有關[1]。早期胃癌的治療方法主要有內鏡手術、腹腔鏡手術、開放手術和綜合治療。對于未發生轉移的胃癌患者,日本JGCA 指南推薦實施根治性手術[2]。然而我國早期胃癌發現率低,常錯過最佳手術時機,而僅能使用卡培他濱+順鉑/奧沙利鉑等藥物行姑息性治療[3]。化療藥物不僅價格昂貴,還可能導致惡心、嘔吐、食欲減退或骨髓增生抑制等不良反應。腺病毒早期區4 第4編碼蛋白(adenovirus early region 4 open reading frame 4 protein,E4orf4 protein)是一種新型的細胞毒因子,不僅參與腺病毒的基因剪切和表達等過程,而且能特異性殺傷癌細胞[4]。Brestovitsky 等[5]以pcDNAE4orf4 的表達載體誘導腫瘤細胞后,死亡率達到80%~90%。為研究E4orf4 對正常細胞的影響,Robert 等[6]以E4orf4 處理人來源腫瘤細胞和原代細胞,發現E4orf4 僅對腫瘤細胞具有殺傷作用,而對正常細胞作用影響很小。E4orf4 蛋白穿透細胞膜進入細胞內是E4orf4 發揮殺傷作用的前提,但是部分E4orf4 無法穿透細胞膜。轉導肽能通過內吞方式進入細胞內,而且無細胞毒性[7]。本研究通過基因工程技術構建pET28-his-TAT-E4orf4 原核表達載體,研究TATE4orf4 融合蛋白對胃癌細胞增殖、遷移和凋亡的影響。
1 實驗材料
1.2 試 劑 胰蛋白酶(批號90305)和RIMP 1640培養基(批號42401042)購自Invitrogen 公司;胎牛血清(批號10091148)購自復蒙公司。半胱氨酸天冬氨酸蛋白酶3(Caspase-3)(批號sc-7272)、半胱氨酸天冬氨酸蛋白酶9(Caspase-9)(批號sc-73548)、酪氨酸激酶Src(Sarcoma,Src)(批號sc-166860)、細胞外調節蛋白激酶(Extracellular Regulated Protein Kinases,ERK)(批號sc-271269)、磷酸化細胞外調節蛋白激酶(Phospho-Extracellular Regulated Protein Kinases,p-ERK)(批號sc-7383)、蛋白激酶B(Protein Kinase,BPKB 或AKT)(批號sc-5298)、細胞周期蛋白依賴激酶(cell division cycle 55p,CDC55p)(批號sc-1906)、酵母核苷二磷酸酶1(yeast nucleoside diphosphatase 1,YND 1)(批號sc-53506)和蛋白磷酸酶2A(protein phosphatase 2A,PP2A)(批號:sc-13601)鼠單克隆抗體購置Santa Cruz 公司,β-actin 鼠單克隆抗體(批號A01010)和HRP 標記的二抗(批號14-19-06)購自北京中杉金橋。蛋白提取試劑盒(批號BB-3101)及ECL 發光試劑盒(批號P10100)購自江蘇凱吉生物公司;BCA 試劑盒(批號P0011)、Annexin VFITC 和PI 試劑盒(批號C1067M)購自碧云天公司。
2 實驗方法
2.1 細胞培養 胃癌AGS 細胞株用含有10%的胎牛血清、1×104U/L 的青霉素和100mg/mL 的鏈霉素的RIMP 1640 培養基,置于37℃、5% CO2的CO2孵箱中培養。待細胞融合度為90%,用0.25%的胰酶消化,進行傳代,取對數期細胞進行試驗。
2.2 構建融合細胞穿膜肽的E4orf4 原核表達載體及鑒定 采用聚合酶鏈式反應(polymerase chain reaction,PCR)重組法克隆E4orf4 表達基因,將TAT 編碼序列與之融合,構建融合分子TAT-E4orf4,同樣以E4orf4 分子作對照。在兩分子兩端均加入6 個組氨酸(His)標簽。利酶切鏈接法將融合分子克隆到原核表達載體pTAT-HA,轉化到大腸桿菌DH5α,菌落PCR 篩選,酶切電泳和DNA 測序驗證。將表達載體轉化到BL21-DE3 菌株,菌落PCR 鑒定,IPTG 誘導蛋白表達,改變培養溫度和誘導時間優化表達條件,免疫印跡鑒定目的蛋白,篩選高表達蛋白菌株。先用His-tag 親和系統純化,再用離子交換層析進一步純化復性。
2.3 細胞增殖實驗 按2.1 進行細胞培養,待胃癌AGS 細胞90%融合后,胰酶消化、離心,取100μL 胃癌AGS 細胞以濃度為1×104細胞/mL 接種在96 孔板中培養24h,設置四組,每組設五個重復孔。前三組分別加入含相等濃度的pET28、pET28-his-E4orf4 和pET28-his-TAT-E4orf4 蛋白純化液,剩余一組加入等體積的RIMP 1640 培養基,設置為空白對照組。置于CO2孵箱孵育8h,每孔均加入20μL 的0.5%MTT 溶液,孵育4h 后終止培養,加入150μL 的 DMSO 后搖床上避光孵育15min。待結晶物溶解后,酶標儀檢測OD 值。細胞活性值=(實驗組平均吸光值-調零孔平均吸光值)/(對照組平均吸光值-調零孔平均吸光值)。
2.4 細胞劃痕實驗 如上設置分組,將胃癌AGS 細胞消化后離心,細胞懸液密度稀釋到2×104個/mL。將Transwell 小室置于6 孔板中,AGS 細胞懸液接種于Transwell 上室,下室加入不含血清的RMIP 1640培養基,并加入等濃度的pET28、pET28-his-E4orf4和pET28-his-TAT-E4orf4,空白對照組加入等體積的不含血清的培養基。孵育24h,經洗滌、固定、染色后,倒置顯微鏡下觀察胃癌AGS 細胞遷移的數量。隨機選取5 條直徑,在每一條直徑上選取5 個視野拍照,采用Picpic 軟件計數,比較穿過Transwell 小室的細胞平均數目。
2.5 流式細胞儀檢測細胞凋亡 如上處理胃癌AGS 細胞后,收集各組細胞,經PBS 洗滌后重懸,加入Annexin V-FITC 避光孵育。1000r/min 離心5min,棄上清,重懸細胞后,加入PI 染色液,混勻后于4℃避光孵育,再次洗滌后,立即用流式細胞儀檢測。
2.6 Western blot 檢測Caspases、Src 和CDC55p 信號通路蛋白表達 如上處理四組胃癌細胞24h,先后以PBS 液洗滌、RIPA 裂解、離心后收集總蛋白,經BCA 法定量、變性、SDS 電泳、轉膜、封閉和洗滌后,4℃過夜孵育一抗(1:1000),TBST 洗滌后,室溫孵育二抗2h(1:200)。最后TBST 洗滌,加入增強化學發光液(ECL,enhanced chemiluminescence)液,置于凝膠成像系統中檢測目的蛋白表達變化。
2.7 統計學方法 應用SPSS 17.0 統計軟件數據分析,實驗所得數據以均數±標準差()表示,上述所有實驗均重復3 次以上。采用單因素方差分析,以P<0.05 為差異有統計學意義。
3 實驗結果
3.1 pET28-TAT-E4orf4 原核表達載體的構建及誘導表達 經Xho I/Eco R 雙酶切原核表達載體后,經瓊脂糖電泳上的預期范圍內出現一條的片段(見圖1A)。通過對溫度、pH、IPTG 濃度進行優化,經SDS-PAGE 電泳分析重組蛋白的表達。結果顯示,1號、3 號、5 號和9 號菌株重組蛋白表達水平明顯高于其他菌株(見圖1B)。對上述菌株進一步培養,收集菌液,用His-tag 親和系統純化,再用離子交換層析進一步純化復性,收集重組融合蛋白進行相關實驗。
3.2 TAT-E4orf4 融合蛋白對胃癌細胞增殖的影響 采用MTT 法檢測不同刺激后胃癌AGS 細胞的增殖能力。結果顯示,相對于空白對照組(1.01±0.12),pET28 刺激后,胃癌AGS 細胞的增殖活性值為(1.03±0.26);而pET28-his-E4orf4 刺激后胃癌細胞增殖活性降低至(0.69±0.44),與pET28 組比較,差異有統計學意義(P<0.05)。融合細胞穿膜肽后(pET28-his-E4orf4 刺激),細胞增殖活性進一步下降,達到(0.41±0.06),與前兩組比較,差異均有統計學意義(P<0.05)。
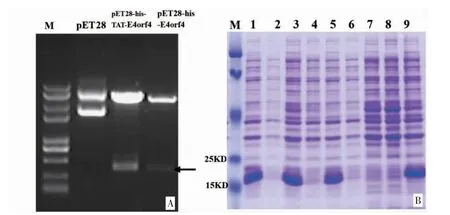
圖1 pET28-TAT-E4orf4 表達載體的鑒定及誘導
3.3 TAT-E4orf4 融合蛋白對胃癌細胞遷移的影響 Transwell 實驗結果發現,空白對照組的穿過Transwell 小室的細胞數目為(796.48±114.35)個,pET28 刺激后,穿過小室的細胞數目為(803.71±127.39)個,二者比較,差異無統計學意義(P>0.05)。經pET28-his-E4orf4 刺激后,AGS 細胞減少至(287.06±78.51)個,與前兩組比較,差異有統計學意義(P<0.05)。而pET28-his-TAT-E4orf4 刺激,穿過小室的細胞數目僅為(163.21±36.77)個,與pET28-his-E4orf4 組比較,差異有統計學意義(P<0.05),見圖2。

圖2 TAT-E4orf4 融合蛋白對胃癌細胞遷移的影響(標尺=200μm)
3.4 TAT-E4orf4 融合蛋白對胃癌細胞凋亡的影響流式細胞儀檢測結果發現,AGS 細胞凋亡率的變化趨勢與MTT 結果相一致。空白對照組胃癌AGS 細胞的凋亡率為6.28%,pET28 刺激后胃癌AGS 細胞的凋亡率無明顯增加。而pET28-his-E4orf4 刺激后,胃癌AGS 細胞上升至20.50%。而pET28-his-E4orf4 刺激后,凋亡率進一步增加,達到33.40%。見圖3。
3.5 TAT-E4orf4 融合蛋白對胃癌細胞Caspase-3 和Caspase-9 表達的影響 采用Western blot 檢測Caspase-3 和Caspase-9 的表達變化。經PET28、PET28-his-E4orf4 和PET28-his-TAT-E4orf4 刺激胃癌AGS 細胞后,Caspase-3 表達水平無明顯變化,與Blank 組比較,差異無統計學意義(P>0.05)。與Caspase-3 變化趨勢相似,四組胃癌AGS 細胞的Caspase-9 的表達水平差異也無統計學意義(P>0.05),見圖4。

圖3 TAT-E4orf4 融合蛋白對胃癌細胞凋亡的影響

圖4 TAT-E4orf4 融合蛋白對Caspase-3 和Caspase-9 表達的影響
3.6 CPP-E4orf4 對胃癌細胞Src 信號通路蛋白表達的影響 PET28 刺激胃癌AGS 細胞后,Src 表達水平無明顯變化,而pET28-his-E4orf4 刺激后Src 表達水平明顯下降,與空白對照組和PET28 組比較,差異有統計學意義(P<0.05)。而融合細胞穿膜肽后,胃癌AGS 細胞的Src 表達水平進一步下降,與pET28-his-E4orf4 組比較,差異有統計學意義。與Src 變化趨勢相反,pET28-his-E4orf4 和pET28-his-TATE4orf4 刺激胃癌AGS 細胞后ERK、p-ERK 和AKT表達水平均下降,而后者的下降趨勢更明顯,差異有統計學意義(P<0.05)。見圖5。
4 討論
胃癌細胞增殖和凋亡間的平衡紊亂是胃癌發生發展的重要分子機制[8]。胃癌細胞凋亡主要通過細胞內和細胞外兩大途徑,前者是由死亡信號誘導線粒體釋放細胞色素C,與Caspase-9 形成凋亡復合體,使Caspase-9 酶原活化并釋放,進而激活Caspase-3及其下游信號蛋白,而后者又包含Fas/Fas 配體、Caspase 家庭蛋白以及Src 介導的相關信號通路等途徑[9-10]。

圖5 細胞穿膜肽對Src-ERK-AKT 信號軸的影響
研究發現,胃癌組織促凋亡蛋白Caspase-3 表達含量明顯低于癌旁組織[11]。有不少研究者試圖通過生物治療、放射治療、細胞毒類藥物和中醫中藥等多種方法來誘導胃癌細胞凋亡,抑制其增殖。Kim 等[12]報道低劑量的順鉑可激活Fas 受體,使Caspase-3 表達增加,促進胃癌細胞凋亡。Nishimura 等[13]利用腺病毒構建Caspase-8 表達載體,導入胃癌細胞株,其凋亡率顯著增加。亦有研究證實Src 介導的相關信號通路在抑制腫瘤發生發展及影響細胞凋亡等生物學行為方面具有重要影響,靶向沉默Src 相關信號通路可調控胃癌細胞侵襲和遷移[14]。
近年發現部分溶瘤病毒編碼的某些特殊蛋白具有很好的抗腫瘤作用,如雞貧血病毒編碼的凋亡素、自主細小病毒編碼的非結構蛋白1 和腺病毒編碼的E4orf4。其中,以E4orf4 研究最為深入。E4orf4 是由人腺病毒基因早期第4 轉錄區第4 開放讀碼框編碼產生,含114 個氨基酸殘基。E4orf4 蛋白與PP2A 或Src等分子伴侶作用,誘導細胞死亡[15]。E4orf4 與PP2A的B55 亞基的結合,能激活mTOR 信號通路,調控蛋白翻譯。此外,Src 家族激酶可使E4orf4 發生磷酸化,繼而在細胞質和細胞膜上聚集,導致雙核肌動蛋白-肌球蛋白網絡的組裝重塑,細胞膜起泡,最終引起細胞死亡[15]。Zhou 等[16]構建EGF-E4orf4 表達載體,刺激胃癌BCG-823 細胞株后,結果發現BCG-823 細胞的增殖能力顯著下降,對轉移瘤小鼠的抑制率達到49%。另有文獻報道,E4orf4 蛋白與分子伴侶Src相互作用可抑制Src-ERK-AKT 信號通路的激活,降低下游促凋亡蛋白(the proapoptotic BH3-onlyprotein,BAD)的磷酸化,增強BAD 與早期凋亡蛋白(Bcl-2 和Bcl-xl)相互作用,促進細胞凋亡[17]。
上述研究證實,E4orf4 對胃癌細胞具有很好的殺傷作用,而E4orf4 穿過細胞膜是其發揮作用的前提。目前常用其他試劑來增強細胞通透性,破壞細胞穩態。TAT 轉導肽是來源于HIV 轉錄活化蛋白tat 的11 肽,通過內吞方式進入細胞內。將TAT 與目的蛋白制成的融合蛋白轉導效率幾乎可達到100%,而且無明顯細胞毒性。基于上述研究現狀,本研究將細胞穿膜肽與E4orf4 融合,構建pET28-his-TAT-E4orf4原核表達載體,分析TAT-E4orf4 融合蛋白對胃癌細胞增殖、遷移和凋亡的影響。結果發現,增加細胞穿膜肽后E4orf4 能顯著抑制胃癌AGS 細胞增殖和遷移,促進AGS 細胞凋亡。Western blot 結果發現E4orf4 對胃癌細胞的殺傷作用及對凋亡的影響與Caspase 信號通路無關,但E4orf4 能活化Src-ERKAKT 信號通路,介導AGS 細胞凋亡,從而發揮抗腫瘤的效應。

