多模態磁共振成像在評估宮頸鱗癌病理分級和分期中的價值
劉濟人,胥毅,郭麗美,司鵬,郭娟*
作者單位:1.山西醫科大學第三醫院(山西省白求恩醫院山西醫學科學院)腫瘤中心,太原030032;2.山西醫科大學第二醫院影像科,太原030001;3.山西醫科大學第三醫院(山西省白求恩醫院山西醫學科學院)影像中心,太原030032
子宮頸癌是女性生殖系統最常見的惡性腫瘤,嚴重威脅女性的生命安全,且發病年齡趨于年輕化[1,2]。其中鱗癌是最常見的病理分型,約占70%。惡性腫瘤的分期是評價其嚴重程度、判斷預后和轉歸、選擇合適的初始治療模式以及個體化手術方案最重要的影響因素。對于不同分期的宮頸癌,采用的治療方案也均有不同。早期(Ⅰ-ⅡA)宮頸癌患者首選手術治療,而根治性同步放化療是中晚期(ⅡB-ⅣA)宮頸癌患者的首選治療方式[3-5]。此外,病理分級也是評價宮頸癌生物學行為及預后的重要指標,低分化宮頸鱗癌較中高分化宮頸鱗癌更易產生放化療抵抗,且具有更高的轉移率、復發率[6,7]。因此術前準確評估宮頸鱗癌的病情,對臨床制訂個性化精準診療計劃及提高預后具有重要意義[8]。
磁共振成像具有較高的軟組織分辨率,并可通過多方位、多參數成像對腫塊位置、大小等形態學特點進行全面觀察,是診斷宮頸癌的首選影像學檢查[9]。但常規MRI 缺乏標準的可視化參數,因此在宮頸癌的病理分級及分期評估中存在一定的局限性。隨著磁共振技術的發展,定量磁共振技術可在無創性觀察組織或器官解剖結構的同時獲得反映腫瘤組織功能狀態的定量指標,對疾病進行更全面、客觀的評估。以往研究表明擴散加權成像(diffusion weighted imaging,DWI) 和動態對比增強MRI(dynamic contrast enhanced MRI,DCE-MRI)在評估宮頸癌病理分級、分期以及預后方面具有一定的價值[10-12]。Winfield 等[13]報道低分化宮頸癌的表觀擴散系數(apparent diffusion coefficient,ADC)明顯低于中高分化宮頸癌。但是ADC 僅反映與組織細胞密度相關的水分子擴散受限程度等信息,不能全面反映腫瘤異質性信息。DCE-MRI 可通過細胞外順磁性示蹤劑的分布獲得容積轉運常數(Ktrans)和速率常數(Kep),用于評估腫瘤新生血管與微血管通透性等組織微循環特點[14]。但是需要注射對比劑且圖像后處理較復雜,在臨床應用方面具有一定的限度。近年來,磁共振弛豫定量技術逐漸應用于臨床。T1 mapping 是描述組織縱向弛豫時間的定量技術,通過對組織的固有特性的測量獲得反映組織成分及病理學信息,可對疾病進行更客觀的評價,為腫瘤評估提供了新的技術手段[15]。T1 值已被用于前列腺癌與炎性病變的鑒別[16]以及腦膠質瘤病理分級的評估[17]。然而,T1 值對于宮頸鱗癌的病理分級及分期的預測少有報道。本研究目的是以DWI 和DCE-MRI 為參考,定量分析T1值對評估宮頸鱗癌病理分級及分期的應用價值,以期為宮頸癌提供更多依據指導治療。
1 材料與方法
1.1 一般材料
回顧性分析2020 年3 月至2021 年2 月于山西醫科大學第二醫院就診的宮頸病變患者病例。納入標準:(1)病理診斷為鱗癌;(2)患者術前行T1 mapping、DWI 及DCE-MRI 序列掃描。排除標準:(1)圖像偽影重;(2) MRI 掃描檢查前接受與腫瘤相關的治療。最終符合上述標準患者65 例。其中高分化組11 例,年齡34~75 歲,平均年齡為60.0 歲;中分化組32 例,年齡30~78 歲,平均年齡為56.9 歲;低分化組22 例,年齡38~74 歲,平均年齡為55.9 歲。根據FIGO(International Federation of Gynecology and Obstetrics) 2018[18]分期如下:ⅠB1 5 例,ⅠB2 11 例,ⅠB3 6例,ⅡA 15例,ⅡB 7例,ⅢA 8例,ⅢB 6例,ⅢC 5例,Ⅳ2例,其中早期組(ⅠB-ⅡA期) 37例,晚期組(ⅡB-Ⅳ期) 28例。本研究獲得山西醫科大學第二醫院倫理委員會批準(倫理批件號:2021YXD024)并免除受試者知情同意。
1.2 數據采集
使用3.0 T MRI 掃描儀(GE Pioneer)及腹部相控陣表面線圈進行掃描。患者膀胱適度充盈,自由呼吸,腹帶加壓以減少呼吸偽影。先行常規MRI 掃描,包括軸位T1WI、T2WI、脂肪抑制T2WI,矢狀位T2WI以及冠狀位T2WI。矢狀位擴散加權成像參數:TR/TE 4800 ms/73.9 ms;層厚/層間距4 mm/1 mm;矩陣140×70;FOV 24 cm×12 cm;b 值50,800 s/mm2。矢狀位多對比度一站式弛豫定量技術掃描參數:TR 4000 ms;TE1/2 21.59/96.4 ms;TI 210,610,1810,3810 ms;翻轉角90/110°;層厚/層間距4 mm/1 mm;FOV 26 cm×26 cm;矩陣320×192。矢狀位動態增強掃描參數:TR 6.4 ms;TE 1.9 ms;層厚2.5 mm;FOV 26 cm×26 cm;矩陣260×224,共采集50 次,增強掃描對比劑為釓雙胺(Gadodiamide,GE),高壓注射器以3 mL/s 速率注射,劑量為0.1 mmol/kg,并配合20 mL生理鹽水助推。
1.3 圖像分析
通過后處理工作站的相關軟件對圖像進行后處理獲得T1、ADC、Ktrans和Kep定量參數圖。兩名影像科醫師分別獨立勾畫ROI 并取測量的平均值作為最終測量值。以矢狀位T2WI 作為參考圖像,選取腫瘤最大層面,沿腫瘤邊界手動勾畫感興趣區(region of interest,ROI),避開壞死、囊變區,獲得相應的定向參數:縱向弛豫時間(T1,ms)、ADC (mm2/s)、容積轉運常數(Ktrans,min-1)和速率常數(Kep,min-1)值。
1.4 統計學分析
應用SPSS 21.0 進行統計學分析。采用組內相關系數(intraclass correlation efficient,ICC)評價兩位放射科醫師各參數測量結果的一致性,ICC>0.75 認為具有良好的一致性。正態分布計量資料采用均數±標準差(±s)表示。應用單因素方差分析評估不同病理分級之間定量參數值的差異,兩兩比較采用LSD 法。應用獨立樣本t檢驗分析早期組與晚期組間的差異。采用受試者工作特征(receiver operating characteristic,ROC)曲線確定診斷宮頸鱗癌病理分級以及分期的診斷效能,計算曲線下面積(area under the curve,AUC),根據約登指數確定各參數的最佳診斷界值、敏感度和特異度。P<0.05表示差異有統計學意義。
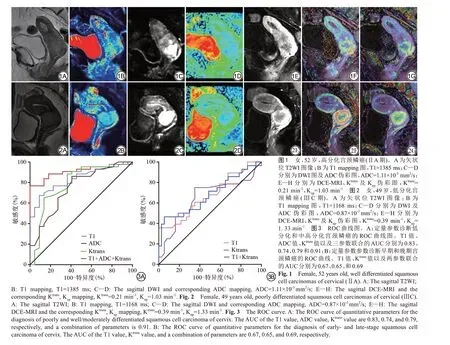
2 結果
2.1 多模態定量參數評估宮頸鱗癌病理分級和分期
T1、ADC、Ktrans和Kep測量值的ICC 分別為0.973(95%CI:0.956~0.984)、0.984 (95%CI:0.974~0.990)、0.990 (95%CI:0.984~0.994) 和0.947(95%CI:0.915~0.968)。低分化組、中分化組以及高分化組的T1 值分別為(1163.64±63.82) ms、(1273.27±116.46) ms、(1331.95±97.81) ms,ADC值分別為(0.91±0.15)×10-3mm2/s、(1.04±0.13)×10-3mm2/s、(1.07±1.78)×10-3mm2/s,Ktrans值分別為(0.43±0.15) min-1、(0.30±0.11) min-1、(0.28±0.05) min-1,Kep值分別為(1.28±0.39) min-1、(1.16±0.42) min-1、(1.19±0.45) min-1。單因素方差分析結果表明,3組之間的T1、ADC、Ktrans值差異存在統計學意義(P均<0.05),Kep值差異無統計學意義(P=0.550),見表1,圖1、2。在比較早期組與晚期組宮頸鱗癌中,T1 和Ktrans值的差異有統計學意義(P<0.05),ADC 和Kep值的差異均無統計學意義(P>0.05),見表1。

表1 宮頸鱗癌不同病理分級和分期定量參數比較Tab.1 Comparison of quantitative parameters among different histologic grade and stage of cervix squamous cell carcinoma
2.2 定量參數鑒別宮頸鱗癌病理分級及分期的診斷效能
以T1、ADC 和Ktrans值作為診斷指標繪制ROC 曲線,診斷低分化宮頸癌鱗的AUC 分別為0.83、0.74 和0.79,診斷界值分別為1226.25 ms、0.91×10-3mm2/s和0.30 min-1。三個參數聯合的診斷效能最高,AUC值為0.91,見表2、圖3A。以T1和Ktrans值作為診斷指標繪制ROC 曲線,診斷早期宮頸鱗癌的AUC 分別為0.67 和0.65,診斷界值分別為1149.25 ms 和0.29 min-1。T1和Ktrans聯合后診斷效能為0.69,見表2、圖3B。
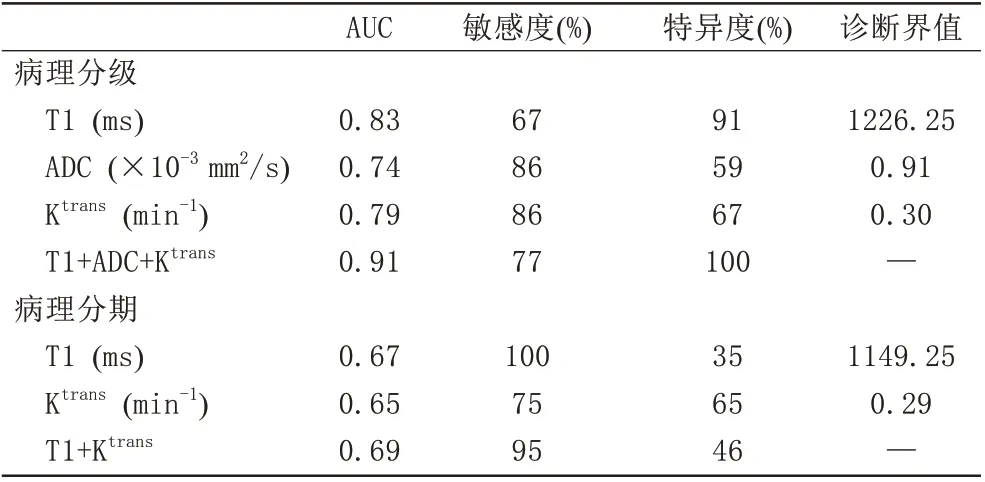
表2 定量參數對宮頸鱗癌病理分級及分期的診斷效能分析Tab.2 Diagnostic performance of quantitative parameters for histologically grading and staging squamous cell carcinoma of cervix
3 討論
本研究以DWI 和DCE-MRI 的定量參數為參考探討了定量參數T1值在預測宮頸鱗癌病理分級及分期的價值。研究結果顯示隨著分化程度的降低以及分期的升高,宮頸鱗癌的T1 值降低,且診斷效能高于ADC和Ktrans值,說明T1值在評估宮頸鱗癌病理分級及分期中具有一定的意義。此外研究發現三參數聯合的診斷效能高于單個參數,表明多參數聯合能夠進一步提高宮頸鱗癌病理分級和分期術前評估的準確性。T1 值可作為一種有效的影像學手段對宮鱗癌的病理分級和分期進行評估,多參數聯合可為臨床醫師選擇治療方案提供更全面、準確的信息。
3.1 定量參數預測宮頸鱗癌病理分級及分期
縱向弛豫時間(T1-relaxation time)是磁共振軟組織對比度的關鍵來源之一,是反映組織固有物理特性的參數值。其最早應用于心血管成像,在心肌水腫、纖維化及浸潤性疾病的診斷、治療及預后過程中都發揮了極大的作用[15,19]。T1 值受細胞組織密度、蛋白質、多肽等大分子含量、組織含水量及微壞死等多種因素影響,可以從分子水平反映組織的生理學和病理學變化,有助于對疾病發生、發展的病理狀態進行更客觀的評估[20]。因此近年來逐漸應用于定量評價前列腺癌[21]、乳腺癌[22]、腦膠質瘤[23]等惡性腫瘤。Adams 等[24]研究結果表明T1 值可作為反映腎透明細胞癌病理分級的內在標志物,且與腫瘤組織細胞外基質呈正相關。Peng等[25]利用T1值評估肝細胞癌的分化程度,結果顯示低分化肝細胞癌的T1 值明顯低于中高分化肝細胞癌。本研究結果與以往研究結果一致,發現隨著分化程度的降低,宮頸鱗癌T1 值降低。分析原因為宮頸鱗癌組織中,腫瘤的分化越差,細胞增殖越快,細胞核越大,核異質性明顯,核漿比會越大,細胞間隙縮小,水含量減少,導致組織T1 弛豫時間縮短[26]。此外,腫瘤細胞的快速增殖導致組織微壞死增多,伴隨著微壞死出現的復雜的順磁性原子及蛋白質也會導致T1弛豫時間縮短[27]。張斐斐等[28]利用T1 mapping評估宮頸癌分化程度,結果顯示低分化宮頸癌T1 值低于中高分化宮頸癌,但是差異無顯著統計學意義。這可能與研究對象同時包括鱗癌和腺癌有關。由于不同病理組織類型宮頸癌之間的T1值可能存在差異,所以本研究只納入了鱗癌,未將腺癌納入分析。在評估宮頸鱗癌分期中,T1 值與分期呈反比,隨著分期的升高,T1 值有所降低。這可能是由于不同分期腫瘤間大分子濃度、水結合狀態和組織含水量等多種生物學因素影響所致[28]。以上結果說明,T1 值能夠評估宮頸鱗癌的惡性程度。與T1 mapping 不同,DWI 和DCE-MRI 通過反映組織內水分子擴散狀態和血液灌注信息,用于良惡性病變的鑒別、惡性腫瘤分化程度的評估。本研究中的ADC值隨著宮頸鱗癌分化程度的降低和分期的升高呈降低趨勢[11],Ktrans則相反[29]。
3.2 定量參數評估宮頸鱗癌病理分級及分期的診斷效能
對比ADC和Ktrans值,T1值在預測宮頸鱗癌病理分級和分期方面具有更高的診斷效能,表明T1 值優于ADC 和Ktrans值,但仍需大樣本研究驗證。不同的定量參數從不同方面反映生物組織特性,因此多參數聯合較單個參數能夠提供更全面的腫瘤病理特征的詳細信息。Baur 等[30]在評估前列腺良惡性腫瘤發現結合T1 和ADC 值的診斷效能優于單個參數。同樣,在胰腺炎和導管腺癌鑒別診斷中,T1、T2 和ADC 值多參數聯合較單個參數獲得了更高的AUC、敏感度、特異度和準確度,且差異具有統計學意義[31]。本研究結果也表明三種參數聯合診斷效能高于單獨參數值,說明多參數聯合改善了單獨使用一種技術的缺點,能更加全面、準確及定量診斷和評估宮頸鱗癌的病理分級及分期。
3.3 本研究的局限性
本研究存在一定的局限性。第一,本研究樣本量較小,需要更大的樣本量來驗證我們的結果。第二,參考既往文獻,為避免不同病理類型宮頸癌之間的差異的影響,本研究僅選用宮頸鱗癌作為研究對象。未來還需納入更多的宮頸癌病理學類型進行研究。第三,本研究未討論T1 值與組織細胞外體積分數等內在病理生理學指標的相關性。計劃在未來的擴展研究中,納入病理指標進行分析。
綜上所述,T1 mapping 技術可獲得反映組織縱向弛豫時間的定量數據,在一定程度上反映宮頸鱗癌的病理分級及分期,有助于預測其惡性程度,聯合DWI 和DCE-MRI 參數能夠進一步提高評估的準確性,為臨床治療方案的選擇和預后評估提供更可靠的影像學信息。
作者利益沖突聲明:全部作者均聲明無利益沖突。

