砧木類型對甜櫻桃花芽多胺代謝相關基因表達和休眠的影響
屈玥婷,劉勛菊,王繼源,陳秋菊,糾松濤,張才喜
(上海交通大學 農業與生物學院,上海 200240)
甜櫻桃(PrunusaviumL.)是薔薇科李屬的落葉果樹。在冬季來臨時落葉果樹的花芽通常會進入休眠的狀態以抵御嚴寒的天氣。只有成功地度過冬季休眠,才能在春季正常開花結果,因此甜櫻桃的花芽休眠是其生長發育過程中重要的生理過程。Lang等[1]根據休眠的誘因將休眠分為類休眠、內休眠和生態休眠。類休眠是指植物休眠結構、組織或器官受到相鄰器官的抑制而不能正常萌發生長的現象;內休眠是指植物受休眠結構內部生理生化因素的制約,即使有適宜的外界環境也不能正常萌發生長的現象;生態休眠是指植物受到外部環境的制約而引起的休眠,如低溫和水分脅迫等,如果條件適宜就可以恢復生長。
先前的研究表明,除光照和溫度等因素外,砧木類型也能影響果樹休眠的進程[2]。趙丹丹[3]研究發現,‘豐水’梨葉芽的休眠進程與其砧木的需冷量有關,高需冷量的砧木能延緩休眠進程,而低需冷量的砧木能加快休眠進程。李璇等[4]的研究發現,‘豐水’梨嫁接在不同砧木時葉芽的休眠進程不同,嫁接于‘豆梨’的葉芽休眠結束時間早于‘杜梨’且其內部多胺的含量變化符合休眠進程的變化,表明梨葉芽的休眠進程與砧木的種類及其內部多胺代謝相關。汪曉云等[5]對油桃砧木的研究表明,砧木能夠影響接穗的萌芽開花和果實成熟。
多胺是植物體在代謝過程中產生的一類小分子有機化合物,植物體內最豐富的幾種多胺是腐胺(Put)、亞精胺(Spd)和精胺(Spm)[6-9]。在高等植物中,多胺參與許多生理過程,如花發育和果樹休眠等。范克欣[10]研究發現,Put能夠促進桃樹的花芽進入休眠,而Spd和Spm含量升高能夠促進花芽解除休眠。Mohamed等[11]研究表明,在休眠期間葡萄芽內Spm和Spd的含量水平較低,Put含量處于較高的水平,休眠結束后多胺的含量則相反的變化。精氨酸是多胺合成的重要前體,Edwards等[12]研究發現,向還未成花的蘋果外源施用精氨酸,對蘋果成花的過程能夠起到促進作用。此外,干旱和低溫的脅迫環境能夠提高柑橘和檸檬內的精氨酸含量從而提高多胺的含量促進成花的過程[13]。Wang等[14]早在1985年就比較了早花甜櫻桃花芽(EB)與晚花山櫻桃花芽(LB)內的多胺含量,在休眠階段LB內的多胺含量始終保持較高的水平且波動不明顯,而EB內多胺雖然含量較低,但在緩慢穩定地增加。休眠結束時,2種類型的花芽內的多胺含量都有所增加,之后才開始出現明顯的生長變化。
在植物體中,Put的合成途徑有兩條:一條是鳥氨酸脫羧酶(ODC)反應途徑,另一條是精氨酸脫羧酶(ADC)脫羧反應途徑[13]。精氨酸脫羧酶反應途徑中,以精氨酸作為反應前體,在ADC的作用下生成Put,Put同時也是Spm和Spd的合成原料。S-腺苷甲硫氨酸脫羧酶(SAMDC)在Spd和Spm的合成過程中也起到了重要作用。多胺的主要分解過程是通過二胺氧化酶(DAO)和多胺氧化酶(PAO)實現的。PAO將Spd和Spm氧化分解生成二氨基丙烷和1-(3-丙氨基)-丙氨酸。因此,多胺氧化酶(PAO)、精氨酸脫羧酶(ADC)和S-腺苷甲硫氨酸脫羧酶(SAMDC)是多胺代謝過程中的關鍵酶。
前期田間調查發現,同一品種嫁接在不同砧木類型(喬化和矮化)上,其休眠進程和花期存在顯著差異。目前,關于此現象還未見相關研究和報道。本試驗將從甜櫻桃多胺代謝過程中的關鍵基因PavPAO、PavADC和PavSAMDC以及多胺含量變化等方面開展相關研究,探究砧木類型對甜櫻桃多胺代謝過程以及休眠和開花進程的影響機理,
1 材料與方法
1.1 植物材料
本實驗采用嫁接于喬化砧木‘馬扎德’(Mazzard)和矮化砧木‘吉塞拉6號’(Gisela 6, G6)的7年生的甜櫻桃品種‘羅亞理’。Mazzard是世界上廣泛使用的一種喬化的櫻桃砧木[15],其幾乎與所有甜櫻桃和酸櫻桃品種親和,且對惡劣的土壤環境具有較強的適應性[15]。G6是親本為酸櫻桃和灰毛葉櫻桃的半矮化砧木,樹體比Mazzard小20%~30%,其優點是開花早且結果量較大,能夠適應各種類型的土壤[16],對李矮縮病毒(PDV)和李屬壞死環斑病毒(PNRSV)有較好的抗性[17]。實驗材料種植于上海交通大學浦江綠谷基地(31.25°N,121.48°E)。所采取的樣品為Mazzard和G6砧的‘羅亞理’一年生枝條的花芽,采樣階段為休眠期到初花期。將采得樣品于液氮中冷凍,置于-80 ℃冰箱內儲存。
1.2 方 法
1.2.1 形態學觀察花芽的統計:隨機選取嫁接于2種砧木的‘羅亞理’各3棵樹的一年生枝條10根,將所有芽縱切觀察內部是花芽或是葉芽,統計每根枝條的花芽分化的百分率,利用Origin做圖。
枝條和樹體的形態學觀察:利用直尺和卷尺等工具對距地面20 cm處樹體的粗度和高度進行測定,比較嫁接于喬化和矮化砧木上的樹體發育差別。
物候期觀察:在休眠的不同時期進行拍照記錄,數據的初步統計采用 Origin進行處理。
1.2.2PavPAO和PavADC基因的克隆及系統發育分析取100 μg花芽利用液氮進行研磨,采用RNAprep Pure多糖多酚植物總RNA提取試劑盒(天根 DP411),根據產品說明書提取花芽總RNA。以總RNA為模板,參照TaKaRa的PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)試劑盒說明書反轉錄合成cDNA。參考NCBI網站(https://www.ncbi.nlm.nih.gov/)進行基因序列的預測,隨后利用軟件Primer 5.0進行引物設計(表1,1~4)。以cDNA為模板進行PCR擴增后將所得產物利用pEASY?-Blunt進行載體構建,最后送至公司進行測序。
利用MEGA 6.0軟件進行系統進化分析,利用DNAMAN軟件進行蛋白序列比對。利用在線網站http://netbio.sjtu.edu.cn/對PavADC的互作蛋白進行預測。
1.2.3 多胺含量測定采用HPLC方法對花芽多胺含量進行分析,運行程序、樣品前處理方法和標品衍生處理方法參照吳琴燕等[18]并稍作改進。本實驗采用Waters高效液相色譜儀進行測定,色譜柱為安捷倫SB-Aq,流動相為60∶40的甲醇和水,檢測波長為230 nm,流速0.8 mL/min,柱溫30 ℃。Put、Spd和Spm標準品均為Tmstandard的產品。
(1)植物樣品前處理方法:取0.5 mg花芽樣品液氮研磨,加入4 mL預冷的5%高氯酸溶液冰浴浸提1 h,4 ℃ 1 200 r/min離心30 min后取500 μL上清液加入7 μL苯甲酰氯,混勻后加入2 mol/L NaOH 溶液1 mL,渦旋20 s后置于37 ℃水浴鍋反應30 min,取出后加入2 mL飽和NaCl溶液終止反應,再加入2 mL乙醚進行萃取,震蕩混勻后1 500 r/min離心5 min,吸取1 mL醚相,于超凈工作臺吹干,-20 ℃冰箱儲存,用時加入400 μL色譜級甲醇溶解上機。
(2)標品衍生處理方法:取配置好的標品共1 mL,加入20 μL苯甲酰氯,混勻后加入2 mol/L NaOH溶液1 mL,30 ℃水浴反應40 min,取出后加入2 mL飽和NaCl溶液終止反應,再加入3 mL乙醚進行萃取,混勻后15 000 r/min離心5 min,吸取1.5 mL醚相,于超凈工作臺吹干,-20 ℃冰箱儲存,用時加入500 μL色譜級甲醇溶解上機。
1.2.4 熒光定量PCR參考TB GreenTMPremix Ex TaqTMⅡ試劑盒的使用步驟,利用Bio-Rad iQ5(Hercules, CA, USA)熒光定量PCR儀檢測目的基因的表達水平。運行程序如下:95 ℃預變性3 min,95 ℃ 10 s,55 ℃ 30 s的程序進行39個循環,試驗設置3次重復。利用軟件Primer 5.0設計引物(表1, 5~10)。以β-actin作為內參基因,利用2-ΔΔCT的方法[19]對熒光定量的結果進行分析得到各個時期基因表達量。
1.2.5 PavPAOs和PavADC的亞細胞定位將3個PavPAOs和PavADC基因連接到pHB載體上,再將構建好的載體轉入GV3101農桿菌菌株中,隨后搖菌培養,菌液的適宜濃度為A600=1.0。用含有載體的農桿菌菌液注射到3~5周齡的煙草葉片,置于黑暗環境培養3~5 d后,使用德國徠卡(Leica)/TCS SP8 STED 3X激光共聚焦顯微鏡觀察GFP綠色熒光蛋白的分布情況。
1.2.6 雙分子熒光互補技術(BiFC) 利用BiFC實驗對預測結果進行驗證。使用的載體為pXY104和pXY106,同源重組方法構建PavADC-pXY106和PavSAMDC-pXY104的載體。再將構建好的載體轉入GV3101農桿菌感受態,涂板挑菌進行陽性克隆的驗證后搖菌至A600為0.8~1.0。互作基因載體混合,室溫靜置2~5 h后,注入生長5周左右的煙草葉片中。經過3 d暗培養后,使用激光共聚焦顯微鏡進行熒光信號觀察。pXY104和pXY106空載體作為實驗對照。載體引物見表1(11~12)。
2 結果與分析
2.1 不同砧木類型‘羅亞理’花芽形成及開花物候期和樹體發育變化
通過田間觀察發現,不同砧木類型甜櫻桃‘羅亞理’的開花進程有差異,‘G6-羅亞理’的初花期要早于‘Mazzard-羅亞理’(圖1,A)。不同砧木類型上‘羅亞理’的花芽分化狀況統計結果顯示,在嫁接于不同砧木的‘羅亞理’上各隨機選取的10根枝條中,‘G6-羅亞理’花芽分化的百分率高于‘Mazzard-羅亞理’的枝條占整體的80%(圖1,B)。此外,本研究對不同砧木類型的‘羅亞理’樹高和主干粗度進行了調查,結果顯示,‘Mazzard-羅亞理’的樹體和主干粗度均高于‘G6-羅亞理’(圖1,C)。

表1 引物序列
2.2 不同砧木類型‘羅亞理’花芽多胺含量變化
通過HPLC方法對不同砧木類型‘羅亞理’花芽多胺含量進行了檢測,以分析多胺含量差異是否造成不同砧木類型‘羅亞理’開花物候期和花芽形成的不同。由圖2可以看出,10月15日至12月15日,不同砧木‘羅亞理’花芽Put含量差異并不明顯,而從1月17日開始至3月10日,‘G6-羅亞理’花芽Put和Spd的含量始終高于‘Mazzard-羅亞理’,同時兩者差異逐漸增大。整體來看,在休眠期,‘Mazzard-羅亞理’花芽Put和Spd含量變化波動較小;而‘G6-羅亞理’花芽Put和Spd含量在整個階段均呈現較大的變化,直至休眠結束后花芽萌發時有大幅度的升高。雖然在生物體中Put、Spd和Spm是較為豐富的3種多胺,但在甜櫻桃花芽內,Spm含量卻很低,僅‘G6-羅亞理’在1月份和3月份有合成;而2種‘羅亞理’花芽Spd的含量整體高于Put。

A. 開花物候期;B. 一年生枝條上形成花芽分化率;C. 距地面20 cm處主干粗度和樹體高度圖1 不同砧木類型‘羅亞理’的花芽形成及開花物候期和樹體發育A. The blooming phenophase; B. The floral bud differentiation rate on annual branches; C. The trunk diameter and the height of the tree 20 cm from the groundFig.1 The floral buds formation, blooming phenophase and the development of ‘Royal Lee’ grafted in different rootstocks
2.3 甜櫻桃PavPAOs和PavADC基因的克隆及其生物信息學分析
為更好地明晰不同砧木類型對甜櫻桃花芽內多胺含量的影響,本研究對多胺代謝的關鍵基因PavPAO2、PavPAO4、PavPAO5及PavADC進行克隆,其長度分別為1 485、1 611、1 704和2 307 bp。對不同物種的PAO和ADC蛋白系統進化關系分析結果(圖3)表明,PAO家族分為4個亞家族,每個亞家族內蛋白數量分布不同,4個亞家族分別包含15、15、7和7個蛋白。其中,PavPAO2是亞家族Ⅰ的成員,PavPAO4是亞家族Ⅱ的成員,PavPAO5是亞家族Ⅳ的成員。甜櫻桃中的PavPAOs與桃、扁桃和蘋果等物種的親緣關系較近,而與甜橙、栓皮櫟等物種親緣關系較遠。甜櫻桃中的PavADC與桃、扁桃和蘋果等物種的親緣關系較近,而與麻風樹、蔓花生等物種親緣關系較遠。ADC家族分為2個亞家族,每個亞家族內蛋白數量分布不均,2個亞家族分別包含12和3個蛋白。其中PavADC是亞家族Ⅰ的成員(圖3)。

**P<0.01,* P<0.05圖2 不同砧木類型‘羅亞理’花芽內3種多胺的含量變化Fig.2 The contents of 3 types of polyamines in floral buds of ‘Royal Lee’ grafted in different rootstocks

圖3 多個物種PAOs(左)蛋白和ADC(右)蛋白進化樹Fig.3 Phylogenetic tree of PAOs (Left) and ADC (Right) in different species

圖4 甜櫻桃PavPAOs氨基酸序列比對Fig.4 Amino acid sequence alignment of PavPAOs of Prunus avium
本研究利用DNAMAN對PavPAOs家族編碼蛋白進行了多序列比對,結果(圖4)表明,PavPAOs家族不同成員的氨基酸序列存在顯著差異。
2.4 不同砧木類型的甜櫻桃花芽PavPAOs和PavADC基因的表達
qRT-PCR分析結果(圖5,A)顯示,不同砧木類型‘羅亞理’花芽PavPAOs和PavADC的表達水平有差異。從休眠期到脫苞期,‘Mazzard-羅亞理’花芽內PavPAO5表達量始終高于‘G6-羅亞理’,這表明在兩種花芽內該基因的表達差異可能是‘Mazzard-羅亞理’花芽多胺含量低于‘G6-羅亞理’的原因。在休眠期,PavADC基因在兩種砧木‘羅亞理’花芽中的表達豐度均不高;而在發育后期,‘G6-羅亞理’花芽內PavADC的表達水平遠遠高于‘Mazzard-羅亞理’,說明在發育后期,‘G6-羅亞理’花芽中可能大量合成多胺。在整個休眠期,PavPAO2和PavPAO4的表達量整體水平遠遠低于PavPAO5的基因表達量,由此推測,PavPAOs家族中,在休眠期起到主導作用的家族成員可能是PavPAO5(圖5,B)。
2.5 PavPAOs和PavADC的亞細胞定位
為明確PavPAOs和PavADC蛋白在細胞中發揮生物學功能的場所,本研究利用激光共聚焦顯微鏡觀察融合質粒35S∷PavPAO2-GFP、35S∷PavPAO4-GFP、35S∷PavPAO5-GFP和35S∷PavADC-GFP在煙草葉片表皮細胞中的瞬時表達情況。結果(圖6)顯示,在瞬時表達PavPAO2-GFP和PavPAO4-GFP融合蛋白的煙草葉片中,在細胞膜上檢測到綠色熒光信號;在瞬時表達PavPAO5-GFP和PavADC-GFP融合蛋白的煙草葉片中在細胞膜和細胞核中檢測到綠色熒光信號;而在單獨表達GFP的對照組中,綠色熒光信號分布于細胞膜、細胞質和細胞核中。根據此實驗結果推測PavPAO2和PavPAO4在細胞膜上發揮功能,而PavPAO5和PavADC在細胞核發揮功能。

A. 材料間比較;B. 基因間比較圖5 不同砧木類型的甜櫻桃花芽PavPAOs和PavADC基因的表達分析A. Comparison between malerials; B. Comparison among genesFig.5 Expression analysis of PavPAOs and PavADC in sweet cherry floral buds of different rootstock types
2.6 PavADC與PavSAMDC在細胞內的相互作用
為解析PavADC在細胞內發揮作用的機制,本研究首先通過在線網站http://netbio.sjtu.edu.cn對其可能的互作蛋白進行預測。結果(圖7,A)顯示,PavADC與S-腺苷甲硫氨酸脫羧酶(PavSAMDC)蛋白可能存在互作關系。先前的報道表明,SAMDC蛋白是多胺代謝過程中的限速酶,能夠使S-腺苷甲硫氨酸(SAM)脫羧生成1-氨基丙基-1-羧酸(ACC)和乙烯,繼而促進Spd和Spm的合成[20-21]。因此,為進一步明確兩者的互作關系,本研究通過BiFC實驗對其進行驗證,結果(圖7,B)顯示,將PavADC-pXY106和PavSAMDC-pXY104菌液混合后注射煙草葉片,培養3~5 d后YFP熒光信號觀察發現,在實驗組PavADC-pXY106和PavSAMDC-pXY104中可見明顯的YFP熒光信號,且熒光信號主要集中在細胞核和細胞膜,而在PavADC-pXY106和pXY104、pXY106和PavSAMDC-pXY104以及pXY106和pXY104等3組陰性對照中均未觀察到YFP熒光信號。表明PavADC與PavSAMDC存在相互作用。
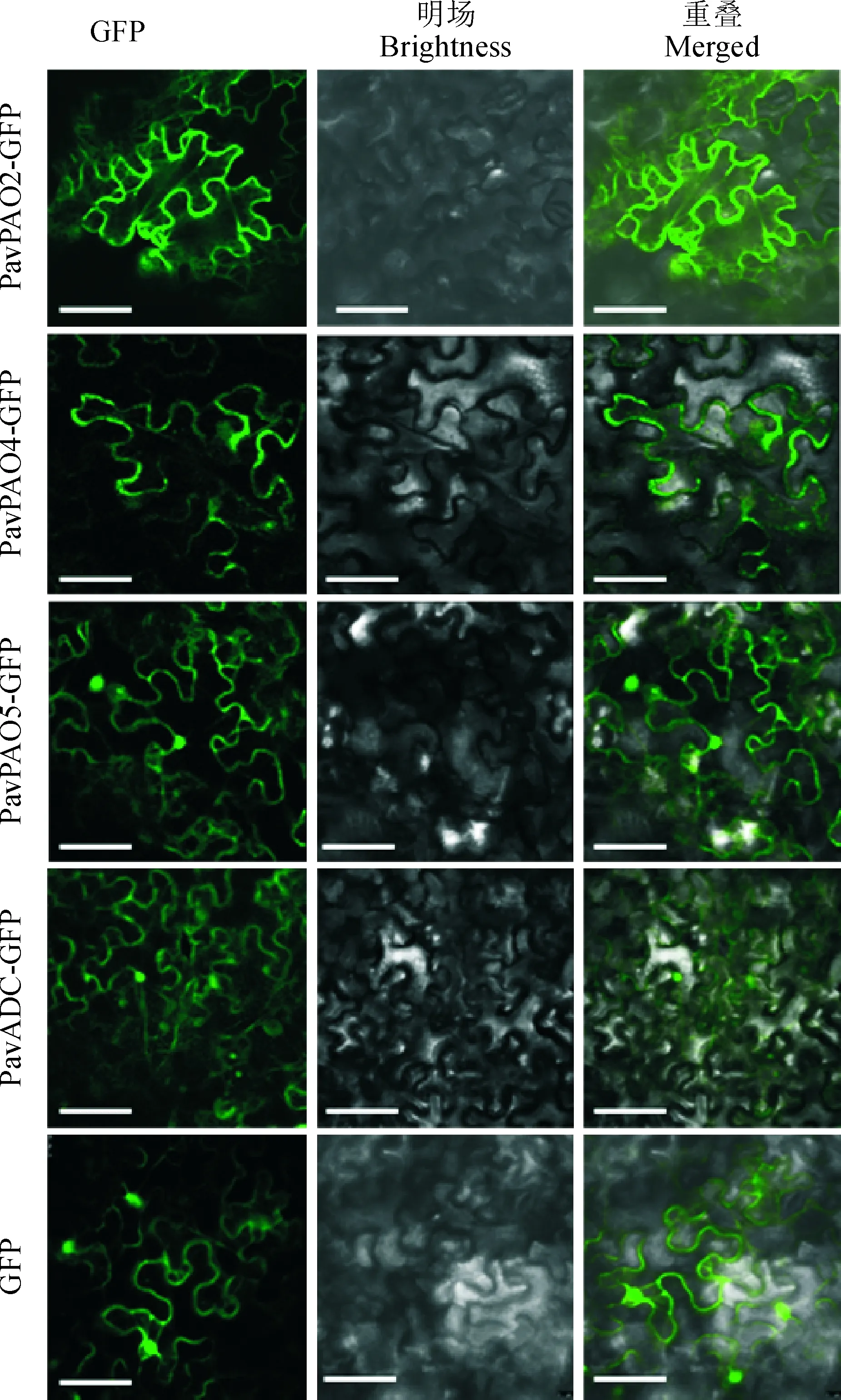
圖6 甜櫻桃PavPAOs和PavADC在本氏煙草葉片表皮細胞中的亞細胞定位(標尺=50 μm)Fig.6 Subcellular localization analysis of PavPAOs and PavADC in leaf epidermal cells of Nicotiana benthamiana(Bar=50 μm)

A. SAMDC與ADC的互作預測,中心紅點為ADC,左側紅圈為SAMDC;B. BiFC實驗。激光共聚焦觀察煙草葉片中蛋白互作圖7 PavADC和PavSAMDC在細胞內相互作用(標尺=50 μm)A. The prediction of the interaction between SAMDC and ADC; B. Bimolecular fluorescent complimentary. The yellow signals were observed with a bimolecular fluorescence complementation assay in Nicotiana benthamiana leavesFig.7 Interactions between PavPAOs and PavSAMDC in cells (bar=50 μm)

圖8 不同砧木類型‘羅亞理’花芽內PavSAMDC基因的表達變化Fig.8 The relative expression of PavSAMDC in the floral buds of ‘Royal Lee’ grafted in different rootstocks
2.7 甜櫻桃PavSAMDC基因表達分析
為進一步明確PavSAMDC的功能,本研究對不同發育期的花芽的表達模式進行了分析,結果(圖8)顯示,在休眠前期,PavSAMDC的表達量存在小幅度的波動,而在休眠后期,PavSAMDC的表達量快速升高,花芽開始萌芽開花,此變化規律與PavADC基因表達量的變化規律相同,這也潛在地表明兩者協同作用共同調控休眠后期的甜櫻桃花芽內多胺的水平,最終促進花芽解除休眠開始萌芽開花。
3 討 論
3.1 果樹花芽內不同種類多胺的含量變化及其作用
多胺在植物生長發育過程中發揮著重要的作用[22],在植物體內最為豐富的幾種多胺為Put、Spd和Spm。前期研究發現,在不同物種不同器官中,不同種類的多胺含量不同。吳琴燕等[18]的研究表明,在茶鮮葉中,Spm的含量最高,Put的含量最低,Spd的含量中等;在芽內的多胺含量高于莖,在莖內的多胺含量高于葉片。范克欣等[10]研究發現,在桃花芽內3種多胺的含量也不相同,Put的含量高于Spd,而Spm的含量最低。Wang等[14]對早花甜櫻桃和晚花山櫻桃的研究結果表明,早花甜櫻桃花芽內的多胺含量變化趨勢不同于晚花山櫻桃,而從整體來看,Spm的含量高于Put的含量,Spm的含量最低。孫曉焱[23]的研究發現,在川梨葉芽內Spd含量最高,其次是Spm,而Put的含量最低。本實驗的研究結果顯示,在休眠過程中,Spd的含量高于Put,而Spm僅有少量合成,大體上喬化砧木內多胺的含量都低于矮化砧木。這種差異可能是由于不同種類的多胺在休眠期間行使的功能不同造成的。
劉少華等[24]的研究表明,在杏花芽內,多胺含量的高低順序為Spd>Put>Spm。Put能夠促進萼片原基和雌蕊原基的分化進而促進開花,因此在露萼期花芽內的Put含量最高;Spm對萼片、雌蕊和開花的過程有一定影響,其在花芽內含量變化趨勢相對較為復雜;Spd對花芽分化以及開花早晚影響較高,因此研究發現其在初花期含量最高。楊貴先等[25]對南瓜花發育過程中多胺的含量變化研究發現,在南瓜雌花中Spd的含量最高,Put的含量最低,而在南瓜雄花中Put的含量要高于Spd和Spm,推測在南瓜雄花發育的過程中Put可能發揮著主要作用,而在雌花中Spd在其發育過程中發揮著更為重要的作用。本研究中,多胺含量的高峰期出現于花芽露白期,因此推測多胺能夠促進甜櫻桃花芽的萌發,且Spd在花芽休眠和萌發階段的總含量高于Put的總含量,推測在甜櫻桃花芽休眠和萌發的過程中Spd起主要促進作用。
甜櫻桃花芽多胺變化的相關研究雖然取得了一定的進展,但對花芽內不同種類多胺執行的具體功能和發揮作用的發育階段還需進一步的實驗驗證。
3.2 多胺的代謝對果樹芽休眠的影響
多胺作為“第二信使”能夠影響多種果樹的芽休眠進程,如桃和葡萄[10,26]。結合本研究結果可知,當2種砧木的甜櫻桃花芽于2月28日時,其花芽內Put和Spd的含量均迅速上升。這不僅說明不同種類的多胺在不同休眠階段發揮著不同的作用,還說明花芽內多胺含量的變化與其休眠進程密切相關。本研究中所檢測的多胺屬于游離態,也有研究指出休眠的解除與游離態多胺密切相關[20]。
3.3 PavPAOs和PavADC對果樹多胺代謝的影響
PAO基因和ADC基因是多胺代謝途徑中的關鍵基因。在植物體中,精氨酸在ADC等酶的作用下脫羧生成Put,進而生成Spd和Spm,使植物體內多胺的含量升高;而多胺能夠在PAO等酶的作用下氧化分解生成醛、氨和過氧化氫從而使多胺的含量降低[27]。多胺作為生物體內的活性物質與多種生理過程有關,如植物的生長發育、抗逆性、開花和休眠等[28]。作為多胺代謝過程中的關鍵基因,這兩種基因能夠通過影響多胺代謝改變植物內多胺的水平進而影響植物的休眠和花期。Wang等[14]研究表明,當多胺的含量迅速升高時,甜櫻桃的花芽會從休眠的狀態過渡到活躍生長狀態。張全軍等[29]研究也說明,‘豐水’梨花芽的萌發和多胺的含量呈正相關且多胺的代謝是影響梨花芽萌發的重要因素。
本研究對甜櫻桃花芽內2種基因的表達分析發現,在休眠階段,PavPAOs的表達量存在小幅度的波動,當休眠結束時表達量降低,而PavADC的表達量在休眠階段變化相對穩定,在休眠解除時存在大幅的升高。結合對花芽內多胺含量和嫁接于2種砧木上甜櫻桃花芽開花進程的分析,推測PavPAO和PavADC基因通過調控花芽內多胺的含量來響應季節變化,進而促進花芽解除休眠和提前開花。
3.4 砧木類型對接穗的影響
關于砧木類型對接穗的影響已有前人進行了相關研究。砧木能夠影響櫻桃接穗的早果性和果實品質。早在1987年就有報道指出馬哈利實生砧木嫁接的櫻桃品種會比馬扎德砧木提前1~2年結果[15],這一結果同樣也在Hrotk等[30]的研究中得到證實。酸櫻桃無性系砧木無論是作為砧木或是中間砧,其接穗品種的果實都會比馬哈利砧木大[31]。此外,砧木也能夠影響接穗內的多胺含量。Tao等[32]的研究發現,在受到高溫脅迫時,苦瓜嫁接苗的葉片中多胺含量的積累高于自根苗。對番茄的研究也表明,在受到Ca(NO3)2脅迫時,番茄嫁接苗葉片和根系內多胺含量上升而自根苗葉片和根系中多胺含量下降,嫁接苗的多胺合成能力較強且分解較少,有較強的耐受性[33]。
本研究表明,休眠期間嫁接于不同砧木的‘羅亞理’花芽內多胺的含量不同,打破休眠和開花的時間也不同。推測砧木類型能夠影響接穗內某種物質或某種生理特性的不同,進而影響多胺代謝過程對環境的響應,從而調控多胺水平的變化最終影響接穗的休眠及開花。然而砧木是通過何種途徑調控多胺代謝的具體機制尚不清晰,在今后的研究中會對此問題進行更深入的探索研究。
綜上所述,砧木類型能夠通過影響多胺代謝進而影響休眠以及開花的過程。在多胺代謝過程中,關鍵基因PavPAOs和PavADC的表達能夠影響花芽內多胺的水平,PavADC能夠促進休眠期間多胺含量的升高從而促進休眠解除以及提早開花。

