外源硼元素對喀斯特地貌先鋒植物黃褐毛忍冬LfMYB基因表達的影響
蔣向輝,肖龍騫
(1 懷化學院 生物與食品工程學院,湖南懷化 418008;2 懷化學院 民族藥用植物資源研究與利用湖南省重點實驗室,湖南懷化 418008;3 懷化學院 湘西藥用植物與民族植物學湖南省高校重點實驗室,湖南懷化 418008)
黃褐毛忍冬(LonicerafulvotomentosaHsu et S. C. Cheng)為忍冬科忍冬屬植物,主產于中國西南部的云南、貴州和廣西等省[1],是喀斯特地貌地區重要的先鋒植物,其花蕾或初開的花在民間被作為金銀花原料使用,2015年版藥典將其歸屬于山銀花一類[2]。黃褐毛忍冬的花中主要含有綠原酸、皂苷類、醇類、酯類和類黃酮等多種化合物[3],其花蕾被廣泛用于治療關節炎、感冒、腸炎、發熱、感染、疼痛和潰瘍等疾病,特別是其中的類黃酮具有同時可以抑制HIV蛋白酶和HIV整合酶的雙重抑制活性[4],有望開發出治療抗逆轉錄病毒的先導化合物。中國喀斯特土壤肥力低、偏堿性和鈣元素含量高[5],生態系統生產力低,在這一特定地理條件下孕育的黃褐毛忍冬具有耐礦質元素脅迫、耐旱和耐貧瘠等特有的生理代謝機制,進行黃褐毛忍冬響應非生物脅迫逆境生理機制的研究,對于中國西部地區喀斯特地貌的修復和特色藥用植物的開發利用有十分重要的意義。
硼(B)是植物必需的一種獨特的非金屬微量元素,植物整個生命周期一直需要B。喀斯特土壤中的B主要以硼酸的形式存在,由于硼酸的高溶解性而易于被降雨溶出,所以喀斯特土壤中B元素含量較低。中國西南部、印度西北部、尼泊爾、日本、孟加拉國和巴西等地區是缺B危害最大的地區。但土壤中B缺乏和過量之間的范圍很窄[6],Sun等[7]認為0.5~2.0 mg/kg是植物所需要的土壤中B含量的最佳范圍,土壤中較低或較高的B含量將導致植物表現B缺乏或B過量脅迫,在不需要B的土壤中施加高比例的B將會導致植物發生B毒性而降低產量。植物非生物逆境脅迫相關基因的表達水平受轉錄因子的調節,包括MYB、bHLH和WDR等轉錄因子[8]。植物中大多數MYB蛋白屬于R2R3-MYB亞家族,已有研究表明該亞家族的成員參與植物干旱和鹽脅迫等非生物脅迫的基因表達調控[9]。
本研究在喀斯特土壤中對黃褐毛忍冬進行不同濃度的施加B肥處理,監測黃褐毛忍冬不同部位B元素含量變化及LfMYB表達量變化,研究黃褐毛忍冬LfMYB轉錄因子表達量與B濃度之間的關系,解析黃褐毛忍冬響應非生物脅迫逆境的生理機制,為中國西部地區喀斯特地貌的修復和特色藥用植物的開發利用提供參考。
1 材料和方法
1.1 材 料
本實驗中的黃褐毛忍冬采自貴州省興義市安龍鎮,經湖南省林業科學研究院王旭軍研究員鑒定為忍冬屬植物黃褐毛忍冬。
1.2 方 法
1.2.1 黃褐毛忍冬不同土壤栽培處理收集喀斯特土壤表層20 cm處的土壤,置80 ℃烘箱2 d烘干,過8 mm篩后,將此基質分成兩份,一份直接用于栽培黃褐毛忍冬,另一份加1/3重量的腐化牛糞后再用于栽培黃褐毛忍冬,于開花期收集不同栽培條件下的黃褐毛忍冬頂端幼葉進行轉錄組差異分析,篩選表達量差異顯著(P<0.05)的MYB基因序列。于開花前一個月開始,對喀斯特土壤基質下栽培的黃褐毛忍冬進行0.25、1.0 和2.5 mg/L不同濃度B的葉面噴施處理,每株噴施300 mL溶液,隔10 d噴1次,3次噴完。采用 ICP 等離子體原子發射光譜儀(Agilent 7500CE)測定土壤硼(B)元素含量。
1.2.2LfMYB全長CDS克隆與生物信息學分析分別采集喀斯特土壤基質和加牛糞基質下種植的黃褐毛忍冬頂端幼葉進行轉錄組差異分析,獲得差異表達的MYB片段序列,采用RACE克隆的方法克隆MYB全長CDS序列。通過https://www.expasy.org/proteomics網站進行蛋白質理化性質分析,通過https://prosite.expasy.org網站進行蛋白功能結構域預測。通過http://kinasephos2.mbc.nctu.edu.tw網站進行蛋白磷酸化位點預測。
1.2.3LfMYB原核表達活性分析構建原核表達質粒pCold-LfMYB轉化大腸桿菌BL21,采用不同濃度的IPTG進行BL21誘導培養,充分收取菌液,經超聲破碎后吸上清,采用鎳柱純化法獲得重組蛋白,對融合蛋白采用考馬斯亮蘭染色的方法進行檢測。
1.2.4 LfMYB轉錄活性驗證參照Wang等[10]方法進行LfMYB反式轉錄激活實驗,轉錄因子LfMYB的全長CDS克隆進pGBKT7載體得到 pBD-LfMYB質粒,同時分別以pBD 為陰性載體、pGAL4為陽性載體,采用乙酰酸鋰介導的方法將誘餌質粒轉入質粒轉化酵母菌YGR-2細胞,涂布于營養缺失的培養基(SD/-Trp)培養2 d,然后將陽性克隆轉移到加有10 mmol/L 3-AT的SD/-Trp-His-Ade平板上生長,在30 ℃下培養3 d后統計生長情況,檢驗轉錄因子的激活活性。
1.2.5LfMYB表達量檢測與B含量檢測采用Invitrogen公司的TRizol 試劑盒分別提取不同濃度B處理后的黃褐毛忍冬不同器官總RNA,參照楊總應等方法[11]逆轉錄成cDNA后,進行實時熒光定量PCR(qPCR)檢測,以actin基因為內參,引物為actin-F(5′-ATGATGCTCCCAGGGCAGTTT-3′)和actin-R(5′-TCCATGTCATCCCAGTTGCTG-3′)。LfMYB基因表達的定量PCR引物為LfMYB-Q-F (5′-CTGACTTAAAGAGCGGCAATA-3′)和LfMYB-Q-R(5′-GGAAGCGGTGGTTTAGTTT-3′)。應用比較Ct值法測定LfMYB相對表達量。參照蔣向輝等[12]采用原子吸收光譜儀法測定相應器官中B含量。
2 結果與分析
2.1 LfMYB 全長CDS克隆與生物信息學分析
對不同栽培條件下的黃褐毛忍冬頂端幼葉進行轉錄組測序,使用Trinity軟件拼接得到78個MYB基因相關的重疊群(contigs),從中篩選出一個460 bp的差異表達片段,采用RACE克隆的方法成功獲得了黃褐毛忍冬MYB全長CDS序列(將其命名為LfMYB),LfMYB編碼序列為1 005 bp(圖1),可編碼334個氨基酸殘基,GenBank登錄號為MT424590。系統發育分析表明,LfMYB與忍冬屬其他MYB成員聚集成一個進化枝(圖2)。LfMYB蛋白質的分子量和等電點分別為37.92 kD和5.05。結構域預測顯示,LfMYB編碼序列與LjaMYB12序列相似度為97.6%(圖3),在氨基末端有3個MYB重復。與NCBI數據庫中獲得的多個MYB轉錄因子序列比對顯示,LfMYB具有與MYB亞組R2R3轉錄因子相同的保守的R2R3結構域。經磷酸化位點預測,LfMYB有 9 個氨基酸位點可被蛋白激酶C(PKC)磷酸化,其中 5 個位點位于轉錄激活區內。

1.M. DL5000;1~3分別為5′-RACE第一輪PCR產物、第二輪PCR產物和第二輪PCR空白對照;B. 4~6分別為3′-RACE第一輪PCR產物、第二輪PCR產物和第二輪PCR空白對照圖1 LfMYB基因5′-RACE(A)和3′-RACE(B) PCR產物電泳檢測M. DL5000;A. 1-3 5′-RACE first round PCR products, second round PCR products and second round blank control; B. 4-6 3′-RACE first round PCR products, second round PCR products and second round blank controlFig.1 5′-RACE(A) and 3′-RACE(B) PCR products of LfMYB checked by electrophoresis

圖2 基于鄰接法構建的不同物種LfMYB基因聚類樹Fig.2 Phylogenetic clustering of LfMYB in different species based on Neighbor Joining method
2.2 LfMYB原核表達活性分析
利用大腸桿菌BL21對LfMYB所編碼蛋白進行了原核表達,采用不同濃度的IPTG誘導后,通過鎳柱純化的方法得到了可溶性重組蛋白,融合蛋白進行SDS-PAGE電泳,并用考馬斯亮藍染色。結果顯示pCOLD-LfMYB重組蛋白經0.2、0.4和0.8 mmol/L IPTG誘導后都能表達,蛋白大小為75 kD左右(圖4),而Pcold TF空載未見有相應大小的蛋白表達,大腸桿菌 BL21空菌經不同濃度的IPTG誘導后也未見有相應大小的蛋白表達。
2.3 LfMYB轉錄活性驗證
LfMYB轉錄活性檢測結果如圖5所示,轉化質粒pBD-LfMYB、pGAL4(陽性對照)和pBD(陰性對照)的酵母在SD/-Trp+3AT培養基上均能生長,但在SD/-Trp-His-Ade+3AT的平板僅轉化有質粒pBD-LfMYB和pGAL4的酵母能生長,而轉化質粒pBD的酵母不能生長(圖5),這表明 LfMYB在酵母中能夠正確轉錄和翻譯,且能夠激活報告基因的轉錄和翻譯,這表明LfMYB有自激活活性。
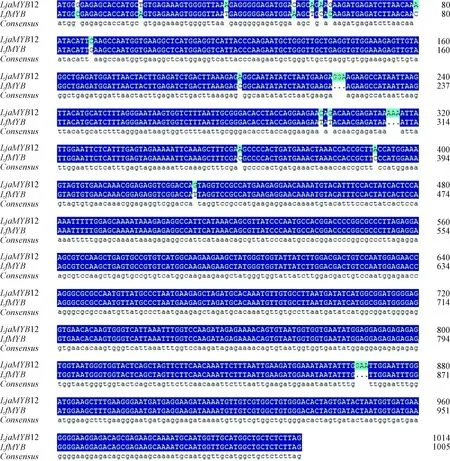
圖3 LfMYB與LjaMYB12基因序列相似性比較Fig.3 Comparison of sequence similarity between LfMYB and LjaMYB12
2.4 LfMYB表達量與B含量檢測
喀斯特土壤基質中B元素的含量為0.962 mg/kg,含量低于Muran等[13]認為的能引起植物B脅迫的水平臨界值2.0 mg/kg。黃褐毛忍冬經不同濃度B處理后對不同部位LfMYB進行qRT-PCR檢測結果如表1,結果表明LfMYB在老葉、白花和黃花中表達量明顯高于其他部位,而幼莖和幼葉中表達量相對較低。在喀斯特土壤基質中添加中濃度B導致黃褐毛忍冬不同部位LfMYB表達量均有提高,其中以老葉、白花和黃花提高最明顯(P<0.05),但當施加高濃度B(2.5 mg/L)時,各部位LfMYB表達量均明顯降低,而以幼葉、幼莖和綠蕾降低最為明顯(P<0.05)。黃褐毛忍冬經不同濃度B處理后,檢測不同部位B含量結果如圖6所示,結果顯示B主要積累在黃褐毛忍冬的老葉和莖中,且隨著施加B濃度升高,黃褐毛忍冬的各部位B含量隨之升高,其中以幼葉、老葉和幼莖中B含量升高最為明顯(P<0.05)。綜上所述,在喀斯特土壤基質中施加一定濃度范圍的B元素時,隨著B元素濃度增加,黃褐毛忍冬各部位LfMYB表達量隨之增加;當施加B元素達到中濃度(1.0 mg/L)時,LfMYB在老葉、白花和黃花中表達量增加更明顯;但是,隨著B元素濃度的繼續增加,黃褐毛忍冬各部位LfMYB表達量反而減少,其中在幼葉、幼莖和綠蕾中LfMYB表達量降低達到顯著水平。

1. 空白對照;2. 陽性對照;3~ 5表分別表示經0.2、0.4和0.8 mmol/L IPTG誘導后的重組蛋白;6~ 8分別表示經0.2、0.4和0.8 mmol/L IPTG誘導后的Pcold TF蛋白(空載);9~ 11分別表示經0.2、0.4和0.8 mmol/LIPTG誘導后的E.coli BL21(空菌)圖4 LfMYB原核表達產物SDS-PAGE檢測1. Blank control; 2. Positive control; 3-5. Recombinant protein (induction by IPTG of 0.2, 0.4, and 0.8 mmol/L, respectively); 6-8. Pcold TF protein (no load) induced by IPTG of 0.2, 0.4 and 0.8 mmol/L, respectively; 9-11. E. coli BL21 (empty bacteria) induced by IPTG of 0.2, 0.4 and 0.8 mmol/L, respectively)Fig.4 SDS-PAGE detection of LfMYB prokaryotic expression product
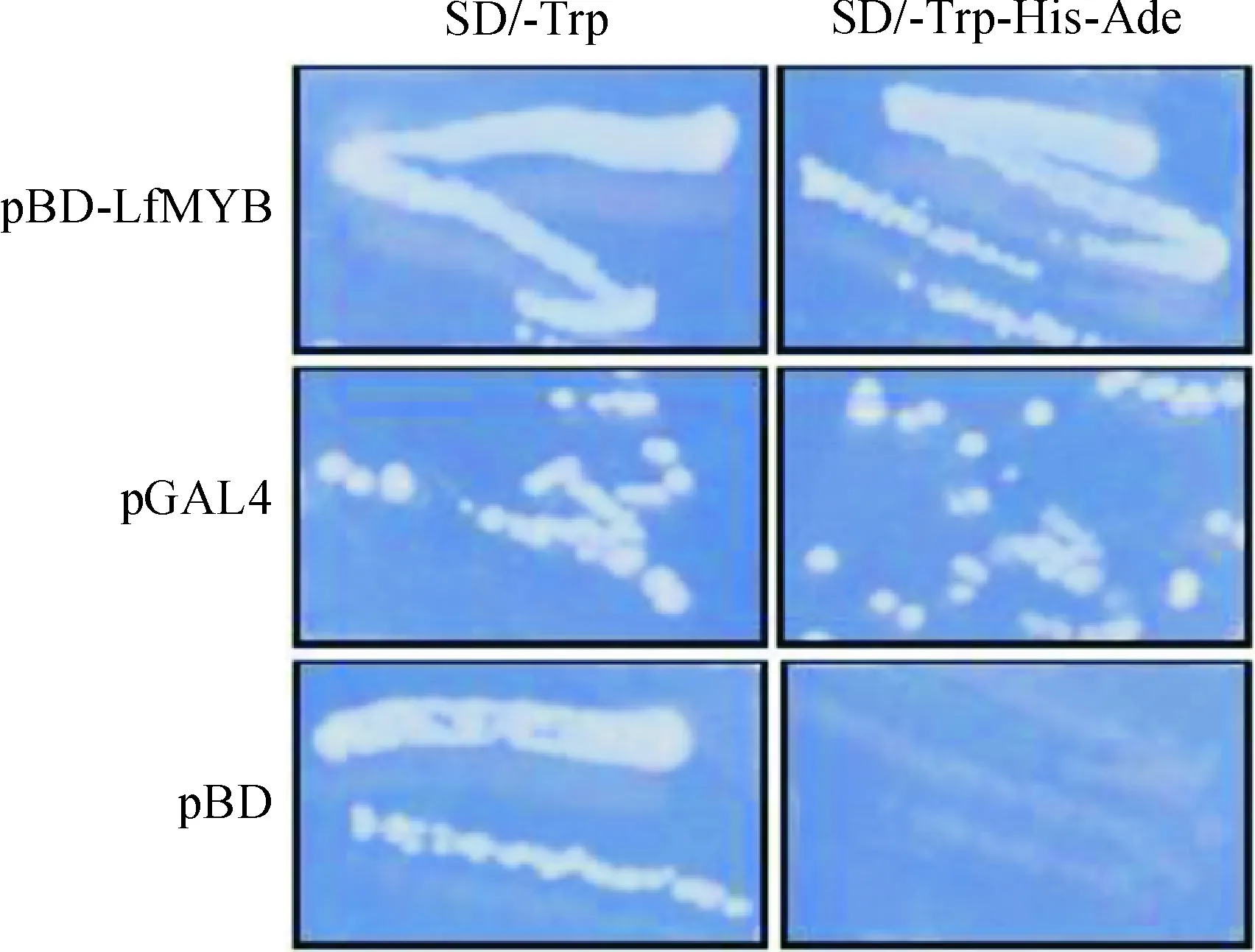
圖5 pBD-LfMYB自激活活性分析Fig.5 pBD-LfMYB autonomous activation analysis

表1 施加不同濃度B元素對黃褐毛忍冬各器官LfMYB表達量的影響

同類型器官不同小寫字母表示差異達顯著水平(P<0.05)圖6 不同濃度B處理后黃褐毛忍冬不同器官中B元素含量Different normal letters in the same organ indicate significant difference at 0. 05 levelFig.6 B element content in different organs of L. fulvotomentosa treated by different concentrations of B
3 討 論
本研究從黃褐毛忍冬中分離出了一個編碼基因LfMYB,系統發育分析和保守序列分析表明LfMYB屬于MYB,反式激活分析表明LfMYB是轉錄激活因子,LfMYB基因序列與LjaMYB12序列相似度為97.6%。Qi等[9]研究表明LjaMYB12的轉錄水平與金銀花發育過程中的總黃酮含量成正比,認為LjaMYB12是植物中的黃酮醇特異性調節因子。本研究結果顯示,黃褐毛忍冬LfMYB在老葉、白花和黃花表達量明顯高于其他部位。黃褐毛忍冬是忍冬科中最重要的變種之一,它具有與金銀花相似的化學組成和藥理作用[14]。雖然,LfMYB基因序列與LjaMYB12序列相似度極高,但轉錄因子在不同植物中作用的靶基因具有明顯的特異性,Nakatsuka等[15]研究發現轉錄因子GtMYBP3在擬南芥中過表達可以增加黃酮醇的積累,而在煙草中過表達時卻未觀察到黃酮醇含量的明顯變化。LUO等[16]研究發現轉錄因子AtMYB12在番茄中異源表達時,可以調控PAL、CHS和GT基因表達量呈現超過100倍的增加,C4H、4CL和HQT基因表達量呈現出3~10倍的增加。ZHAO等[17]研究發現LjaMYB12在擬南芥中過表達能促進PAL、F3H、FNS、CHS和CHI等黃酮生物合成基因的表達上調。STRACKE等[18]研究認為,同一亞組的轉錄因子通常表現出相似的調節功能,但LfMYB與LjaMYB12是否屬于同一亞組,這還有待進一步確認。因此,LfMYB在白花和黃花中的特異性表達對下游基因的調控特性是否與LjaMYB12相似,是否與其黃酮類藥用成分的合成緊密相關,這還有待對黃褐毛忍冬中黃酮類藥用成分合成相關基因的定量PCR檢測與黃酮類成分的含量測定。
本研究結果顯示在喀斯特土壤基質中施加一定量的B元素可促進LfMYB的表達量增加,而過量的B元素則抑制LfMYB的表達,這種抑制作用在幼葉、幼莖和綠蕾中最顯著,這在另一個方面進一步證實了Gupta等[19]提出的B元素主要參與植物細胞分裂、開花和座果等代謝活動的觀點。
Li等[20]研究認為B對類黃酮等成分合成影響極為明顯。本研究結果顯示,黃褐毛忍冬在B脅迫的條件下,過量的B主要積累在老葉、白花和黃花中,而白花和黃花是黃褐毛忍冬的主要藥用部位。并且,另有研究表明,植物的生殖生長對硼缺乏的反應比營養生長更敏感,直接影響植物的開花與座果,特別是對類黃酮的合成與轉運的影響極為明顯[18]。因此,對喀斯特高鈣、缺硼生境下的黃褐毛忍冬合理追施B肥,這是提高黃褐毛忍冬藥材的產量和質量的有效措施。已有研究表明在植物中Ca或B的缺乏或過量會影響另一種元素的營養狀況[21],因此,研究喀斯特高鈣生境下黃褐毛忍冬對B吸收利用的分子機理,將為黃褐毛忍冬施加B肥的栽培措施提供很好的參考。
忍冬屬藥用植物中含有黃芩素、槲皮素、蘆丁、二羥黃酮、山柰酚、槲皮素和楊梅素等多種類黃酮化合物[20]。類黃酮化合物含量是評估忍冬屬植物藥材質量的重要指標。近年來在忍冬屬藥用植物中有關黃酮醇、黃烷醇和花色苷等類黃酮化合物生物合成途徑的研究越來越多,類黃酮生物合成途徑相關結構基因的轉錄調控受生物與非生物因素協同作用[22]。植物中大多數MYB蛋白屬于R2R3-MYB亞家族,已有研究表明該亞家族的成員參與干旱和鹽脅迫等非生物脅迫的調控[9]。本研究結果顯示,LfMYB是屬于R2R3 MYB轉錄因子家族的轉錄激活因子,對其進行B脅迫下類黃酮代謝調控機理研究,將為黃褐毛忍冬礦質營養的改良和類黃酮代謝調控奠定重要的理論和實驗基礎。

