枯草芽孢桿菌信號肽依賴分泌表達系統研究進展
段春燕,井明博,宋 曦
(1.隴東學院 生命科學與技術學院,甘肅 慶陽 745000;2.甘肅省高校隴東生物資源保護與利用省級重點實驗室,甘肅 慶陽 745000;3.隴東學院 農林科技學院,甘肅 慶陽 745000)
大腸桿菌是目前掌握最為成熟的基因克隆表達系統,經常被用作蛋白質分泌和表達的宿主菌,它遺傳背景清晰、轉化效率高、表達周期短、操作簡單,因此使用范圍很廣。但是大腸桿菌也有一些不足之處:大腸桿菌表達的蛋白質形成包涵體,給下游的純化處理帶來不便,同時有些表達蛋白無法分泌至胞外,不利于測定酶的活性和直接使用[1]。枯草芽孢桿菌是基因工程中又一個被廣泛使用的表達系統,常作為表達酶和外源蛋白的宿主菌使用。對于枯草芽孢桿菌的研究可以追溯到100年前,初期側重于形態觀察等方面的研究,1958年Spizizen在實驗中采用了化學試劑,進而制備了枯草芽孢桿菌的感受態細胞,極大地促進了其在基因工程研究方面的進展[2]。1997年,枯草芽孢桿菌模式菌株168的基因組完成測序,全基因組共4.2Mb,含有4214810個堿基,200個調控蛋白參與1500個操縱子的調控,蛋白編碼序列占87%的基因組。在4106個蛋白質編碼基因中,已經可以明確或預測約58%的蛋白質編碼基因功能[3]和約30%的產物功能[4],為研究枯草芽孢桿菌蛋白質的分泌機理提供了重要理論依據,推動了相關研究的進行[5]。現在枯草芽孢桿菌已經成為一種成熟的基因工程表達系統,飼料、食品等行業大多利用枯草芽孢桿菌高效表達系統來生產內源生化產物,其應用之廣僅次于大腸桿菌[6]。
1 枯草芽孢桿菌基因表達系統的優勢
1.1 容易獲得
枯草芽孢桿菌廣泛分布在土壤、腐敗的有機物以及水環境中,容易在枯草浸汁中繁殖。
1.2 遺傳操作簡單
枯草芽孢桿菌的基因組測序已于1997年完成,DNA遺傳背景清晰,便于操作[7]。質粒載體如pUB110、pC194、HCMC和大腸桿菌-枯草芽孢桿菌穿梭質粒如pHT43、pSP10等的研究應用,為枯草芽孢桿菌在基因工程中的發展應用提供了便利[8]。
1.3 蛋白分泌系統功能完善
枯草芽孢桿菌蛋白質分泌能力強,可以實現對多種蛋白質的有效分泌,分泌的時候,并不存在包涵體的形成,可以直接透過細胞膜向培養基釋放,回收純化目的蛋白質方法簡單,
1.4 發酵工藝成熟
枯草芽孢桿菌嗜溫好氧,培養基配方簡單,代謝產物中含有蛋白酶、淀粉酶等酶類,在工業上應用成熟。
1.5 非致病性
生理生化背景清晰,細胞壁組成簡單,只含有肽聚糖和磷壁酸,不含內毒素,可以在動物腸道中繁殖,為正常的腸道微生物,被美國食品藥品管理局認為是生物安全級別的微生物,在飼用酶和益生菌的生產上具有極大的優勢[9]。
2 枯草芽孢桿菌信號肽依賴分泌胞外蛋白途徑
在外源基因的克隆表達過程中,重組蛋白一般以3種形式表達,包括細胞外的分泌表達、細胞內的可溶性表達和在細胞內形成不溶性的胞涵體。枯草芽孢桿菌為格蘭氏陽性菌,只有一層細胞膜,蛋白可直接分泌至胞外而不形成胞涵體,其表達產物多數具有天然構象和生物活性,產物較易純化,極大地方便了外源蛋白的下游加工和酶活測定,經枯草芽孢桿菌分泌的很多外源蛋白質已經應用于益生菌、酶制劑等工業生產領域[10],占有很大的市場份額。根據SubtiList數據庫提供的SignalP算法軟件,共294種蛋白質被預測為分泌蛋白質[11]。根據蛋白質分泌是否涉及到信號肽,可以將分泌途徑分為兩種:信號肽依賴以及不依賴的分泌途徑[12]。其中枯草芽孢桿菌分泌的蛋白質大部分是依托于信號肽依賴的分泌途徑分泌至胞外,因此這種途徑也稱為典型性途徑。
2.1 信號肽的研究進展
20世紀70年代初,美國的細胞生物學教授Gunter Blobel提出信號肽假說。該假說理論認為信號肽位于蛋白的N端,可以結合并引導核糖體附著在內質網的極性通道內,肽鏈不斷延伸并穿過內質網膜,進而延伸到腔內,信號肽酶水解信號肽,正確折疊肽鏈,進而實現向胞外的轉運[13]。信號肽是一段連續的氨基酸序列,用于指導蛋白質跨膜運輸,它一般由10~40個左右的氨基酸殘基構成,包括三個區域:氨基端區(N端)、疏水端區(H端)和羧基端區(C區)。其中N端由賴氨酸和精氨酸等帶正電荷的氨基酸組成,氨基酸殘基與細胞膜帶負電荷的磷酸基團相互作用。H端的長度以及疏水性在蛋白分泌中起著重要的作用,主要由異亮氨酸等20個或超過20個的中性氨基酸構成,疏水氨基酸殘基接觸到膜脂,形成α螺旋結構,在蛋白質跨膜轉位起始階段發揮重要作用。C區又稱為加工區,存在絲氨酸等小分子氨基酸,在蛋白轉位中或轉位后,信號多肽在C區被信號多肽酶識別并切割,隨后信號多肽被降解,蛋白質被釋放至胞外[14]。
細胞外分泌表達是外源基因克隆表達中最為理想的表達形式,但是大部分外源蛋白都會在細胞內形成包涵體,只有少數外源蛋白可以在細胞外分泌表達。為了讓許多原本不能分泌至胞外的外源蛋白進行細胞外分泌表達,目前解決方法多為直接利用表達宿主的信號肽序列或對載體的啟動子進行表達后插入編碼信號肽序列來引導外源蛋白胞外分泌[15]。有研究表明,信號肽連接后,在大腸桿菌、芽孢桿菌和乳酸桿菌等原核表達系統中分泌和表達了多種外源基因。同時信號肽在畢赤酵母等真核表達系統中也得到了廣泛的應用。如魏薔等將信號肽插入豬瘟病毒E2蛋白基因,實現了該基因在桿狀病毒表達系統中的分泌表達,其中gp67信號肽可使E2基因分泌表達量、純度、產率都得到較大提高[16]。祝發明等構建了枯草芽孢桿菌Tat信號肽,實現了青霉素G酰化酶(PGA)在枯草芽孢桿菌中的分泌表達,其中最佳信號肽可引導PGA的表達酶活高達0.83U/mL[17]。但是信號肽與目的蛋白質之間具有適配性,如Brockmeier等人以角質酶和脂解酶為例,通過高通量篩選的方法建立了信號肽文庫,以期有效篩選枯草芽孢桿菌sec途徑中的148個信號肽。結果顯示,兩者間并不存在對應關系,148個信號肽能引導角質酶基因在枯草芽孢桿菌中表達,但最有效促進角質酶分泌的信號肽引導脂解酶分泌的水平很低,僅為最高分泌量的5%[18],即使是同一種蛋白,用類型不同的信號肽進行引導,多數均可以表達,但分泌效率顯著不同。因此選擇合適的信號肽是影響蛋白質產量的重要因素。
2.2 枯草芽孢桿菌分泌胞外蛋白途徑
枯草芽孢桿菌中至少存在4種信號肽依賴分泌途徑,具體為Sec途徑、Tat途徑、ABC轉運子途徑和假菌絲蛋白輸出途徑[19]。ABC轉運子途徑和假菌絲蛋白輸出途徑只輸出特定蛋白質,且分子量相對較小,目前研究較為清楚的是Sec途徑和Tat途徑,其中Sec途徑廣泛應用于枯草桿菌分泌蛋白質,信號肽分為兩類:I型普通型信號肽、C區含有脂蛋白盒子的Ⅱ型信號肽。Tat途徑通常情況下僅對組裝成熟的蛋白質進行分泌,信號肽中一般包括兩個相鄰氨酸殘基[20]。
Sec(general secretory pathway)轉運途徑。Sec途徑是主要的蛋白分泌途徑,很多文獻中外源表達蛋白的分泌主要依托于Sec途徑來實現[8],對于枯草芽孢桿菌來講,大約存在著三百種分泌蛋白[21],很多分泌蛋白向胞外的轉移主要依托于Sec途徑來實現,Sec轉運系統在轉運過程中,發揮著重要作用的編碼蛋白為SecA、SecD、SecE、SecF、SecY、ffh、ftsY。SecA本質上屬于一種ATP酶,依托于ATP的水解驅動分泌蛋白前體穿膜,而SecYEG的構成主要包括了SecE、SecY和SecG,從蛋白轉移酶的角度來說,SecD7和SecF作為其重要的輔助成分[22]。在Sec途徑中,核糖體會先合成有著信號肽的分泌蛋白前體,此時蛋白為未折疊狀態。Sec蛋白的ATP酶對ATP進行水解,信號肽在這種情況下將會引導分泌蛋白前體,向細胞膜外的轉移主要依托于極性通道來實現,通道蛋白的構成主要包括了一組膜蛋白,其主要的職責是對分泌蛋白的細胞質進行定位和轉移[23],分泌蛋白以肽鏈形式在轉移階段存在。在穿過細胞膜后,信號肽酶在C區切除信號肽,蛋白質被正確折疊,并穿過細胞壁,最終作為成熟蛋白分泌到培養基中[24],詳見圖1[25]。
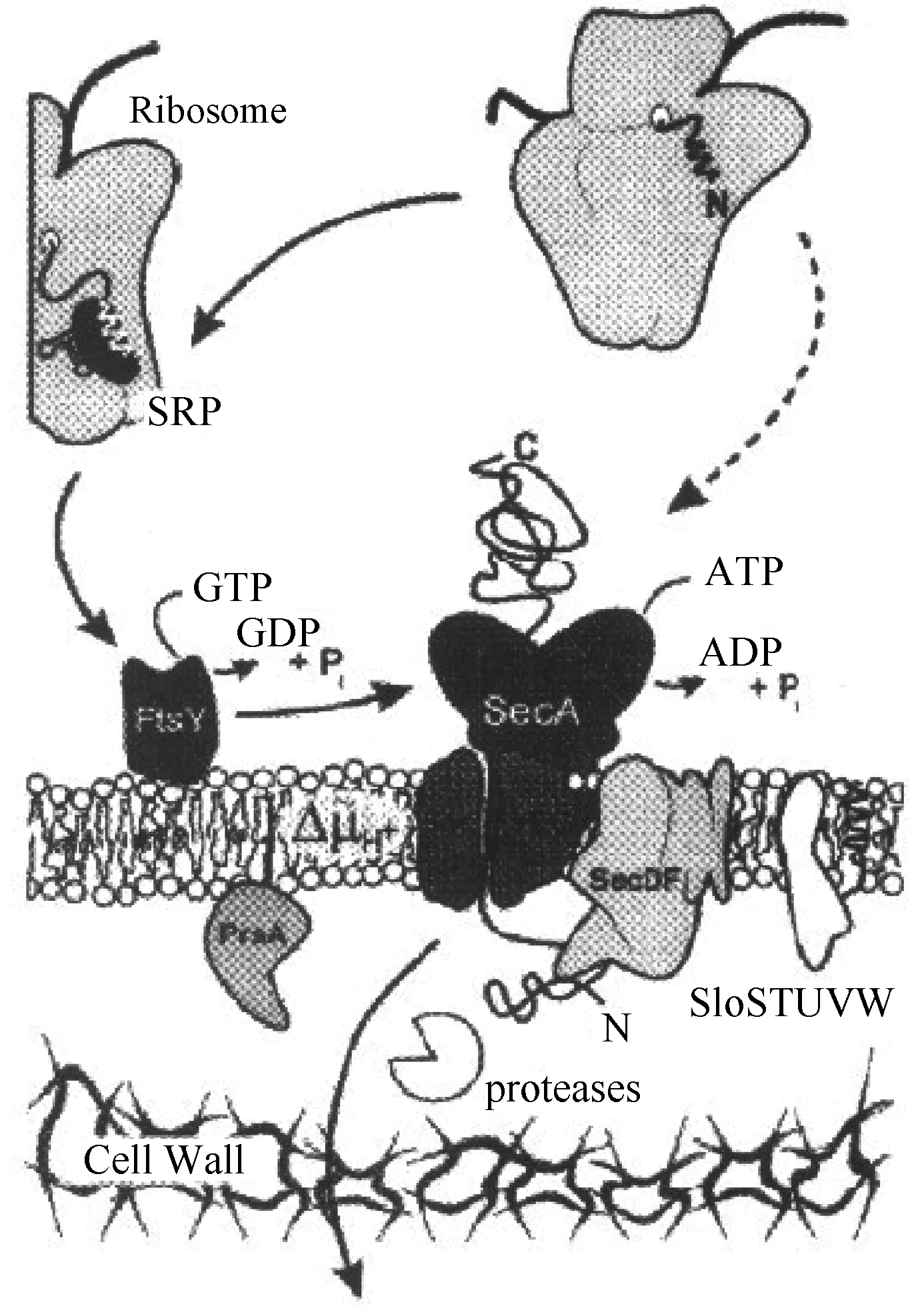
圖1 枯草芽孢桿菌蛋白質Sec途徑轉移機制
Sec途徑是枯草芽孢桿菌分泌胞外蛋白質的主要途徑,也是酶制劑工業化生產的主要途徑,但經Sec途徑可成功分泌的外源蛋白較少,而且表達量并不高[26]。主要原因如下:
(1)效率較低。Sec 轉運途徑只能將以非折疊狀態即多肽鏈形式存在的分泌蛋白前體從細胞質轉運到細胞膜外,但在細胞質中已經折疊完全的蛋白質不能通過該途徑轉移;
(2)蛋白降解。經sec途徑轉運的外源蛋白在轉移到膜外后才進行折疊,但這一過程比較慢,有時來不及折疊就會被蛋白酶降解,降低了外源蛋白的表達量。
(3)錯誤折疊。王光強等嘗試用不同的Sec信號肽來引導分泌表達耐熱乳糖酶BgaB,均分泌失敗,利用python語言編寫的程序分析表明,細胞質蛋白質的N端較容易折疊成高級結構,導致外源蛋白無法進入分泌途徑而失敗。
(4)膜定位能力差。
Tat(twin-arginine translocation)轉運途徑。2000年Jongbloed等通過功能基因組的分析發現Tat轉運途徑,這也是研究較為清楚的另一種蛋白分泌途徑,與Sec轉運途徑有很大區別的是,該途徑可以將折疊緊密的蛋白或者多亞基酶復合物直接分泌到胞外,而Sec轉運途徑只能轉移多肽鏈型式的蛋白。除枯草芽孢桿菌外,如一些植物葉綠體和細菌如大腸桿菌等均存在該途徑[27]。
Tat途徑的典型特征為分泌蛋白信號肽中兩個精氨酸殘基相鄰,經此途徑分沁的蛋白大多數都帶有聯精氨酸信號肽。Tat途徑由TatA(3個TatA/B/E的同源基因)和TatC(2個TatC的同源基因)組成[28],其中3個TatA/B/E同源基因的跨膜和兩親性雙螺旋在蛋白分泌過程中起著關鍵性的作用。首先,蛋白信號肽雙精氨酸前體與TatC相連,隨后TatC和TatB再相連,在具有跨膜PH梯度下,再連入TatA,最后,TatB調節轉移折疊好的基質從TatC轉移到Tat孔,具體途徑如圖2[29]。
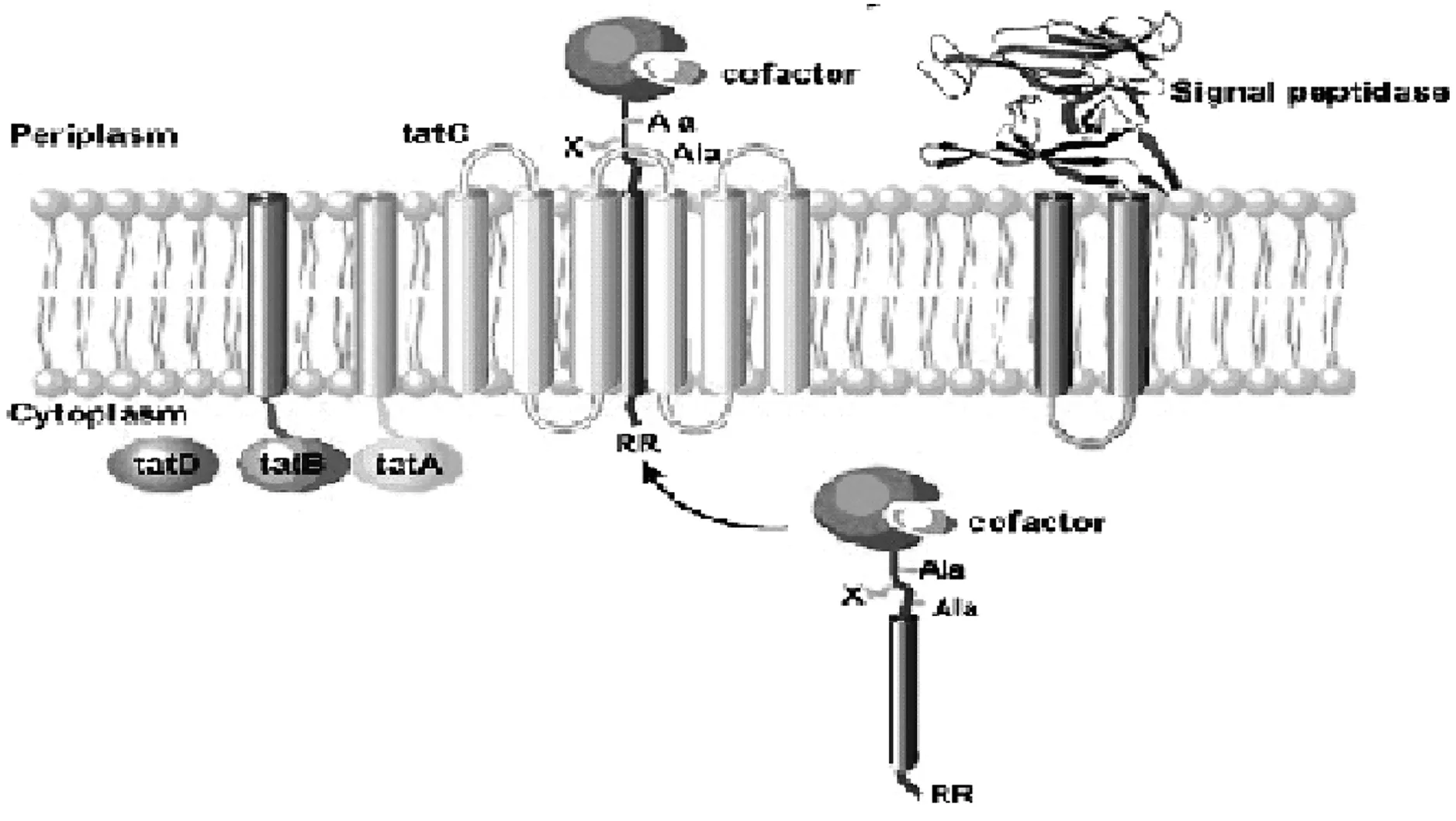
圖2 枯草芽孢桿菌蛋白質Tat途徑轉移機制
Tat途徑的研究多集中于大腸桿菌上,berk等發現大腸桿菌中Tat基質在輔助因子作用下可以轉運折疊蛋白,Santini和Thomas分別證明綠色熒光蛋白可以在折疊狀態下通過Tat途徑在大腸桿菌中轉移至胞外。對枯草芽孢Tat途徑的研究較少,主要集中在與大腸桿菌的Tat途徑的對比上,只有很少的蛋白質可以通過Tat途徑分泌,目前僅磷酸二酯酶(PhoD)和未知功能蛋白質YwbN是枯草芽孢桿菌Tat途徑分泌至胞外的蛋白質[30]。
3 枯草芽孢桿菌表達系統的研究方向
近年來,枯草芽孢桿菌表達系統不斷地發展,在外源基因克隆表達領域和工業生產上都得到了廣泛應用,很多外源基因經枯草芽孢桿菌表達系統得到高效表達[31],但同時枯草芽孢桿菌表達系統仍存在以下問題,影響了其進一步的應用發展。
(1)分子克隆效率低。枯草芽孢桿菌中很少有可以自發形成感受態的菌株,而且形成感受態持續的時間也很短,現有的質粒載體不穩定,經常會發生結構或者分離方面的問題,使質粒結構改變甚至丟失。
(2)蛋白酶降解。枯草桿菌中存在大量表達和分泌蛋白酶,比如堿性蛋白酶、中性蛋白酶、金屬蛋白酶等。這些蛋白酶沒有底物專一性,外源蛋白分泌到胞外后,會被這些蛋白酶降解,從而降低產率。現在通過研究已經構建了許多蛋白酶失活的突變菌株,如WB600和WB700,可以在一定程度上解決蛋白酶降解的問題,提高產率。
(3)枯草芽孢桿菌表達系統中有大量的信號肽(如Sec途徑有148個,Tat途徑有27個),這些信號肽對不同的蛋白有不同的引導分泌效率,目前研究中一般通過高通量篩選的方法來確定目的蛋白的適配信號肽,無法進行有效預測。
(4)真核蛋白表達量低[32]。因此在今后的研究中,一方面需要優化胞內蛋白酶質量控制體系,提高目的蛋白產率,另一方面要加強信號肽分泌機制研究,并構建目的蛋白的信號肽篩選系統,提高表達效率。

