C反應蛋白與前白蛋白比值在評估胃癌病人預后中的臨床價值
馬亞輝,楊 琪,朱洪波,劉冬良
中國的癌癥發病率和死亡率一直在上升,癌癥現已成為自2010年以來的主要死亡原因[1]。胃癌是一種預后不良的腫瘤,國外一項大數據研究[2]表明病人的5年生存率僅為25%。而在日本和韓國,由于擁有完善的篩查程序,大部分胃癌病人能夠得到早期診斷,生存率得以提高[3-4]。胃癌預后相關的因素一直是臨床關注的重點問題。自1863年,VIRCHOW首先發現了炎癥與癌癥之間的關系,隨后,越來越多的學者開展了相關研究[5-8]。應用TNM分期和炎癥指數的結合可以更好地預測胃癌病人的預后。LIU等[9]發現C反應蛋白/白蛋白(CRP/ALB)在預測胃癌的長期存活方面優于傳統的炎癥指標。前白蛋白(PA)是主要在肝臟中合成的54 000蛋白質。其主要功能是運輸甲狀腺素,間接運輸維生素A(它作為視黃醇結合蛋白的載體蛋白)。PA是一種快速代謝的內臟蛋白,其半衰期(近2 d)比ALB短得多。此外,PA早期受到蛋白質平衡急劇變化的影響,并且比ALB對營養狀況的反應更快[10]。有研究表明,PA作為單一參數,可用于評估蛋白質能量營養不良,對癌癥手術后的結局和復發有重要指導意義[11-12],并且是惡性腫瘤病人預后的獨立預測因子[13-14]。根據上述理論基礎,我們假設PA可以替代ALB與CRP結合以構建新的炎癥指數:CRP/PA,這在臨床上鮮見報道。本研究根據臨床數據來研究CRP/PA在預測胃癌預后中的價值,為臨床提供參考。
1 資料與方法
1.1 研究對象 收集2012-2013年在我院胃腸外科經根治性手術治療(畢羅Ⅱ式,D2 清掃)的胃癌病人,手術均由同一外科手術組完成,所有病人術后均行鉑類聯合5-氟尿嘧啶(5-Fu)方案化療。本研究共納入符合標準病人214例。本研究通過醫院醫學倫理委員會批準,所有病人均簽署相關知情同意書。
研究對象納入標準:(1)首次確診為胃癌,且不合并其他腫瘤;(2)術前至少2周未使用任何種類抗生素、非甾體類抗炎藥;(3)未接受過任何形式的抗腫瘤治療;(4)本研究包含的臨床資料及隨訪數據完整。排除標準:(1)胃癌復發和再發病例;(2)合并其他部位原發腫瘤;(3)合并血栓;(4)合并其他嚴重疾病,非癌性死亡病人。
1.2 資料收集 收集所有病人的臨床病理資料,包括年齡、性別、體質量指數(BMI)、空腹血糖、血紅蛋白、PA、腫瘤部位、腫瘤分化程度、腫瘤大小、腫瘤分期等。采用美國癌癥聯合會(AJCC)第七版 TNM 分期方法進行病理分期[15]。
1.3 隨訪 查詢病人的原始病歷,獲得病人的一般臨床資料、入院后的血生化指標、圍手術期并發癥及病理資料,通過電話隨訪或門診方式調查病人術后的預后情況。病人的生存時間按月計算,隨訪至病人因為胃癌死亡,或時間截至2018年12月。
1.4 統計學方法 采用t檢驗、χ2檢驗,生存分析采用Kaplan-Meier法,多變量分析采用Cox比例風險回歸模型。
2 結果
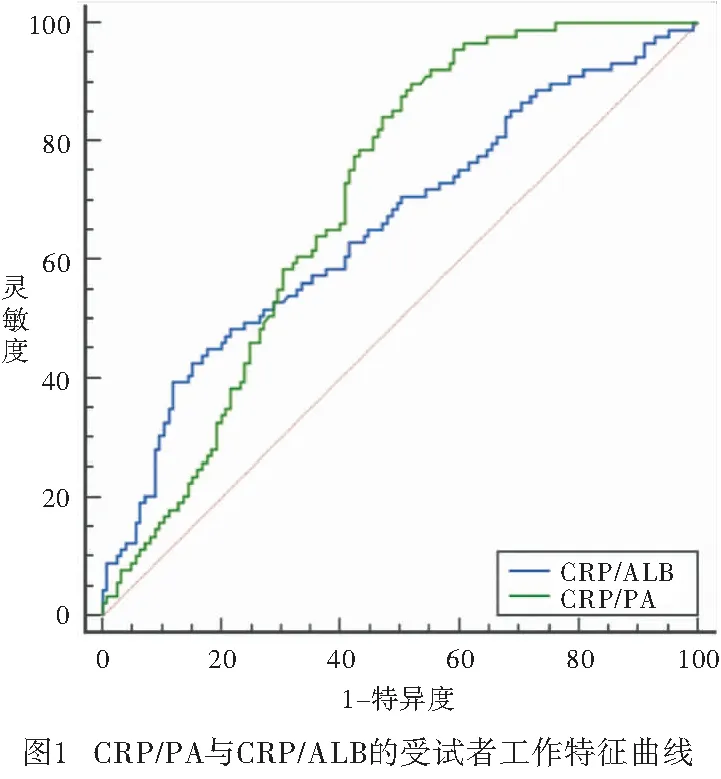
2.1 CRP/PA與CRP/ALB預測胃癌病人預后的價值 214例病人的CRP/PA值范圍為(0.33~45.21)×10-3,CRP/ALB值范圍為(2.37~307.5)×10-3,根據5年生存作為終點分別繪制兩者的ROC曲線(見圖1)。計算CRP/PA與CRP/ALB的曲線下面積AUC值分別為0.704(95%CI:0.637~0.764)與0.656(95%CI:0.588~0.719)。CRP/PA的預測價值高于CRP/ALB(z=2.21,P<0.05)。當CRP/PA值為18.8×10-3時,Youden指數最大,靈敏度為0.828,特異度為0.562;以18.8×10-3作為分界值,將≤18.8×10-3作為低CRP/PA(LCP)組(129例),>18.8×10-3為高CRP/PA(HCP)組(85例)。
2.2 胃癌病人CRP/PA水平與臨床病理特征的關系 2組病人性別、BMI、腫瘤部位、腫瘤分化程度、空腹血糖差異均無統計學意義(P>0.05),年齡、貧血、腫瘤直徑、浸潤深度淋巴結轉移、TNM分期在2組病人之間差異均有統計學意義(P<0.05~P<0.01)(見表1)。
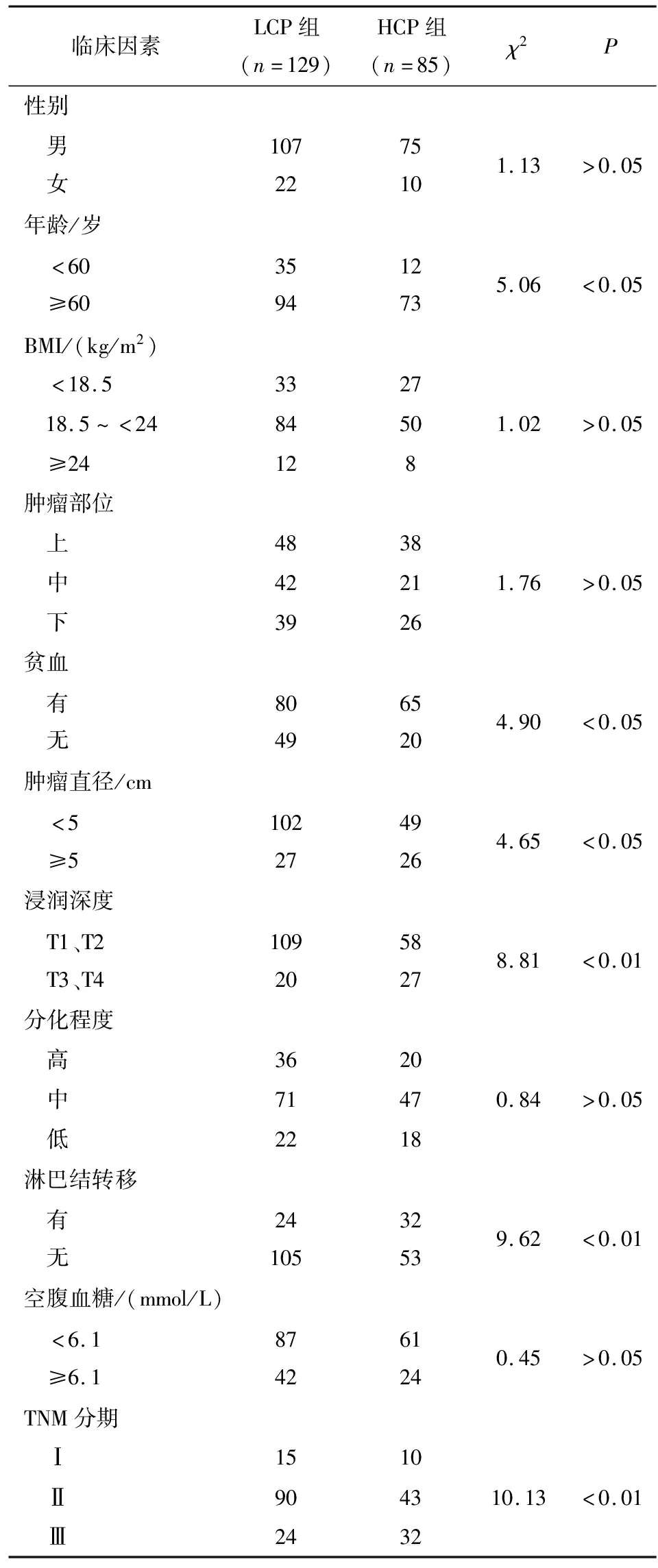
表1 CRP/PA與臨床病理資料的關系
2.3 胃癌病人CRP/PA水平與并發癥的關系 214例病人中共有62例病人出現并發癥,并發癥的發生率為28.9%,包括切口液化或感染6例,切口裂開1例,吻合口瘺5例,腹腔感染6例,肺部感染28例,胸腔積液10例,呼吸衰竭1例,心力衰竭1例,淋巴漏4例,所有病人經治療后均順利出院。HCP組并發癥發生率37.64%(32/85)高于LCP組的發生23.26%率(30/129)(χ2=5.16,P<0.05)。
2.4 胃癌病人預后的影響因素 在最長60個月的隨訪周期內,共有125例病人死亡,13例病人失訪,所有病人5年累積生存率為35.5%。病人的中位生存時間是43個月。HCP組和LCP組病人的5年累積生存率在分別是29.4%和46.3%。LCP組病人5年生存率高于HCP組的病人(χ2=5.86,P<0.05)(見圖2)。由于腫瘤TMN分期包括浸潤深度及淋巴結轉移,只研究TMN分期,通過Cox比例風險模型進一步分析發現,CRP/PA水平、TNM分期是胃癌病人術后的獨立預后因素(P<0.01)(見表2)。
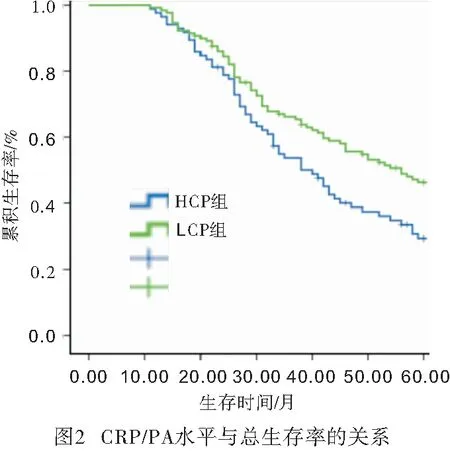
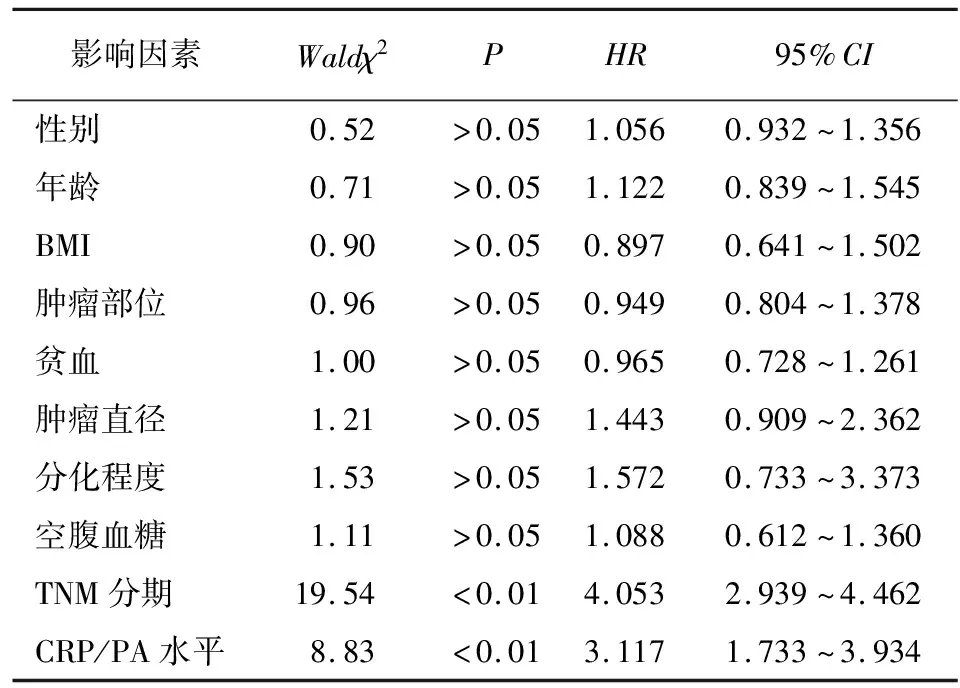
表2 胃癌病人總生存率的COX比例風險模型多因素分析
3 討論
胃癌是一種消化道惡性腫瘤,位居癌癥發病率第四高,也是癌癥死亡的第二大原因(占癌癥死亡人數的10.4%)[2]。手術仍然是成功治療的主要方法,但由于早期胃癌的表現癥狀不明顯,大多數病人發現時已處于中晚期,預后較差。在胃癌的診療過程中對于病人預后的判斷不是一件容易的事,在實際操作中,由于胃癌存在很大的異質性,即使具有相同的危險因素,不同個體的預后仍有很大差異,為了及時判斷胃癌病人的病情,依據病人的預后選擇合適的治療方案有重要的臨床意義。
腫瘤診斷時的TNM分期(腫瘤浸潤深度、淋巴結轉移和遠處轉移)是用于評估預后和預測可切除胃癌中全身治療需求的最重要工具[16]。TNM系統描述了腫瘤的大小和浸潤深度、癌細胞是否已擴散到淋巴結以及癌癥是否已擴散到身體的不同部位。目前臨床普遍使用的主要分類是由美國癌癥聯合委員會(AJCC)和國際抗癌聯盟(UICC)開發的腫瘤分期系統以及日本分期系統,而日本分期系統更加詳細,基于解剖學基礎,更加側重于淋巴結情況[15,17]。盡管廣泛使用TNM分期來評估胃癌病人的預后,特別是淋巴結的數量作為不良預后因素,但在相同腫瘤階段的病人之間預后通常不同。因此,除TNM分期外,還應該研究其他一些影響因素提高預后分層的準確性。
一些炎癥指標,如中性粒細胞-淋巴細胞比率(NLR)、系統免疫炎癥指數(SII)、血小板-淋巴細胞比率(PLR)在癌癥診療中的應用價值已得到證實[6-8]。中性粒細胞計數的增加可能是由于未成熟和無功能的中性粒細胞數量的增加,相對比淋巴細胞比例減少,隨之而來的是淋巴細胞介導的對腫瘤的免疫應答較弱[18]。癌癥相關炎癥的特征包括炎癥細胞的浸潤和腫瘤組織中炎癥因子的產生,組織重塑,組織修復和血管生成從而促進惡性腫瘤的進展和轉移[19]。以前的研究表明,在炎癥反應中,身體通過合成大量細胞因子作出反應,這些因素包括白細胞介素和腫瘤壞死因子,這些因子可下調、降低ALB和PA的血漿濃度[20],營養不良與免疫功能的降低密切相關,這會削弱身體的抗腫瘤免疫力。CRP/ALB值對于預測胃癌的預后有重要的價值[9]。但由于ALB半衰期長(近20 d),特別是在圍手術期,急性蛋白質營養不良可降低ALB的敏感性。PA是一種快速代謝的內臟蛋白,其半衰期(近2 d)比ALB短得多,早期受到蛋白質平衡急劇變化的影響,并且比ALB對營養支持的反應更快[10]。在我們的研究中,我們用PA與CRP結合以構建新的炎癥指數CRP/PA,并與CRP/ALB相比較,我們根據5年生存作為終點分別繪制兩者的ROC曲線,計算CRP/PA與CRP/ALB的曲線下面積AUC值分別為0.704與0.656,通過z檢驗發現CRP/PA的預測價值高于CRP/ALB(z=2.213,P=0.026 9)。通過生存分析結果顯示CRP/PA是影響胃癌病人預后的獨立危險因素,低CRP/PA組病人的5年生存率高于高CRP/PA組的病人,說明低CRP/PA組病人預后優于高CRP/PA組的病人,與其他研究[21]結果相似。
胃癌手術的術后并發癥導致多種不良事件,包括住院時間延長,醫療費用增加和輔助化療延遲,最終導致病人預后惡化。文獻[21]報道,胃癌的預后可能受到由并發癥引起的延長的炎癥反應的影響,即使在病理性治愈性切除術后,腫瘤細胞仍可能在數年后復發。還有文獻[19]報道胃癌術后嚴重并發癥炎癥反應與宿主免疫抑制有關。本研究214例病人中共有62例病人出現并發癥,并發癥的發生率為28.9%,分組比較,高CRP/PA組的并發在發生率顯著高于低CRP/PA組(37.1%和23.1%,P<0.05)。而CRP/PA值的升高與高CRP及低PA有關,這與國外研究[11]相似。我們假設如果我們在手術前提供營養支持的潛在干預以及控制病人的全身炎性反應,可以降低術后并發癥風險。這個結果具有特別重要的意義,因為對于術后并發癥的其他危險因素,并不是我們容易改變的。
我們目前的研究仍存在一些局限性,首先,這是一項樣本量較小的單中心研究,其次,缺乏基礎研究來探索CRP/PA如何參與影響胃癌預后的詳細機制。
綜上所述,本研究中CRP/PA水平、TNM分期是影響胃癌病人預后的獨立因素,處于CRP/PA高值水平的病人術后并發癥發生率會增加,預后差。

