藻類捕光天線系統:結構與功能的統一
甄張赫,李文軍,林瀚智,秦松*
(1.中國科學院煙臺海岸帶研究所,山東 煙臺 264003;2.中國科學院大學 資源與環境學院,北京 100049;3.中國科學院海洋大科學研究中心,山東 青島 266071;4.廣東省科學院 廣東省生態環境技術研究所 華南土壤污染控制與修復國家地方聯合工程研究中心/廣東省農業環境綜合治理重點實驗室,廣東 廣州 510650)
1 引言
藻類是光合自養的水生孢子植物,是地球上最原始的進行放氧光合作用的植物,可分為原核藻類及真核藻類。原核藻類的成員主要為藍藻,它通過內共生進化出各種真核藻類。最初,藍藻的初級內共生演化出3 個分支:灰胞藻、紅藻及綠藻[1]。隨后,紅藻及綠藻通過一系列次內共生產生了其他的真核藻類[2]。按照傳統方法,真核藻類通常被分為10 個門:綠藻門、輪藻門、裸藻門、紅藻門、隱藻門、甲藻門、金藻門、黃藻門、硅藻門及褐藻門[3]。
藻類可在各類地球環境中(湖泊、海洋、溫泉、高山、極地等)生存,特別是水下弱光環境造就了藻類獨特而高效的捕光能力[4]。為了適應各種光環境,藻類進化出了各種捕光天線(色素?蛋白復合體),包括定位于類囊體膜外的水溶性復合體,以及在類囊體膜內的疏水性復合體。這些復合體可通過調整其結合色素的數量、種類及位點,吸收環境中特定波段的光[5]。例如水溶性捕光天線復合體藻膽體(Phycobilisome,PBS),可通過共價結合的各類藻膽素,如藻藍膽素(Phycocyanobilin,PCB)、藻紅膽素(Phycoerythrobilin,PEB)、藻尿膽素(Phycourobilin,PUB)和藻紫膽素(Phycoviolobilin,PVB)等吸收460~670 nm 的可見光[6];膜蛋白捕光天線復合體(Light-harvesting Complex,LHC)可通過非共價結合的各類色素如葉綠素(Chlorophyll,Chl),及各種類胡蘿卜素(Carotenoids)如巖藻黃素(Fucoxanthin,Fx)、甲藻黃素(Diadinoxanthin,Dd)和硅藻黃素(Diatoxanthin,Dt)等吸收350~750 nm的光[7-8],這些吸收的光能被捕光天線復合體以大于90%的效率傳遞至光合反應中心。在此過程中,類胡蘿卜素可以通過淬滅激發態葉綠素的方式進行光保護。這些捕光和傳能的過程之所以如此的高效,與藻類捕光天線獨特的蛋白結構密不可分[9-13]。
藻類擁有的獨特的捕光天線結構是其行使捕光和傳能過程的基礎(表1)[14-16],研究藻類捕光天線的精細結構具有非常重要的意義。其精細結構的揭示,可以幫助人們了解天線的捕光和傳能機制,并為光電仿生器件提供重要的結構和功能基礎[17],這對開發太陽能電池甚至人工光合作用的合成都至關重要。
但需要注意的是,藻類捕光天線結構生物學的發展非常依賴于相關的檢測及解析技術。這些技術被用來分析藻類捕光天線的成分和結構,是影響結構分辨率的重要因素,因此相關的研究方法學和技術手段的進步至關重要。本文將以研究方法學和技術手段的進步為線索,回顧過去70 年藻類捕光天線結構生物學的研究歷程,闡明結構生物學揭示的藻類捕光復合體結構與功能的統一性及其科學意義,并展望有關領域未來發展趨勢。
2 藻類捕光天線結構解析
2.1 生化提取和成分分析階段
生化提取是解析藻類捕光天線結構的第一步,也是后續成分分析的重要基礎。自20 世紀50 年代起,人們開始通過簡單易行的生理生化技術,廣泛研究藻類捕光天線的組成及結構[18-20]。例如,Gantt 和Lipschultz[21]開發了從單細胞紅藻紫球藻中分離完整PBS 的方法,大大推動了當時甚至后續的PBS 結構的研究進展。后續提取完整PBS 的方法均由此衍生而來,至今仍延用了其中的經典條件及步驟,例如細胞破碎緩沖液磷酸根濃度為0.6~1.0 mol/L、pH 約為7,提取溫度在18°C 左右,純化方法選擇蔗糖梯度離心法等[22-25]。
隨后Gingrich 等[26-28]通過改進該方法,分離純化了藍藻的PBS,例如聚球藻SynechococcusPCC 6301、SynechococcusPCC 7002 等,并通過蛋白電泳、吸收光譜及熒光發射光譜,對PBS 的蛋白成分及色素成分進行了鑒定(表1)。基于這些研究成果,Glazer[29]構建了聚球藻Synechococcus6 701 藻膽體結構的初始模型。在完整的藻膽體結構被結構生物學研究技術解析之前,該初始模型的建立對于分析藻膽體能量傳遞途徑具有重要的指導意義。
2.2 利用X-ray 解析晶體局部精細結構
X-ray 晶體學是解析藻類捕光天線復合體精細結構的第一選擇[30](表1)。蛋白本身的特性往往決定了其結晶的難易程度,因此水溶性捕光天線和膜蛋白捕光天線的晶體結構解析進展并不對等。大量易結晶的水溶性捕光天線蛋白以及組成PBS 的各類藻膽蛋白率先獲得了原子分辨率的結構,例如多甲藻素葉綠素蛋白(Peridinin-chlorophyll-protein,PCP)(2 ?)[31]、藻紅蛋白(phycoerythrin,PE)(1.85 ?)[32]、藻藍蛋白(phycocyanin,PC)(1.35 ?)[33]和隱藻PE545(0.97 ?、1.63 ?)[34-35]等(表2)。
由于膜蛋白純化及結晶均較為困難,因此獲得LHC 家族成員的晶體結構往往需要漫長的摸索過程。幸運的是,目前已經獲得了多種LHCII、FCP(Fx and Chla/cbinding protein)的高分辨晶體結構(表2),這些結構清晰地展示了色基類型及結合位點[36-38]。大量晶體結構的成功解析,為后續冷凍電鏡三維重構計算奠定了重要的結構基礎。
然而,由于LHC 家族成員的結構多樣性,膜蛋白又較難結晶,因此大多數藻類的膜蛋白捕光天線的精細結構尚未通過X-ray 晶體學方法獲得(表2)。此外,超分子捕光復合體的結構也很難通過X-ray 晶體學方法獲得。一方面是由于超分子復合體的體積太大,增加了結晶難度,例如PSI(photosystem I)-LHCI,PSII-LHCII 等大體積復合物至今未見晶體結構,而其包含的體積小的PSI、PSII 以及部分LHC卻早已通過結晶法獲得精細結構[37,39-40];另一方面是受限于復合體的體外理化性質,例如PBS 不僅體積大,而且在體外易解聚,很難通過結晶獲得完整的精細結構。由于X-ray 晶體學技術幾乎沒有機會完成部分藻類捕光天線的結構解析,因此開發更多的結構解析技術變得非常必要。
2.3 利用電鏡技術解析捕光天線復合體結構(以冷凍電鏡為技術分水嶺)

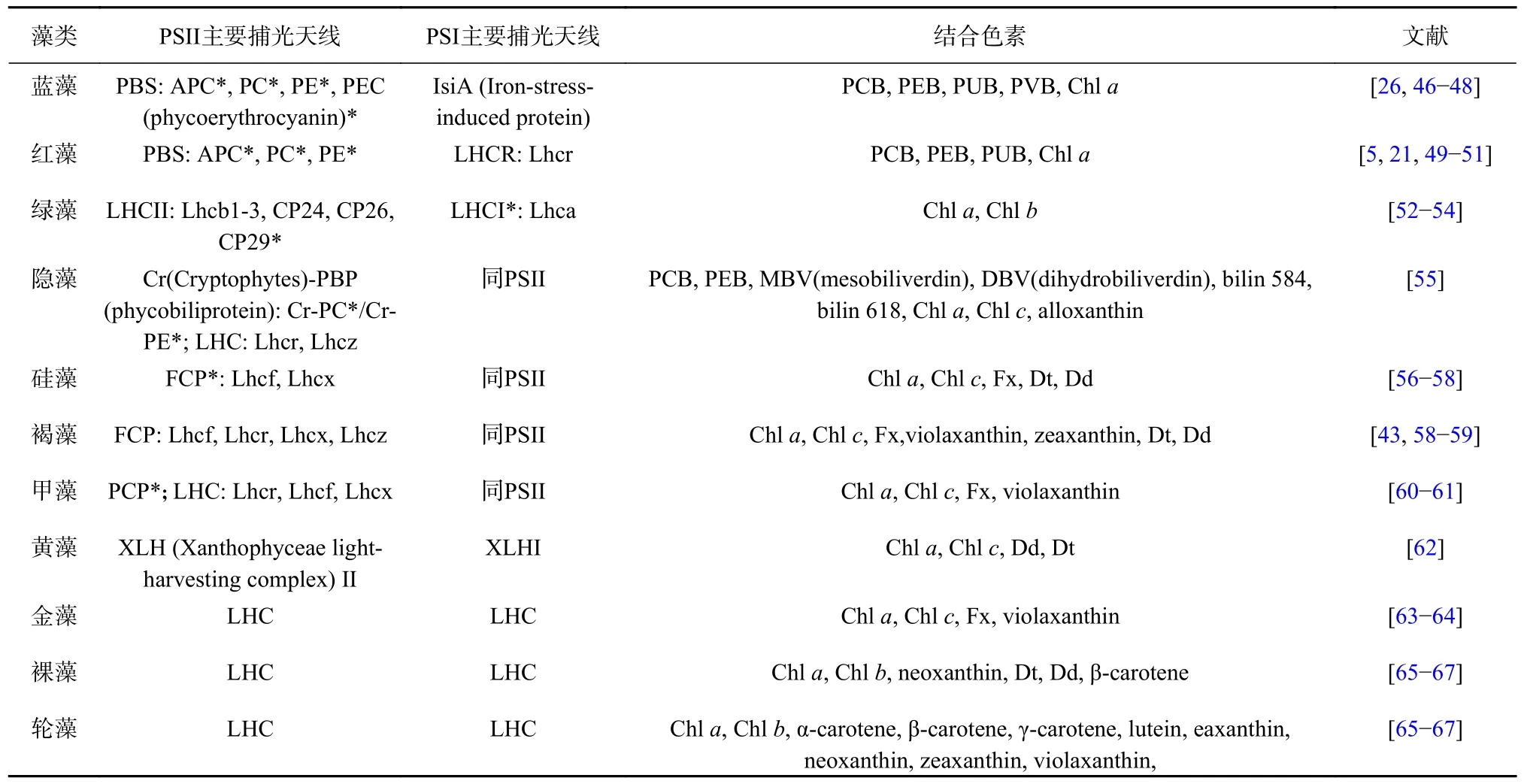
表2 藻類捕光天線復合體晶體結構解析進展Table 2 Progress in crystal structure analysis of algal light-harvesting antenna complexes
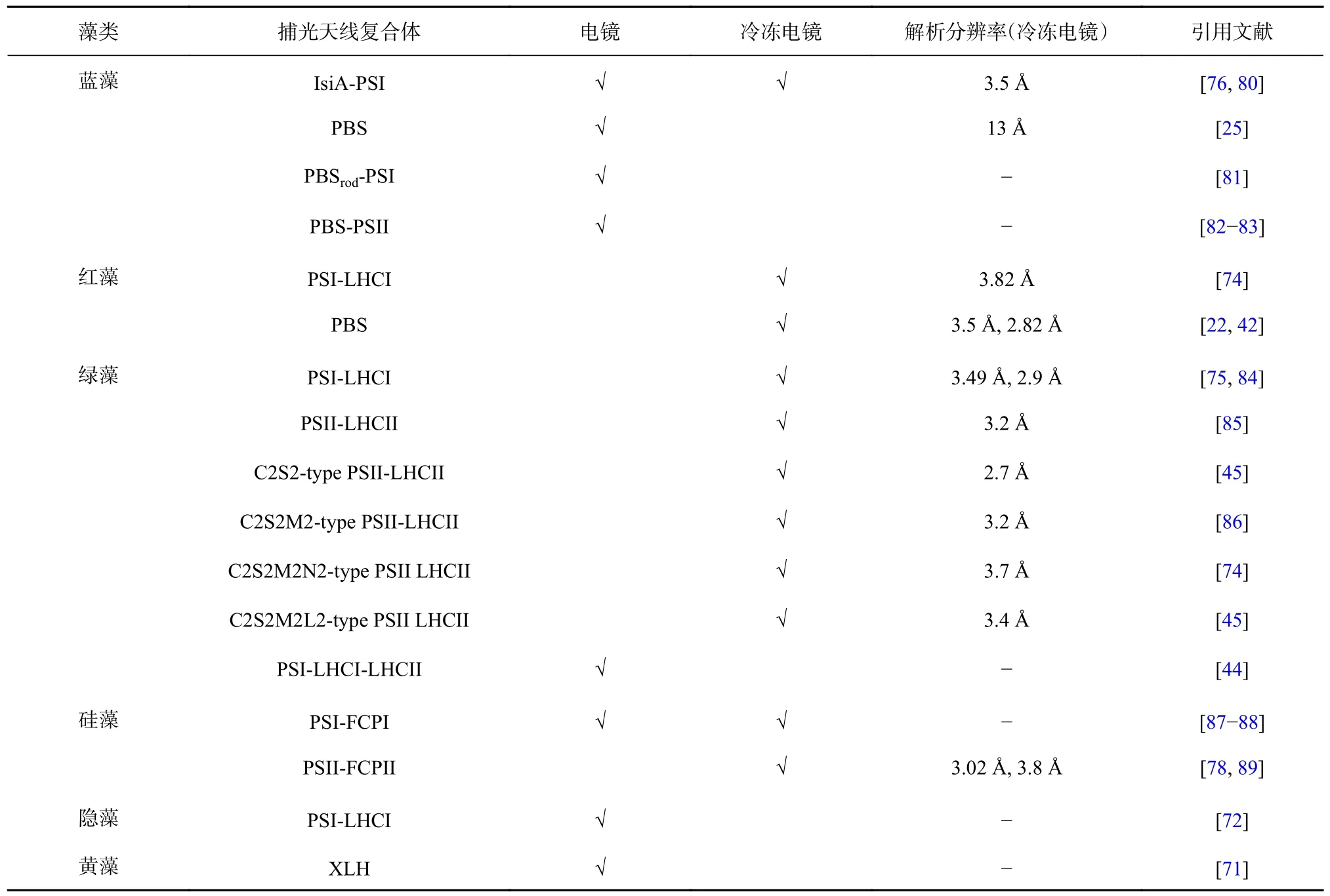
表3 電鏡技術解析藻類捕光復合體結構的研究進展Table 3 Advance in electron microscope analysis of algal light-harvesting complexes
電鏡技術一直是生物分子結構生物學結構解析,特別是超大分子解析的重要手段,只不過早期的解析清晰度遠遠不如X-ray 晶體解析技術,制約了技術的應用范圍。早在20 世紀80 年代起,人們便開始利用各種電鏡技術對捕光天線的結構進行觀察(表1,表3),例如通過透射電子顯微鏡(Transmission Electron Microscope,TEM)[21,68]、掃描隧道顯微鏡(Scanning Tunneling Microscope,STM)[69]以及原子力顯微鏡(Atomic Force Microscope,AFM)[70]觀察到了各種不同類型的二維或三維PBS 結構。部分膜蛋白捕光天線的結構也可通過電鏡觀察到,如體積較小的XLH(來源于黃藻)[71]以及大體積的LHC 和光系統I 的超分子復合物(如隱藻的PSI-LHCI[72]、綠藻的PSI-LHCI-LHCII[44]等),結合已公布的晶體結構,可對這些負染圖像進行三維重構計算,獲得粗略結構模型。然而,由于這幾種電鏡技術本身的限制及獲得的圖像分辨率的限制,這些粗略結構相比于精細結構僅能提供復合體組成成分,丟失了大量的亞基及色基結構細節,例如PBS與PSII-LHCII(圖1A,圖1C)的粗略結構,無法提供確切的亞基類型及空間位置,也無法觀察到結合的色基,而精細結構(圖1B,圖1D)卻可以提供這些細節。因此,直到冷凍電鏡技術發展成熟之前,人們都很難通過電鏡獲得捕光天線復合體完整的精細結構。
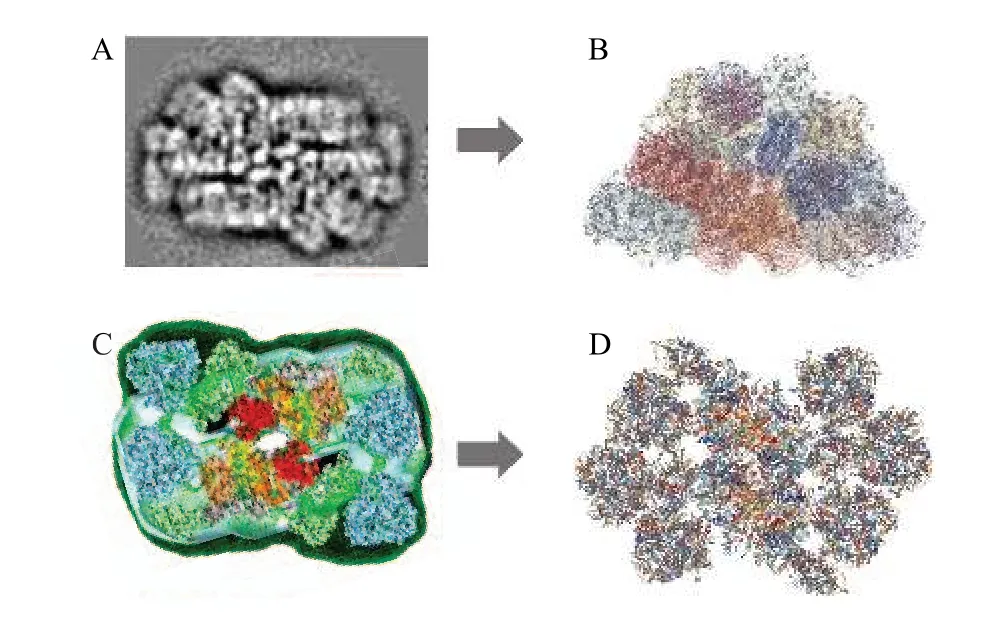
圖1 捕光復合體粗略結構及精細結構對比Fig.1 Comparison of contour and fine structures of algal light-harvesting complexes
冷凍電鏡技術的應用不僅使結構生物學跨入了新時代,也使藻類捕光天線的結構解析得以關鍵性突破,這得益于冷凍電鏡技術相比較X-ray 結晶法對樣品質量的依賴度更低[73]。僅2019 年,便有7 個超分子復合體的精細結構通過冷凍電鏡技術獲得[42,45,74-78],包括提高了分辨率的PBS 結構(紅藻Porphyridium purpureum,2.82 ?)[42]、綠藻的PSI-LHCI 以及多種類型的PSII-LHCII 等。這些結構清晰的揭示了復合體組件之間的連接與排布方式。目前,冷凍電鏡技術在藻類捕光天線復合體結構解析領域的應用還有很大的發展空間。例如,利用冷凍電鏡技術解析的藻類捕光天線復合體結構分辨率均未突破2.5 ?(表3)。因此,未來還需要對樣品純化以及冷凍電鏡解析技術繼續優化提升,以提高結構分辨率。
3 藻類捕光天線蛋白結構與功能的統一
結構生物學的進步,為深刻理解藻類捕光天線復合體的功能提供了大量結構細節,例如精細結構展示的大量的精準的發色團位置,提示了捕光天線系統內部高效的能量傳遞發生的可能機制。目前,將結構生物學與捕光天線功能整合為一體的研究方法學如下(圖2)。
(1)通過比對分析捕光蛋白的同源基因,結合其三維結構,揭示捕光蛋白結構與功能的進化關系。例如,在2006 年,Zhao 和Qin[90]對藻膽蛋白同源基因進行了進化分析,發現某些藻膽蛋白中的部分氨基酸位點表現出較高的非同義替換率(圖2A),這些位點大多分布在發色團結合結構域和螺旋發夾結構域(X 和Y)內或其附近(圖2B),并顯示出共同進化的特征。將這些位點精確地定位在藻膽蛋白的三級結構上,發現脫輔基蛋白的發色團結合結構域為發色團創造了特定的微環境,以確保高效的能量轉移效率[90]。這個研究從計算生物學的角度,證實了發色團與藻膽蛋白之間存在特定的空間環境以有效的進行共振能量轉移。
(2)根據藻類捕光天線蛋白精細結構提供的發色團網絡,預測能量傳遞的大概路徑,并為利用超快時間分辨光譜研究能量傳遞提供結構基礎。例如,通過硅藻(Phaeodactylum tricornutum)FCP 的結構解析發現,FCP 主要以二聚體的形式存在,且該結構揭示的FCP 不僅結合了含氧光合作用生物中常見的Chla,而且結合了Chlc和Fx,使它們能夠捕捉藍綠光以適應水中的光環境(圖3)[36]。隨后通過PSII-FCPII 的結構解析,進一步揭示了硅藻(Chaetoceros gracilis)FCPII與PSII 的連接方式及可能的能量傳遞模式。但是由于超分子復合體的結構過于復雜,具體的能量傳遞路徑目前還不清晰[89]。由于復合體體積太大,色素分子較多而導致目前無法僅通過高分辨的復合體結構就準確預測能量傳遞路徑的例子還有很多,例如,2020年解析的來自紫球藻(P.purpureum)的PBS 的結構,包含了1 598 個色素分子,且2.82 ?的分辨率足以使人們看清每個色基的結合位點[42]。然而,由于色素數量龐大,能量傳遞路徑復雜,其中可能涉及到多個激子能量傳遞,甚至相干共振能量轉移。因此,準確的能量傳遞途徑還需要配合各種精確的光譜技術手段進行分析。
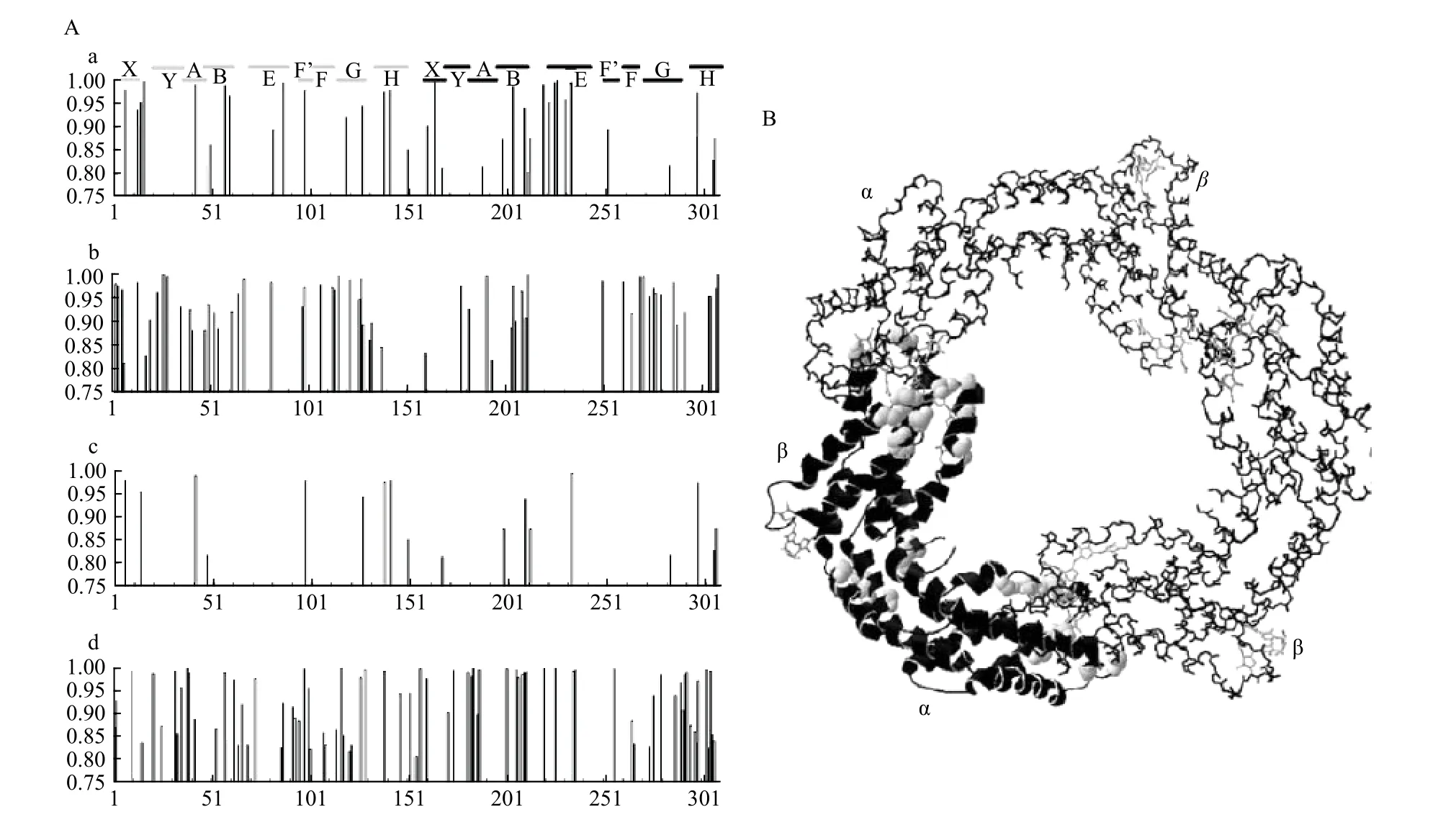
圖2 計算生物學分析藍藻藻膽蛋白同源序列及結構[90]Fig.2 Computational biology analysis of cyanobacterial phycobiliprotein homologous sequence and structure [90]
(3)光譜學是分析捕光蛋白能量傳遞的最佳手段,常用的有吸收光譜、熒光發射光譜、圓二色譜[91]以及超快光譜[92]。目前,超快時間分辨光譜被認為是分析捕光蛋白能量傳遞機制的最佳光譜學手段,超快時間分辨光譜可對飛秒(fs)內的能量傳遞過程進行監測[93-94]。例如,二維超快時間分辨光譜顯示,隱藻捕光蛋白PC645的兩組色素分子之間存在振動相干節拍以及部分離域振動,這使得能量轉移速率增強[95-96]。
除了高效能量傳遞,藻類捕光天線系統的精細結構,為理解其光適應機制提供了更多的科學依據,例如,藻類捕光天線可通過結構的變化響應來啟動各種光保護機制(如非光化學淬滅(NPQ)、狀態轉換等[97-98]),以保護光合反應中心免受光損傷。例如,發色團網絡揭示的各類LHC 的類胡蘿卜素位置,可輔助理解LHC 的NPQ 機制。近來,有研究利用時間分辨紅外光譜對LHCII 的能量淬滅動力學及構象變化進行了分析[99],該研究揭示了高等植物LHCII 三聚體對多余激發能的耗散可響應溫度和酸度的變化,這可通過類胡蘿卜素與葉綠素612 之間的動態構象變化來調控。需要說明的是,由于植物LHCII 的結構與綠藻LHCII 的結構一樣,因此,對高等植物LHCII 的研究結果均可用來分析綠藻LHCII。此外,對高等植物PSI-LHCI-LHCII 的精細結構解析,也可幫助人們深入理解綠藻捕光天線的狀態轉換機制。通過對比綠藻中發現的各種類型的PSII(photosystem II)-LHCII(C2S2-typePSII-LHCII、C2S2M2-typePSII-LHCII及C2S2M2N2-typePSII-LHCII 等)復合體結構差異,有助于深入理解LHCII 對不同光條件下的響應機制[45,74,77,86]。
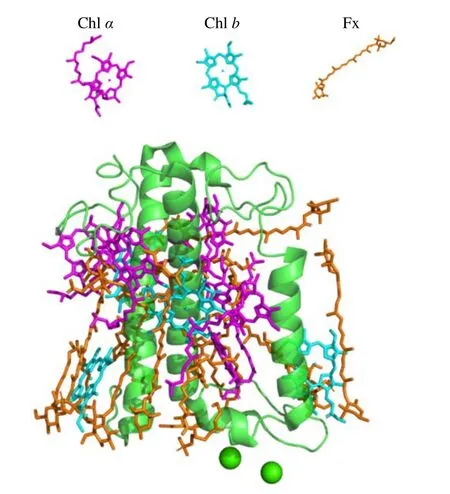
圖3 FCP 單體結構及其色素組成[36]Fig.3 Monomer structure and pigment composition of FCP [36]
藻類捕光天線的結構盡管可根據生活的光環境進行變化,但是決定其結構類型的根本因素在于進化所決定的基因。因此,盡管有一些藻類生活在相似的環境中,但是其捕光天線結構卻有差別,例如都生活在海表面的單細胞藍藻和紅藻,其具備的捕光天線結構并不相同。紅藻的藻膽體較藍藻藻膽體體積更大,且紅藻還具有膜蛋白LHC[23,42,74]。因此,藻類捕光天線的結構與功能的統一是建立在進化的基礎上的,解析不同藻類的捕光天線結構有助于理解藻類進化。
4 展望
冷凍電鏡技術與超快時間分辨光譜技術的結合,初步實現了對藻類捕光天線系統結構與能量傳遞功能的統一認識,為深刻理解水生植物藻類為何具有高效的弱光捕獲能力,極高的傳能效率以及靈活的光適應能力等,奠定了堅實的結構基礎。然而,清晰繪制一幅特殊水環境如何塑造了特殊的捕光結構,又如何獲得高效而精準的捕光功能的系統畫卷,仍舊任重道遠。
捕光天線結構中復雜的發色團網絡結合各類光譜技術可揭示其高效的傳能過程,其中可用于解釋兩個相干量子系統引起的周期性振動過程的CRET 機制引起了廣泛的關注和爭議。CRET 過程可使能量在幾百飛秒內分布在整個系統(大于分子的直徑)內[100],因此部分觀點認為相干共振能量轉移是藻類捕光天線高效捕光的真正原因。然而,也有部分觀點認為該過程的相互作用時間太短暫,在光合作用能量轉移中沒有任何功能意義[101]。而且,通用的物理計算模型無法可靠的解釋捕光天線內復雜的能量傳遞過程,例如關于隱藻PC645 中量子節拍的解釋仍然備受爭議,因為原子振動也可呈現出相似的觀測結果,而這種觀測結果很難區分是由哪種機制導致的[96]。因此,需要開發更合理的計算模型(如非微擾計算模型)[102],才能清楚地闡釋相干能量傳遞機制是否是藻類捕光天線高效捕光的“殺手锏”。另外,需要注意的是,現今發現的捕光天線內的量子節拍大多數測量于77 K,而考慮到藻類生存的溫度及溫度升高對量子退相干過程的加劇作用,在常溫下測量量子相干的意義重大。
關于PBS 光保護機制的研究還需要依賴相關復合物的結構解析。一方面,PBS 可通過橙色類胡蘿卜素蛋白(water-soluble orange carotenoid protein,OCP)依賴型NPQ 過程將多余的激發能進行熱耗散(圖4a)。但關于OCP 的結合位點仍存在爭議,雖然普遍認為活性OCP 可以結合PBS 的核心結構[103],但至今沒有相關的結構被解析,無法直觀的驗證該觀點。另一方面,PBS 可通過狀態轉換機制進行光保護,其機制不同于膜蛋白LHC(圖4)。為了避免PSII 能量過強導致光損傷,通常PBS 可通過移動傳能機制(圖4b,狀態一)和溢出機制(圖4b,狀態二)兩種途徑實現多余能量在光系統之間的重新分配[104]。遺憾的是,至今,兩種機制的結構僅局限于結構模型,直觀的結構解析將寄希望于未來原位結構生物學技術的進步及動態結構研究方法的開發。
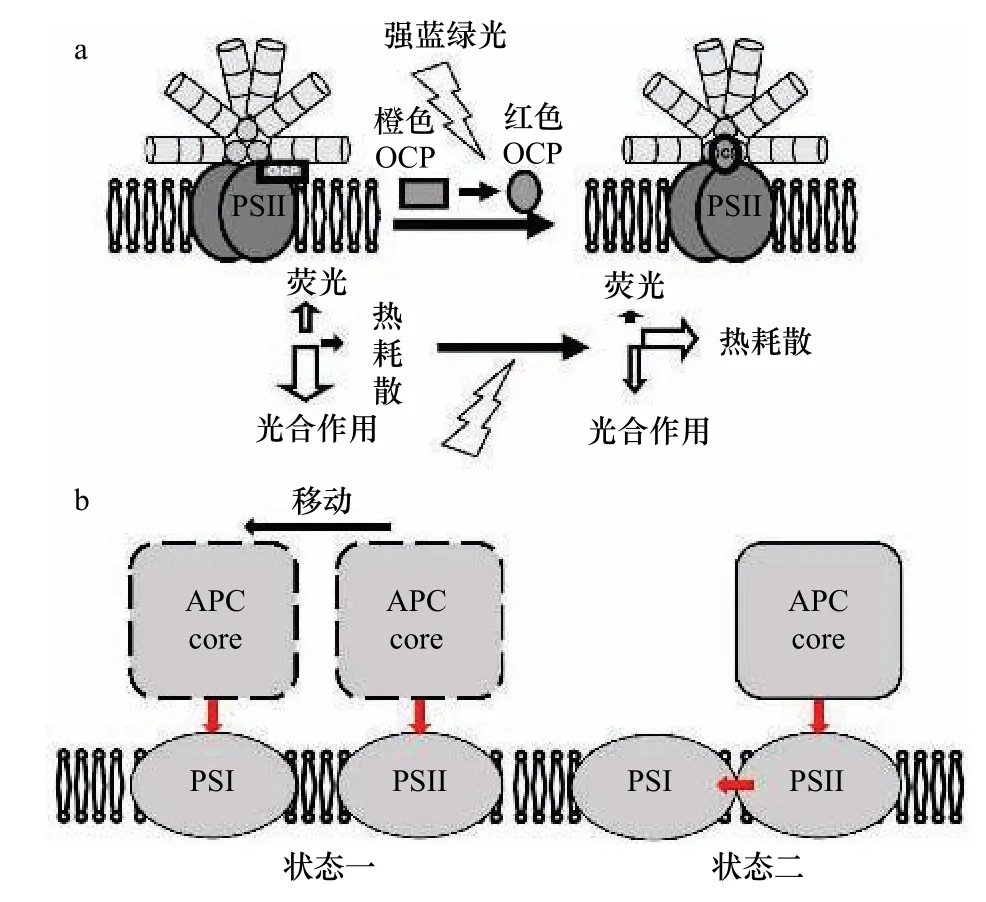
圖4 藻膽體光保護結構模型Fig.4 Photoprotective structural model of phycobilisomes
目前,仍有許多藻類捕光天線的精細結構未被解析,其中不乏有一些藻類擁有特殊結構的捕光天線。例如,極端環境中的藻類為了在多變的光環境或不尋常的溫度條件下,依然能維持捕光天線的結構穩定性和捕光效率,進化出了獨特的捕光天線結構。已發現嗜熱藍藻的捕光天線核結構中,含有結構特殊的PC(PC612),可使藻膽體在高溫條件結構依然穩定[105];南極紅藻可通過轉換不同的藻膽體類型來適應長期的光照環境和長期的黑暗環境[106]。但這些沒有細節的粗略結構只是提供了理解適應機制的可能方向,并不能輔助人們理解其特殊的捕光及傳能機制。例如,嗜熱藍藻中特殊結構的PC 在藻膽體傳能過程中的具體作用還不清楚;驅動南極紅藻兩種藻膽體轉換的具體機制以及兩種藻膽體與光系統的聯系仍未見報道。這些科學問題都需要通過解析精細結構,甚至是動態光環境下的精細結構來解釋。
現階段,藻類捕光天線系統結構生物學的研究已為深入揭示藻類光合作用高效能量傳遞機制奠定了堅實的結構基礎,驗證了結構生物學揭示的藻類捕光復合體結構與其功能的統一性。此外,通過特殊的捕光天線結構及其動態結構變化,進一步研究捕光天線對光環境的適應性,成為了未來的研究重點,這將為藻類捕光天線蛋白在光電器件領域的應用提供科學依據。

