6地小貫小綠葉蟬酶活性及其對藥劑的敏感性
從春蕾 張 鳳 石慶薈 劉天雷 孫月華 張玉波
(安順學院農學院;貴州省昆蟲信息系統與資源開發利用重點實驗室,貴州 安順561000)
小貫小綠葉蟬(Empoasca onukii Matsuda)是一種廣泛分布于我國茶區的重要害蟲,以成蟲和若蟲刺吸茶樹的嫩葉、嫩莖,極大影響茶葉產量及品質。其體小活躍、危害隱蔽,防治難度較大,目前藥劑防治仍為應急防治的主要手段,尚缺乏高效無害化的防治技術,因各地用藥種類、用藥強度等差異,小貫小綠葉蟬對常用殺蟲劑產生了抗藥性差異。抗藥性的產生會對昆蟲體內多種酶系產生誘導或抑制作用,而解毒酶和保護酶酶活性的增強是導致害蟲耐藥性和抗藥性增強的重要原因。李建宇等發現羧酸酯酶(CarE)和細胞色素P450氧化酶活性的增強在茶假眼小綠葉蟬對聯苯菊酯的抗性產生中起到了重要的作用。何發林等發現,溴氰蟲酰胺亞致死劑量初期可誘導小地老虎體內過氧化物酶 (POD) 、過氧化氫酶 (CAT) 、超氧化物歧化酶 (SOD) 活力升高,而對谷胱甘肽S-轉移酶 (GSTs) 活力則為明顯的誘導作用。通過多種昆蟲的抗藥性研究發現,不同地理種群體內相關酶活性具有明顯的地理差異性;王彩云等發現廣西4地稻縱卷葉螟幼蟲解毒酶活性越高對農藥的抗性也越強。本文測定了貴州6地代表性茶區小貫小綠葉蟬種群體內與抗藥性相關的3種保護酶[SOD、POD和CAT]和3種解毒酶[AchE、CarE和GSTs]活性,并對其藥劑敏感性進行測定,分析種群間相關酶活性及對藥劑的敏感性的關系,為小貫小綠葉蟬的防治策略提供理論依據。
1 材料與方法
1.1 供試蟲源與藥劑
2017年對貴州省安順、六枝、清鎮、都勻、遵義、鳳岡六個茶區進行小貫茶小綠葉蟬采集。每個茶區分別選擇茶園3-5個,每個茶園中5點取樣,每個點采集小貫小綠葉蟬不少于20頭,建立混合種群。
10%吡蟲啉WP(Imidacloprid 10WP),南京紅太陽股份有限公司生產;30% 吡蚜酮WP(Pymetrozine 30WP),廣西農喜作物科學有限公司生產;3%啶蟲脒FS(Acetamiprid 3FS),山東一覽科技有限公司生產。
1.2 試驗方法
1.2.1 酶活力測定
保護酶和解毒酶酶液的制備和酶活力的具體測定方法按照南京建成生物工程公司生產的試劑盒(SOD試劑盒:A001-1、POD試劑盒:A084、CAT試劑盒:A007-2、AchE試劑盒:A024、CarE試劑盒:A133、GSTs試劑盒:A004)說明書進行。每處理重復3次。
1.2.2 生物測定
分別對6個不同地理種群小貫茶小綠葉蟬種群進行生物測定,采用室內浸梢法,具體方法參照李建宇等。將供試藥劑配置成系列濃度藥液,以蒸餾水處理為空白對照。將茶枝放入配好的藥液中浸泡 15 s,迅速取出晾干后,插入50 mL離心管內的保濕花泥中。每管內接入20頭健康的小貫小綠葉蟬成蟲,用紗布封住管口,置于(26±1)℃,濕度(RH)70%~80%,光周期14 h∶10 h(L/D)氣候箱內飼養。48 h后,檢查存亡狀況,計算死亡率(以小毛筆或尖銳鑷子輕觸蟲體,試蟲不能協調運動者視為死亡),每處理 5 次重復。
1.3 數據統計與分析
實驗數據采用Excel 2010進行統計分析和SPSS 20.0進行數據分析,計算各種群對不同殺蟲劑的LC50值及其95%的置信區間、斜率,運用Duncan's新復極差法比較各酶活性的差異。同種藥劑對不同地理種群的LC50比率以幾個地理種群中LC50值最小的為參照進行計算。
2 結果與分析
2.1 不同地理種群小貫小綠葉蟬種群體內解毒酶活性
由表1可看出,貴州省不同地理種群小貫小綠葉蟬體內主要解毒酶活性間均存在顯著差異[GSTs(F=6.919,P<0.05)、CarE(F=20.574, P<0.05)和AchE(F=4.337,P<0.05)]。對于GSTs、CarE活性,以清鎮茶園小貫小綠葉蟬種群酶活性最高,分別為76.82U/mg、1.39U/mg,且均顯著高于其他茶區(P<0.05,下同)。對于AchE活性,以安順種群的酶活性最高,為0.57U/mg,高于清鎮和鳳岡種群但差異不顯著,顯著高于湄潭和六枝種群。
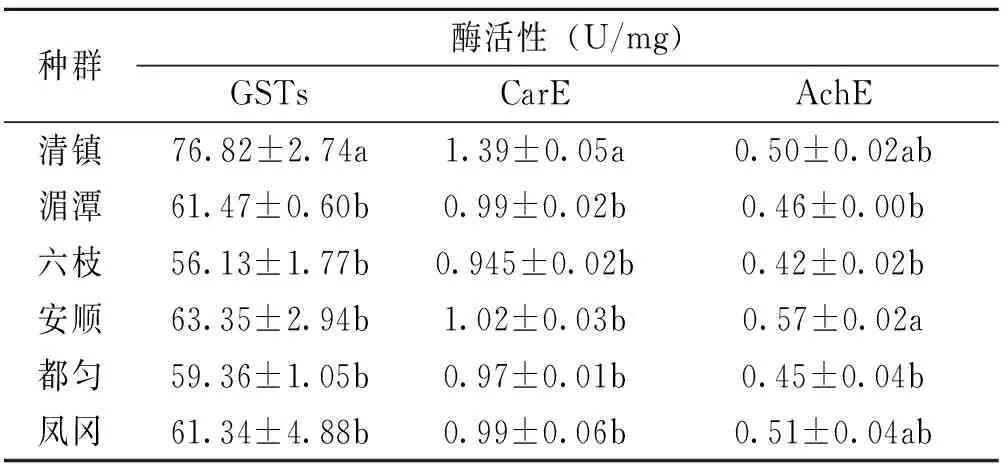
表1 不同地理種群小貫小綠葉蟬種群體內解毒酶活性
6個不同地理種群小貫小綠葉蟬種群體內的GSTs、CarE和AchE活性值分別為56.13~76.82、0.97~1.39和0.42~0.57U/mg,其中清鎮和安順種群的AchE、CarE和GSTs活性較高,六枝和鳳岡的種群較低。僅從3種解毒酶的酶活性來看,清鎮和安順種群具有較高的抗藥性,而六枝和鳳岡種群的抗藥性較低。
2.2 不同種群小貫小綠葉蟬體內保護酶活性測定結果
由表2可看出,各種群小貫小綠葉蟬間體內主要保護酶活性間均存在顯著差異[POD(F=28.257, P<0.05);SOD(F=4.372, P<0.05);CAT(F=5.778, P<0.05)],對于POD活性,以清鎮茶園小貫小綠葉蟬種群的活性最高,為0.83U/mg,且顯著高于其他茶區。對于SOD活性,以清鎮種群的活性最高,為5.87U/mg,且顯著高于其他茶區。對于CAT活性,以湄潭種群的活性最高,為1.12U/mg,除清鎮外酶活性均顯著高于其他茶區。

表2 不同地區小貫小綠葉蟬種群體內保護酶活性
6個采樣點小貫小綠葉蟬種群體內POD、SOD和CAT活性分別為0.55~0.83、3.02~5.87和0.68~1.12,其中以清鎮和湄潭種群的POD、SOD和CAT活性較高,鳳岡、六枝和安順種群的活性較低。僅從3種保護酶的活性來看,清鎮和湄潭種群具有較高的抗藥性,而鳳岡、六枝和安順種群的抗藥性較低。
2.3 不同種群小貫小綠葉蟬對不同藥劑的敏感性
如表3,使用吡蟲啉、吡蚜酮和啶蟲脒對6個種群的小貫小綠葉蟬進行敏感性的檢測。清鎮種群對吡蟲啉、吡蚜酮的敏感性顯著低于其余5個,都勻種群對啶蟲脒的敏感性顯著低于其余5個。

表3 不同種群小貫小綠葉蟬對不同藥劑的敏感性
通過表3中的比率可知,6個種群對吡蟲啉的敏感性差異達1~4.811倍,LC50范圍為88.195~18.331mg·L,其中,湄潭種群對吡蟲啉的敏感性最高,清鎮最低。6個種群對吡蚜酮的敏感性差異達1~3.232倍,LC50范圍為47.434~153.318mg·L,其中六枝種群對吡蚜酮的敏感性最高,清鎮最低。6個種群對啶蟲脒的敏感性差異達1~4.260倍,LC50范圍為3.223~13.73mg·L,其中六枝種群對啶蟲脒的敏感性最高,都勻最低。
3 討論
昆蟲生命代謝活動均需酶的參與,蟲體內酶催化調節進入的外來有害化合物經一系列的代謝降低其毒性或增強其水溶性,最終將其排出體外以達到解毒目的。在長期進化過程中,昆蟲除形成解毒酶系以降解進入蟲體的外來有害化合物外,同時還存在著清除外來有害物質的自由基,以保護細胞膜系統。昆蟲體內的保護酶和自由基在正常生理狀態下維持代謝平衡,但殺蟲劑、溫度、寄主植物等外源逆境能誘導其活性變化。本研究通過對貴州省6地小貫小綠葉蟬種群體內3種主要解毒酶活性和3種主要保護酶活性進行測定,發現清鎮和安順種群的AchE、CarE和GSTs活性均處于全省較高水平,六枝和鳳岡種群的活性處于較低水平;清鎮和湄潭種群的SOD、CAT和POD活性相對較高,鳳岡、六枝和安順種群的活性較低,可見貴州6地小貫小綠葉蟬種群的體內保護酶代謝存在一定的差異。
昆蟲酶活性與昆蟲對藥劑的敏感性之間有著密切的聯系,二化螟對三唑磷產生抗性導致酯酶、多功能氧化酶活性升高;乙酰膽堿酯酶活性隨稻縱卷葉螟對氯蟲·噻蟲嗪的抗藥性的升上而上升,在亞致死濃度下的吡蟲啉引起果蠅體內GST、CarE活性升高,吡蟲啉的脅迫對蜜蜂體內保護酶SOD、POD、CAT均有一個升高的過程。本研究測定了6個地理種群小貫小綠葉蟬對不同藥劑的敏感性,同樣發現6個種群對同種藥劑的敏感性差異為1~5倍不等,且對不同藥劑的敏感性水平也不相同。清鎮種群對吡蟲啉、吡蚜酮的敏感性最低,而GSTs、CarE、SOD和POD活性最高,可見小貫小綠葉蟬體內解毒酶、保護酶活性升高,其對藥劑的敏感性水平相對較低。整體來看,貴州茶區小貫小綠葉蟬6個地理種群在酶活性、藥劑敏感性等方面存在種群差異性。生產實際過程中使用化學農藥進行防治小貫小綠葉蟬時建議根據不同地理種群的抗藥性選擇防治藥劑,以提高防治效果。

