基于超聲影像組學模型預測浸潤性乳腺癌淋巴管血管侵犯狀態
南京醫科大學第一附屬醫院超聲診斷科,江蘇 南京 210000
超聲影像組學特征有成為診斷、分型、預測預后或評估治療反應的影像學標志物的潛力[1-3]。因此,本研究旨在開發并驗證一種基于二維超聲圖像的影像組學模型,幫助臨床醫師術前預測浸潤性乳腺癌(invasive breast cancer,IBC)患者的淋巴管血管侵犯(lymphovascular invasion,LVI)狀態,以制訂個體化治療策略。
1 資料和方法
1.1 研究對象
選取2018年1月—2019年4月于南京醫科大學第一附屬醫院術前進行超聲檢查的258例IBC患者,患者超聲圖像均來自于同一臺超聲儀器。納入標準:① 經術后病理組織學確診的IBC患者;② 無新輔助治療史;③ 術前2周內行超聲檢查;④ 臨床病理學資料及超聲圖像完整。排除標準:① 有其他腫瘤病史;② 多發性或非腫塊性病灶;③ 病灶在超聲檢查前已進行活檢;④ 超聲圖像未能成功提取特征。患者均為女性,年齡23~91歲,平均年齡54.56歲;腫塊最大徑為0.8~5.0 cm,平均直徑2.17 cm。
1.2 儀器與檢查方法
1.2.1 儀器
采用意大利Esaote公司的Mylab Twice彩色超聲診斷儀,使用高頻(4~13 MHz)線陣探頭(LA523)。
1.2.2 檢查方法
患者采用仰臥位或側臥位,雙手上舉,充分暴露雙側乳房及腋窩,由經驗豐富的超聲科醫師對完全暴露的乳頭乳暈及乳房各個象限進行全面掃描并保留腫塊最大截面。觀察腫塊的位置、形態邊緣、內部回聲、是否有鈣化及后方回聲等,根據美國放射學會(American College of Radiology,ACR)乳腺影像報告和數據系統(Breast Imaging Reporting and Data System,BIRADS)分類標準[4]對腫塊進行分類。同時檢查腋下Ⅰ、Ⅱ和Ⅲ區淋巴結,如果超聲檢查時發現至少有以下可疑表現之一,則認為腋窩淋巴結(axillary lymph node,ALN)陽性。① 淋巴結皮質厚度大于3 mm;② 長短徑比大于2;③ 淋巴門完全或部分消失;④ 彩色多普勒超聲圖像顯示非淋巴門型血流;⑤ 淋巴結內微鈣化。
1.3 臨床病理學資料
臨床病理學因素從南京醫科大學第一附屬醫院病歷系統中獲取,包括年齡、雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)、人表皮生長因子受體2(human epidermal growth factor receptor 2,HER2)、Ki-67標記指數及病理組織學類型(如浸潤性導管癌、小葉癌及其他等)。ER、PR陽性定義為ER、PR染色陽性≥10%。經免疫組織化學法檢測HER2時,若病灶為HER2+++時,則直接定義為HER2陽性;若病灶為HER2+或無表達時,則直接定義為HER2陰性;若表現為HER2++時,需進行熒光原位雜交(fluorescence in situ hybridization,FISH)檢測判斷HER2基因擴增狀態。根據2011年St.Gallen乳腺癌共識[5]將Ki-67>14%定義為Ki-67標記指數高。所有病灶術前均行穿刺活檢,ER、PR、HER2、Ki-67標記指數及病理組織學類型等臨床因素通過病灶粗針穿刺活檢獲得。
1.4 影像組學
1.4.1 腫瘤分割
腫瘤分割是由1名超聲科醫師使用ITK-SNAP軟件進行手動分割。在每例患者病灶超聲圖像的最大橫斷面上繪制感興趣區域(region of interest,ROI),沿著病灶的可見邊界,以囊括整個病灶(圖1)。在邊緣模糊或有毛刺的情況下,則盡可能完全地包括病灶,繪制病灶的最大范圍。分割結果最終由1名有15年工作經驗的超聲科醫師進行驗證。

圖1 ROI勾畫示意圖
1.4.2 特征提取與選擇
從二維超聲圖像中可提取出反映腫瘤異質性的影像組學特征,提取的影像組學特征可分為兩類:一階特征和紋理特征。一階特征包括形狀、大小特征和強度特征等。紋理特征的提取是基于4種紋理矩陣,包括灰度共生矩陣(grey level cooccurrence matrix,GLCM)、灰度運行長度矩陣(grey level run-length matrix,GLRLM)、灰度大小區域矩陣(grey level size zone matrix,GLSZM)和灰度依賴矩陣(gray level dependence matrix,GLDM)。所有的特征提取均采用開源Pyradiomics軟件包實現。為測試影像組學特征的穩定性,2名超聲科醫師隨機選取70例患者勾畫ROI,其中1名超聲科醫師在1周內獨立重復上述操作。通過計算組內相關系數(intraclass correlation coefficient,ICC)和組間相關系數(interclass correlation coefficient,CCC)來確定特征的穩定性,ICC和CCC低于0.75的特征被排除在最終的特征數據集中。2種機器學習算法,包括最大相關性最小冗余度(maximum relevance minimum redundancy,mRMR)和最小絕對收縮和選擇算子(the least absolute shrinkage and selection operator ,LASSO)回歸算法,被用于篩選與預測LVI狀態相關的影像組學特征。mRMR可最大限度區分LVI陰性和陽性的特征,并消除冗余和不相關的特征,本研究通過篩選,保留了30個特征。隨后使用LASSO回歸算法與懲罰參數調整進行10倍交叉驗證,選擇交叉驗證二項偏差最小的最優特征數據集,將非零系數定義為所選特征的權重,表示特征與LVI的相關性。
1.4.3 模型建立
3種術前預測LVI狀態的模型最終建立:影像組學評分、臨床模型及影像組學模型。為了建立臨床模型,我們對臨床參數進行單因素和多因素分析,最終將有統計學意義的參數納入臨床模型。并通過logistic回歸算法聯合影像組學評分和有效臨床參數,建立影像組學模型,以預測IBC患者術前LVI狀態。
1.4.4 模型評估
3種模型的診斷性能通過受試者工作特征(receiver operating characteristic,ROC)曲線分析評估,并使用Delong驗證來比較不同模型曲線下面積(areas under curve,AUC),確定它們的診斷效能之間是否有顯著差異。研究中預測數據和實際數據之間的差異通過校準曲線和Hosmer-Lemeshow試驗來評估。最終,通過對整個隊列中不同閾值概率下的凈效益進行量化,進行決策曲線分析(decision curve analysis,DCA)以確定影像組學模型的臨床有效性。
1.5 統計學處理
所有統計學分析均使用R 3.6.2軟件包進行。分類變量用百分比表示,采用χ2檢驗或Fisher精確檢驗;連續變量用±s表示,采用獨立樣本t檢驗。P<0.05為差異有統計學意義。本研究中所需R安裝包:使用“mRMR”包進行mRMR算法;LASSO Cox回歸使用“glmnet”包;“pROC”包用于繪制ROC曲線;“rms”包用于模型可視化和校準曲線;DCA通過“devtools”和“rmda”包執行。
2 結 果
2.1 臨床特征
訓練組和驗證組的臨床特征如表1所示,單因素分析顯示,年齡、LVI患者數目、超聲最大腫瘤直徑(maximum tumor diameter,MTD)、腫瘤病理組織學類型、ER、PR、HER2、Ki-67、超聲BI-RADS分類、超聲ALN狀態及ALN陽性數目等臨床參數在訓練組和驗證組之間差異無統計學意義。表2顯示了訓練組和驗證組中超聲ALN狀態和實際ALN狀態對比,兩者間差異無統計學意義(P=0.33)。本研究中超聲檢測ALN準確度、特異度、靈敏度、PPV及NPV分別為72.48%、94.61%、31.87%、76.32%及71.82%。
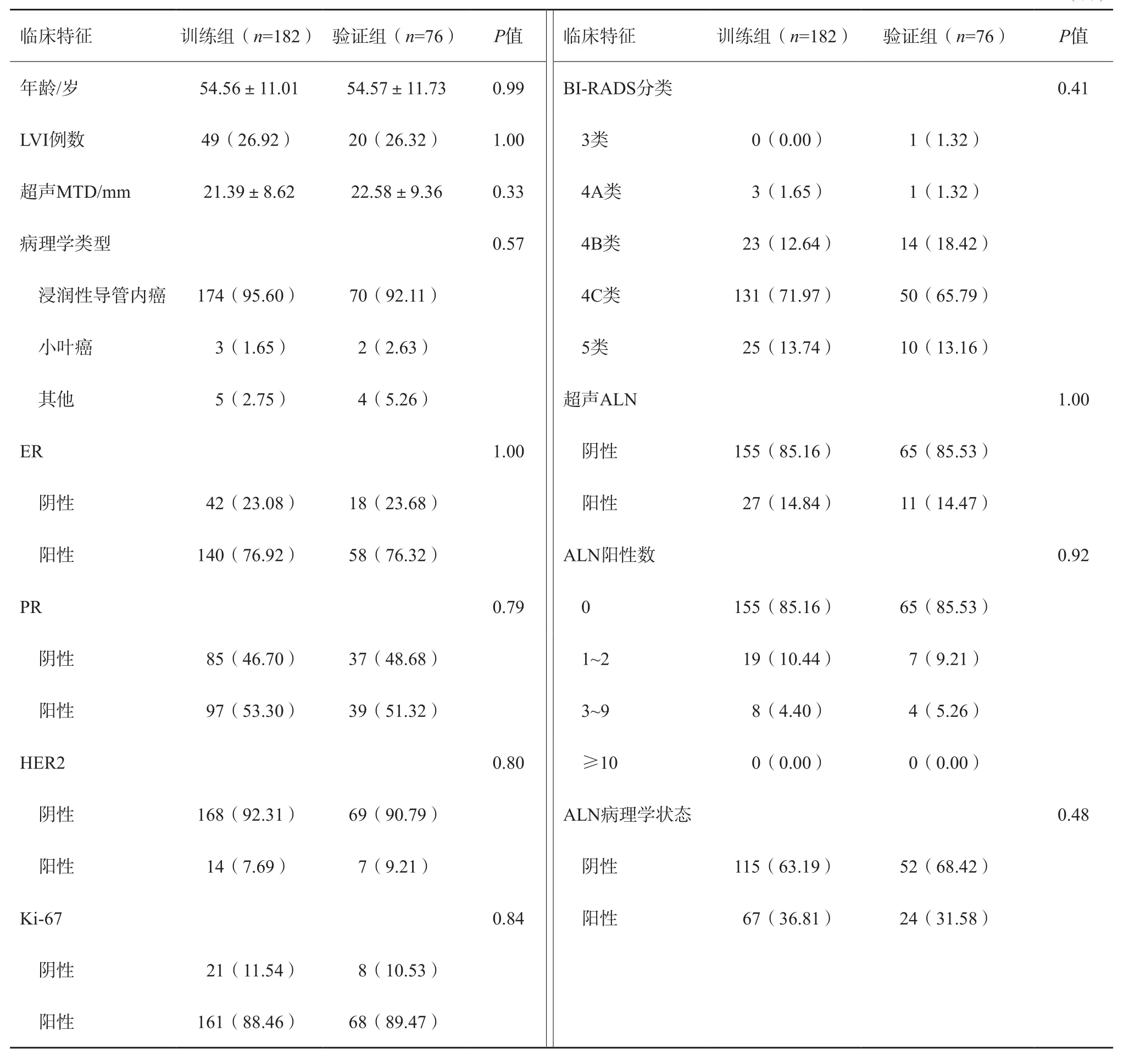
表1 訓練組和驗證組中臨床病理學特征比較 n(%)
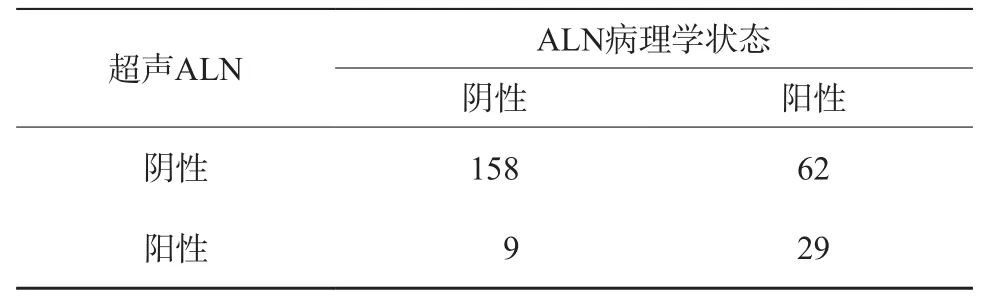
表2 超聲腋窩淋巴結和腋窩淋巴結病理學狀態
2.2 臨床模型建立
根據病理組織學結果,可將患者分為兩組:LVI陽性組和LVI陰性組。在訓練集中對LVI陽性及陰性組臨床特征進行單因素分析,如表3所示,年齡、超聲MTD、超聲BI-RADS分類、超聲ALN狀態及ALN陽性數目等臨床特征差異有統計學意義(P<0.05)。隨之,將單因素分析中有意義的臨床因素納入logistic多變量分析(表4),得出超聲ALN狀態及超聲BI-RADS分類是預測IBC患者LVI狀態的獨立影像因子,并根據多因素分析結果繪出臨床預測模型(圖2)。

表3 訓練組術前臨床病理學特征單因素分析結果 n(%)
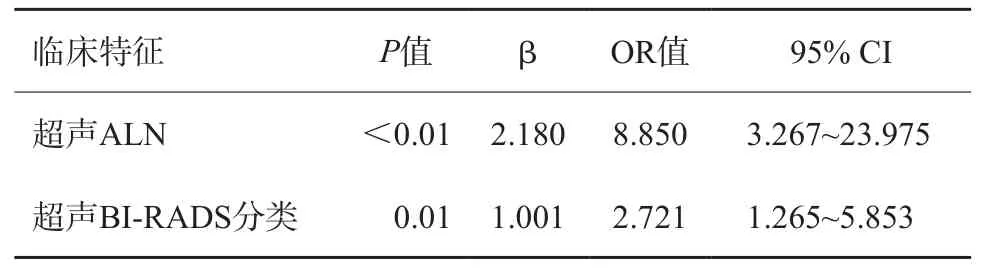
表4 訓練組術前臨床病理學特征多因素分析結果
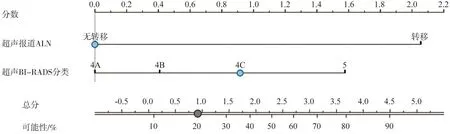
圖2 臨床模型
2.3 影像組學評分
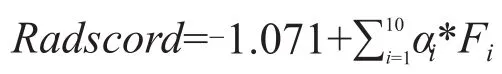
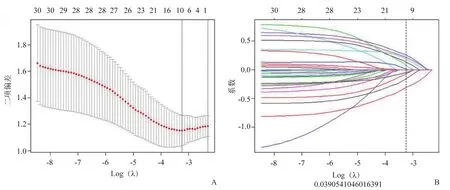
圖3 LASSO回歸算法

圖4 經mRMR及LASSO回歸算法選擇的特征

表5 公式系數及特征
2.4 聯合模型的建立和驗證
通過logistic回歸算法聯合影像組學評分和有效的臨床病理學參數,建立影像組學模型(圖5)。如圖6A、B所示,在訓練組中,影像組學模型在3種模型中均具有最好的預測能力,影像組學模型AUC為0.865,而另兩種模型分別為0.729和0.801,在驗證組中亦然(AUC:0.857 vs 0.786 vs 0.759),較之單純使用影像組學評分或臨床模型,聯合了超聲影像組學評分和有效臨床因素的影像組學模型預測能力顯著提高(表6)。校準曲線驗證了在訓練集和驗證集中預測的LVI狀態與實際LVI狀態有良好的一致性(圖7A、B),且通過Hosmer-Lemeshow檢驗,顯示預測數據和實際數據之間差異無統計學意義(P=0.371、0.094),說明組合模型具有良好的校準能力。圖8總結了DCA預測模型的臨床應用情況,結果證明,影像組學模型在很大的風險閾值概率范圍內可提高對LVI陽性風險的預測能力。因此,我們構建了一個列線圖以可視化方式表示預測結果。
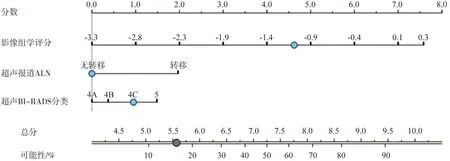
圖5 影像組學模型
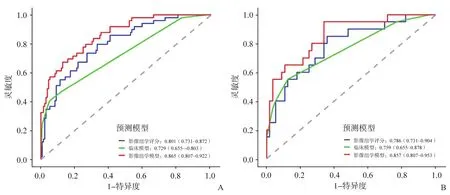
圖6 訓練組(A)及驗證組(B)中各個模型的ROC曲線
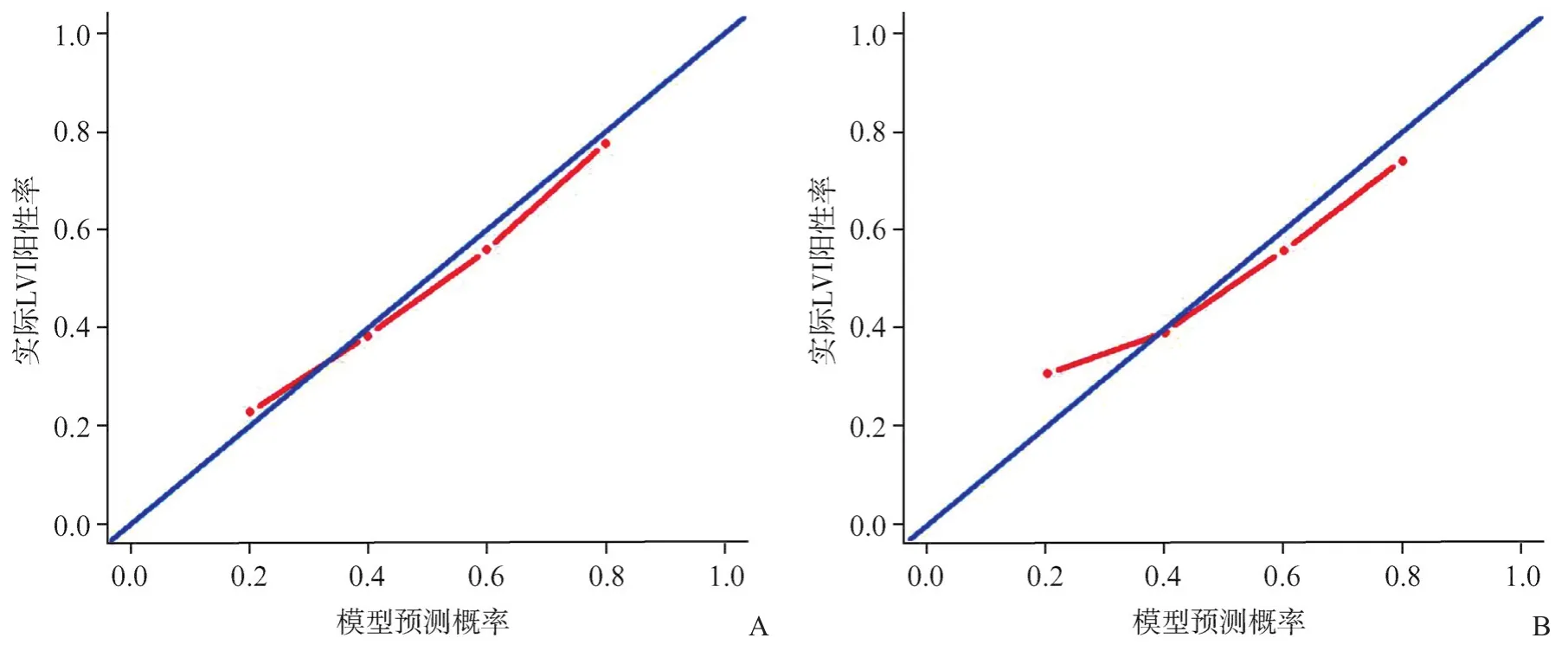
圖7 訓練組(A)及驗證組(B)中影像組學模型的校準曲線
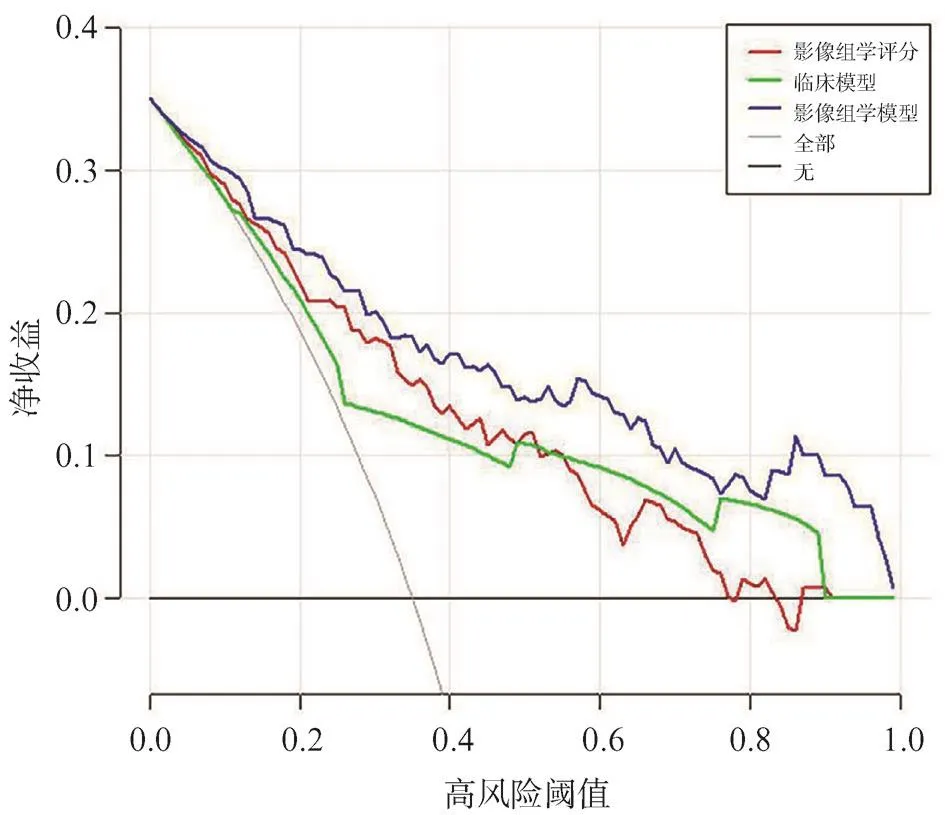
圖8 影像組學模型的DCA
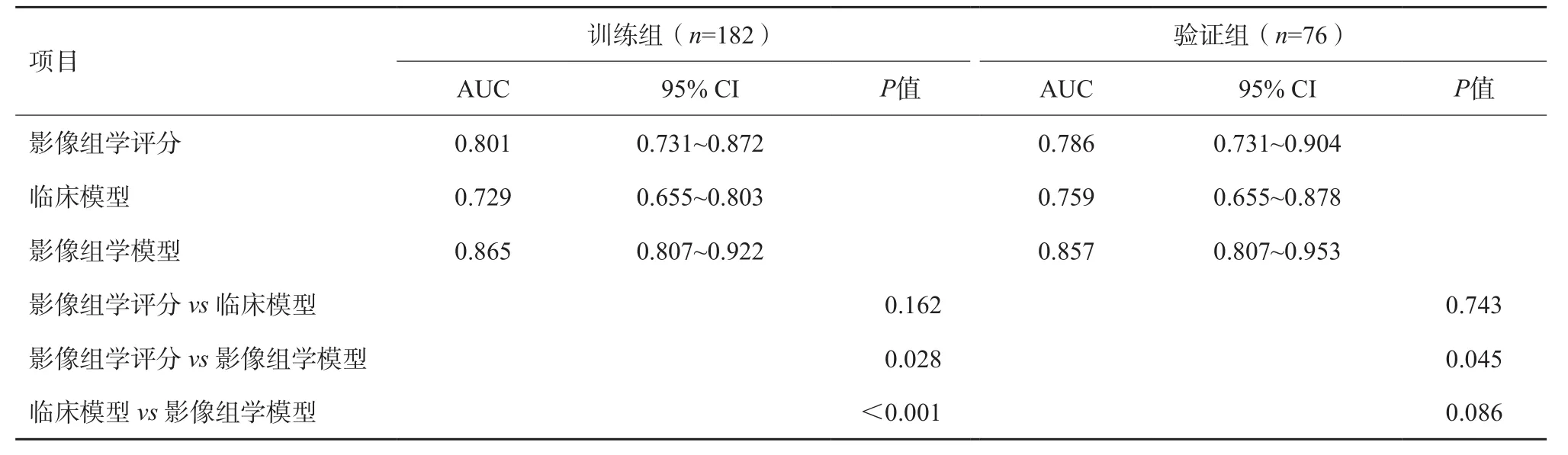
表6 3種預測模型的AUC比較
3 討 論
乳腺癌是女性最常見的惡性腫瘤,其預后情況也是人們關注的重中之重[6]。患者的年齡、腫瘤大小、ALN狀態、腫瘤的組織學分級、ER、PR和HER2等因素是評估乳腺癌患者預后和制訂適當的治療策略的重要指標[7-9]。而近年來,LVI也被報道為乳腺癌患者的一個較強的預后因素[10-11]。LVI是指腫瘤細胞侵犯淋巴管血管壁或彌漫于管腔內形成癌栓,是腫瘤細胞播散轉移導致疾病復發或進展的關鍵步驟超聲檢查可以發現較大脈管內形成的癌栓。先前的研究[12-14]發現,LVI與較低的平均年齡、Ki-67標記指數、腫瘤大小、陽性淋巴結和組織學分級等有關。本研究表明,ALN狀態與LVI陽性風險相關。LVI患者的ALN陽性概率大于無LVI患者,這與Zhang等[15]的觀點相似,這種相關性可以部分解釋ALN陽性乳腺癌患者的不良預后。超聲BI-RADS分類亦是IBC患者LVI狀態的一個重要的獨立預測因子。BI-RADS分類越高LVI陽性率越大,這或許是病灶的超聲BI-RADS分類越高,惡性征象(如邊緣毛刺或乳房懸韌帶受牽拉等)更多、更顯著,腫瘤侵襲性更強,發生LVI的可能性更大,導致預后更差[16-17]。
影像組學是一種計算機輔助技術,通過計算機算法將醫學影像信息轉換成一系列數據[18]。既往研究[19-20]發現,影像組學特征與腫瘤的微觀結構和生物學行為密切相關。影像組學特征反映了腫瘤的紋理信息,是判斷腫瘤內和腫瘤間異質性的重要指標。腫瘤內異質性可能是基因組異質性的結果,這與腫瘤進展和轉移行為有關,基因組異質性越大,腫瘤越容易轉移和產生耐藥性,預后就越差[21]。研究[22]表明,基因組異質性可以從醫學圖像中識別出來,然而,生物過程和影像組學特征之間的聯系仍然是復雜的。紋理特征可以量化單個腫瘤在結構和功能上的空間變化,而其中應用最廣泛的紋理特征便是GLCM,GLCM通過描述圖像灰度的空間相關特性來反映紋理信息,既往多項研究[23-26]支持GLCM與腫瘤內部異質性相關,這與本研究結果相一致。一階特征中的峰度也是本研究中影像組學評分的重要組成部分,是基于圖像直方圖平均值的不對稱分布尺度。峰度在影像組學研究中的應用也較為廣泛,在Niu等[27]的研究中證實了此項特征與腫瘤的異質性相關。
超聲醫師主觀判斷的超聲圖像特征,結合臨床病理學或基因因素,在術前預測IBC患者的LVI狀態[17]。本研究結果表明,根據影像組學特征權重開發的影像組學評分對LVI預測能力較佳。此外,將超聲影像組學評分納入臨床模型后,臨床模型的AUC從0.729顯著提高到0.865,預測LVI的能力優于單獨的影像組學評分和臨床模型,且在預測IBC患者LVI方面是穩定的。DCA顯示,比起臨床模型和影像組學評分,超聲影像組學模型將使更多的患者受益,這表明影像組學評分增加了臨床危險因素在臨床有用性方面的增量價值。因此,我們開發基于超聲影像組學特征的模型用于術前個體化預測IBC患者的LVI狀態,且為了臨床醫師使用更為便捷可視化,我們進一步開發了包含超聲影像學評分和臨床病理學特征等多種危險因素的列線圖,以幫助臨床醫師術前對患者LVI狀態進行個體化預測。
本研究有以下局限性:首先,由于樣本規模相對較小,統計能力可能會有所欠缺。其次,本研究完全是回顧性分析,需要通過前瞻性研究進行驗證,且缺乏多中心驗證。第三,Fujii等[28]發現,LVI中血管侵犯(blood vessel invasion,VI),而非淋巴管侵犯(lymphatic invasion,LI)可能是生物侵襲性的指標,是一個有效的預后因素。然而,本研究沒有單獨分析LI和VI對乳腺癌患者預后的影響,這也是我們未來研究的方向之一。
總之,影像組學特征可以作為術前預測IBC患者LVI情況的影像學標記,基于超聲影像組學評分和臨床病理學特征的影像組學模型有助于指導制訂個性化治療策略。

