細菌類多糖疫苗凍干工藝優(yōu)化研究
趙陽,周園,卓曉琴,楊淼,王弢

摘 要:目的 研究細菌類多糖疫苗凍干工藝優(yōu)化方法。方法 首先根據(jù)A群C群腦膜炎球菌多糖疫苗共晶點溫度確定預(yù)凍溫度;然后統(tǒng)計分析一次干燥階段和解析干燥階段制品溫度線與設(shè)定溫度線的重合時間,以確定一次干燥時間和解析干燥時間是否有縮短空間;最終確定優(yōu)化凍干工藝曲線后,進行凍干試驗,對優(yōu)化前后凍干產(chǎn)品進行質(zhì)量對比分析。結(jié)果 將A群C群腦膜炎球菌多糖疫苗凍干工藝優(yōu)化為:預(yù)凍-40℃,3h;一次干燥-45℃→-10℃→10℃→25℃→40℃→31℃,總時間為12h,真空控制為0.10~0.16mbar;解析干燥31℃、6h,真空控制為0.005mbar。優(yōu)化后A群C群腦膜炎球菌多糖疫苗的關(guān)鍵質(zhì)量屬性(外觀、復(fù)溶性、水分、分子大小和多糖含量)均符合質(zhì)量標(biāo)準,檢定結(jié)果無差異;優(yōu)化后凍干周期縮短310min。結(jié)論 優(yōu)化后A群C群腦膜炎球菌多糖疫苗凍干工藝周期明顯縮短,設(shè)備負荷和生產(chǎn)能源成本降低。
關(guān)鍵詞: 細菌類多糖疫苗,凍干工藝,優(yōu)化方法,凍干周期
中圖分類號:R392
細菌類多糖疫苗是預(yù)防病原菌感染的有效方法,其中A群C群腦膜炎球菌多糖疫苗是典型的、使用量較大的細菌類多糖疫苗,它是通過分別提取和純化A群和C群腦膜炎奈瑟球菌培養(yǎng)液的莢膜多糖抗原,混合后加入凍干保護劑,再通過凍干工藝而制成,用于預(yù)防A群和C群腦膜炎奈瑟球菌引起的流行性腦脊髓膜炎[1-2]。其中凍干工藝對制品延長保存期有良好的效果,目前凍干工藝優(yōu)化方法研究比較復(fù)雜,本文將以A群C群腦膜炎球菌多糖疫苗為例,通過測定共晶點,分析一次干燥和解析干燥制品溫度線與設(shè)定溫度線的重合時間,確定現(xiàn)有凍干工藝是否有優(yōu)化空間,以此確定細菌類多糖疫苗初步優(yōu)化凍干工藝。
1 材料與方法
1.1 材料和設(shè)備? A群C群腦膜炎球菌多糖疫苗半成品由蘭州生物制品研究所有限責(zé)任公司菌苗一室提供,共計6批,用于優(yōu)化前后凍干工藝質(zhì)量比對分析,使用設(shè)備為東富龍Lyo-15冷凍干燥機。
1.2 方法 首先根據(jù)A群C群腦膜炎球菌多糖疫苗共晶點溫度確定預(yù)凍溫度;然后統(tǒng)計分析一次干燥階段和解析干燥階段制品溫度線與設(shè)定溫度線的重合時間,以確定一次干燥時間和解析干燥時間是否有優(yōu)化空間;最終確定優(yōu)化凍干工藝曲線后,在A群C群腦膜炎球菌多糖疫苗分裝生產(chǎn)過程中,每批取600瓶,使用優(yōu)化后的凍干工藝進行凍干,共6批次;凍干結(jié)束后,分別對使用現(xiàn)有凍干工藝和優(yōu)化后凍干工藝的制品取樣,送公司質(zhì)量檢定室,檢測外觀、復(fù)溶性、水分、分子大小和多糖含量。對優(yōu)化前后凍干產(chǎn)品進行質(zhì)量對比分析,確認優(yōu)化后凍干工藝是否能夠滿足產(chǎn)品質(zhì)量要求。
2 結(jié)果
2.1? 根據(jù)A群C群腦膜炎球菌多糖疫苗共晶點溫度為-26℃,為保證全部凍結(jié),預(yù)凍溫度的設(shè)定要求比共晶點溫度低10~15℃[3],確定將現(xiàn)有凍干工藝預(yù)凍溫度從-45℃提升至-40℃;
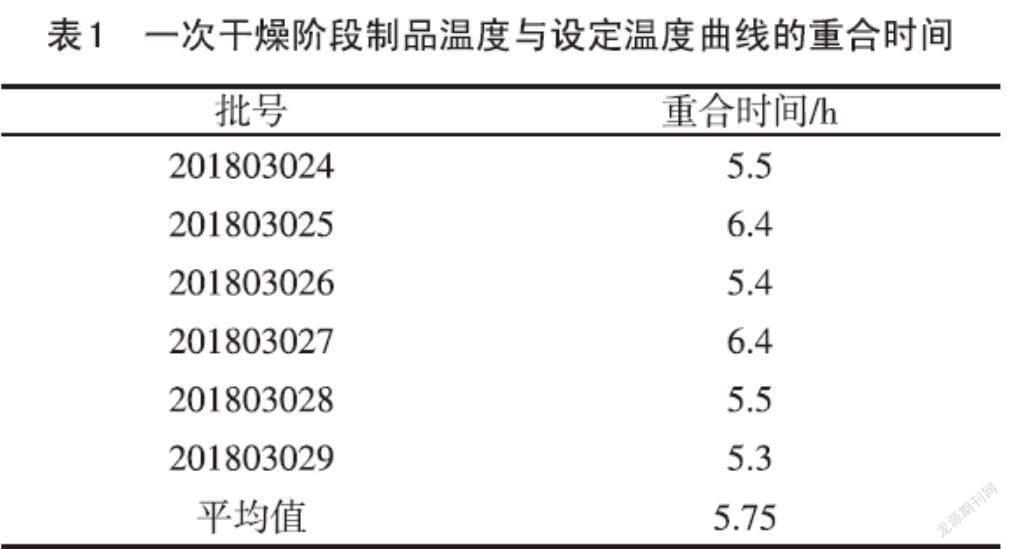
2.2? 一次干燥階段制品溫度線與設(shè)定溫度線的重合時間? A群C群腦膜炎球菌多糖疫苗現(xiàn)有凍干工藝中一次干燥階段為-45℃→-10℃→10℃→25℃→40℃→31℃,總時間為15.17h,真空控制為0.13~0.19mbar。根據(jù)表1中6批一次干燥階段制品溫度線與設(shè)定溫度線重合平均時間為5.75h,認為一次干燥時間有縮短的空間,同時考慮到制品溫度探頭位置、凍干機板層大小以及中心位置制品完全干燥等因素的影響,將A群C群腦膜炎球菌多糖疫苗凍干工藝一次干燥階段改為-45℃→-10℃→10℃→25℃→40℃→31℃,總時間為12h,真空控制為0.10~0.16mbar,一次干燥時間比原先縮短3.17h。
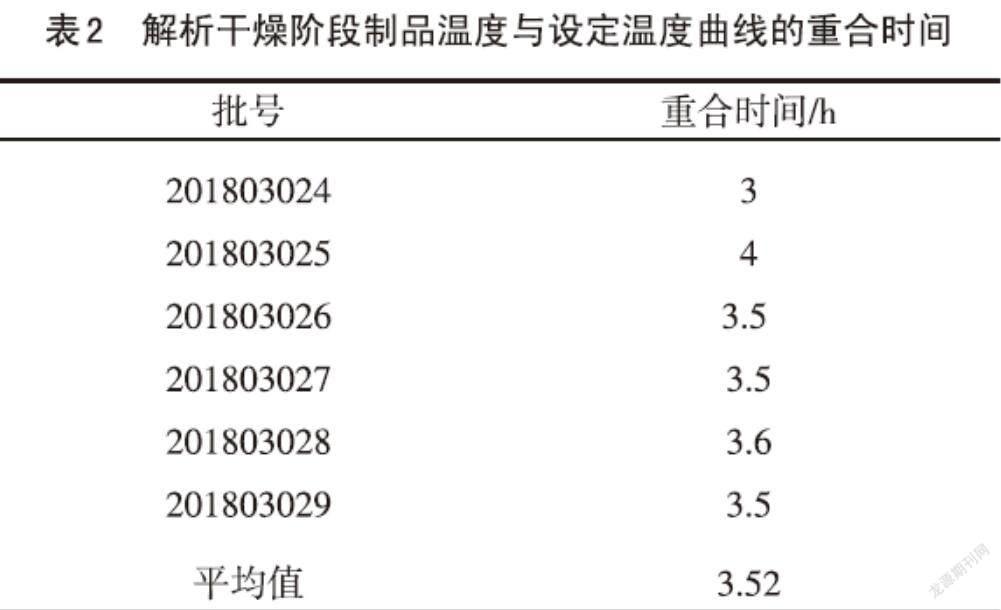
2.3? 解析干燥階段制品溫度線與設(shè)定溫度線的重合時間? A群C群腦膜炎球菌多糖疫苗現(xiàn)有凍干工藝中解析干燥階段為31℃、8h,真空控制為0.005mbar。根據(jù)表2中6批解析干燥階段制品溫度線與設(shè)定溫度線的重合平均時間為3.52h,認為解析干燥時間有縮短的空間,同時考慮到制品溫度探頭位置、凍干機板層大小以及中心位置制品完全干燥等因素的影響,將A群C群腦膜炎球菌多糖疫苗凍干工藝解析干燥階段改為31℃、6h,真空控制為0.005mbar,解析干燥時間比原先縮短2h。
2.4? 最終將A群C群腦膜炎球菌多糖疫苗凍干工藝優(yōu)化為:預(yù)凍-40℃,3h;一次干燥溫度設(shè)定為-45℃→-10℃→10℃→25℃→40℃→31℃,總時間為12h,真空控制為0.10~0.16mbar;解析干燥溫度設(shè)定為31℃、6h,真空控制為0.005mbar。優(yōu)化后凍干工藝預(yù)凍溫度從-45℃提升至-40℃,凍干周期縮短了310min。
2.5? 凍干工藝優(yōu)化前后質(zhì)量檢定結(jié)果如下:
2.6? 將表3檢定結(jié)果與質(zhì)量標(biāo)準分析比對后,可以看出使用現(xiàn)有凍干工藝和優(yōu)化后凍干工藝凍干A群C群腦膜炎球菌多糖疫苗,制品外觀、復(fù)溶性、水分、分子大小和多糖含量均符合質(zhì)量標(biāo)準要求,并且使用兩種凍干工藝,制品檢定結(jié)果無差異,優(yōu)化后凍干工藝能夠滿足產(chǎn)品質(zhì)量要求,同時具有生產(chǎn)適用性。
2.7 通過本研究初步確定了一種較為簡便的細菌類多糖疫苗凍干工藝優(yōu)化方法,即可以首先測定細菌類多糖疫苗共晶點溫度,以共晶點溫度為依據(jù)確定制品預(yù)凍溫度,一般預(yù)凍溫度比共晶點溫度低10~15℃;然后與現(xiàn)有凍干工藝預(yù)凍溫度做對比,確定是否需要改變現(xiàn)有凍干工藝預(yù)凍溫度;同時統(tǒng)計分析一次干燥階段和解析干燥階段制品溫度線與設(shè)定溫度線的重合時間,以確定一次干燥時間和解析干燥時間是否有縮短空間;最終確定凍干工藝優(yōu)化曲線后,進行凍干試驗,比對優(yōu)化前后凍干產(chǎn)品質(zhì)量檢定結(jié)果,確認優(yōu)化后凍干工藝是否能夠滿足產(chǎn)品質(zhì)量要求。
3 討論
冷凍干燥是一個復(fù)雜的傳熱傳質(zhì)過程。在生物制品凍干過程中,除了考慮凍干后制品的外觀成型要好、干損率少、殘余水分含量小于 3%外,還應(yīng)重點考慮凍干過程對生物活性物質(zhì)的凍結(jié)過程損傷和干燥過程損傷[4-5]。
在確定預(yù)定溫度時,除了以共晶點溫度為依據(jù)外,還應(yīng)考慮凍干機型號以及板層面積等因素,以保證制品能夠全部凍結(jié)。在確定一次干燥階段和解析干燥階段時間時,本文采用的原理為產(chǎn)品升華帶走大量的熱,從而導(dǎo)致制品溫度一直低于設(shè)定溫度,干燥結(jié)束后,升華帶走熱量的現(xiàn)象停止,產(chǎn)品溫度與設(shè)定溫度達到一致,同時考慮到制品溫度探頭位置、凍干機板層大小以及中心位置制品完全干燥等因素的影響,一般將一次干燥和解析干燥設(shè)定時間略長于制品溫度線與設(shè)定溫度線的重合時間。
本研究中可以看出,使用優(yōu)化后的凍干工藝凍干A群C群腦膜炎球菌多糖疫苗時,其關(guān)鍵質(zhì)量結(jié)果無差異,同時優(yōu)化后的凍干工藝提升了預(yù)凍溫度和縮短凍干周期,設(shè)備負荷和生產(chǎn)能源成本降低。這將對后期凍干工藝變更提供有利支撐。另外,本試驗初步確定了凍干工藝的優(yōu)化方法,可以通過初步確定的凍干工藝做進一步的優(yōu)化研究。
致謝:感謝蘭州生物制品研究所有限責(zé)任公司質(zhì)量檢定室對試驗的幫助。
參考文獻
[1] Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Repubic of China(Vol Ⅲ)[S]. Beijing:China Med Sci Press,
2010:41-43.(in Chinese)國家藥典委員會. 中華人民共和國藥典(三部)[S]. 北京:中國醫(yī)藥科技出版社,2010:41-43.
[2] Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Repubic of China(Vol Ⅲ)[S]. Beijing:China Med Sci Press,2015:71-73.(in Chinese)國家藥典委員會. 中華人民共和國藥典(三部)[S]. 北京:中國醫(yī)藥科技出版社,2015:71-73.
[3]馬兆堂,丁敏.淺談藥物凍干曲線的制定及常見問題分析[J].當(dāng)代化工研究,2017,04:146-147.
[4]徐斌,王弢,周園,李睿,劉毅.麻疹減毒活疫苗凍干工藝的優(yōu)化[J].中國生物制品學(xué)雜志,2010 ,23(12):1343-1346.
[5] 華澤釗,任禾盛.低溫生物醫(yī)學(xué)技術(shù)[M].北京:科學(xué)出版社,1994.

