肺癌免疫治療預(yù)測指標(biāo)在非小細(xì)胞肺癌免疫治療中的預(yù)測價值
周英 吳賓 劉紅崗 段鴻濤 常寧 張勇 許天齊 張艱
1空軍軍醫(yī)大學(xué)第一附屬醫(yī)院呼吸與危重癥醫(yī)學(xué)科,西安710032;2空軍軍醫(yī)大學(xué)第二附屬醫(yī)院胸外科,西安710032
肺癌免疫治療不僅革命性地改變了癌癥治療的格局,而且也改變了癌癥治療的理念[1]。目前臨床上最廣泛、最成功使用的是免疫檢查點抑制劑(i mmune checkpoint inhibitors,ICIs)[2],如細(xì)胞毒性T 淋巴細(xì)胞抗原4和PD-1/PD-L1。 “精準(zhǔn)醫(yī)療計劃”[3]是期望個體化治療能為患者帶來最大化臨床獲益,而生物標(biāo)志物為個體化治療的指明了方向。PD-L1 在免疫治療中初露鋒芒。研究發(fā)現(xiàn),PD-L1高表達(dá)與ICIs治療的高應(yīng)答率及臨床獲益有關(guān),PD-L1高表達(dá)者有更好的總生存期 (overall survival,OS)和無進(jìn)展生存期 (progression-free survival,PFS)[4-6],但是免疫治療未在所有PD-L1表達(dá)陽性的患者中獲益[4]。有研究發(fā)現(xiàn)無論PD-L1表達(dá)水平如何,患者都表現(xiàn)出臨床獲益[7]。腫瘤突變負(fù)荷 (tu mour mutation burden,T MB)是另一種預(yù)測生物標(biāo)志物。雖然大量臨床研究結(jié)果顯示,接受ICIs的肺癌患者中,高T MB具有更高的總體應(yīng)答率、PFS 及持久的臨床獲益,甚至是OS[8-9],但是T MB成本高且耗時,需專業(yè)人士解讀報告,缺乏標(biāo)準(zhǔn)化檢測平臺和統(tǒng)一的T MB 閾值。還有一些其他的生物標(biāo)志物也都表現(xiàn)出一定的缺陷。
越來越多的研究結(jié)果證實系統(tǒng)性炎癥反應(yīng)與腫瘤的發(fā)生、發(fā)展有著千絲萬縷的聯(lián)系[10],而外周促炎狀態(tài)與癌癥患者較差的預(yù)后有關(guān)[11]。許多血液常規(guī)參數(shù)被認(rèn)為是癌癥患者潛在的炎性生物標(biāo)志物,且與癌癥的預(yù)后有關(guān),如白細(xì)胞計數(shù)、絕對中性粒細(xì)胞計數(shù)、絕對血小板計數(shù)、乳酸脫氫酶(lactate dehydr ogenase,LDH)水平和白蛋白水平[12-14]。一些潛在的生物標(biāo)志物,如中性粒細(xì)胞與淋巴細(xì)胞的比率 (neutr ophil to ly mphocyte ratio,NLR)[15-16]、衍生的中性粒細(xì)胞與淋巴細(xì)胞的比率[17-18]、Gustave Roussy免疫評分[19]、肺癌免疫預(yù)后指數(shù)[20-21]等與癌癥的免疫治療預(yù)后相關(guān)。
然而,以往的研究多集中在非肺癌或非免疫治療方面,炎性生物標(biāo)志物在非小細(xì)胞肺癌 (nons mall cell l ung cancer,NSCLC)免疫治療中的預(yù)后和預(yù)測價值尚不完全清楚。因此本研究提出了簡單、實用、經(jīng)濟(jì)、方便的肺癌免疫治療預(yù)測指標(biāo)(l ung cancer i mmunot herapy predictive index,IOPI),即NLR 聯(lián)合LDH,用來預(yù)測接受ICIs治療的NSCLC患者預(yù)后。
1 對象與方法
1.1 研究對象 本研究為多中心回顧性研究,納入2018年1月至2019年7月就診于空軍軍醫(yī)大學(xué)第一附屬醫(yī)院(呼吸與危重癥醫(yī)學(xué)科及腫瘤科)和空軍軍醫(yī)大學(xué)第二附屬醫(yī)院(呼吸內(nèi)科、胸外科及腫瘤科)的88例確診NSCLC并接受PD-1/PD-L1抑制劑治療的患者,隨訪截至2020年7月。納入標(biāo)準(zhǔn):(1)18歲以上的成人患者;(2)組織學(xué)或細(xì)胞學(xué)證實的NSCLC;(3)至少一次根據(jù)實體瘤評估(response eval uation criteria in solid t u mors,RECIST)標(biāo)準(zhǔn)1.1對病灶進(jìn)行評估[22]; (4)使用PD-1/PD-L1抑制劑治療。排除標(biāo)準(zhǔn):(1)治療前1周內(nèi)有持續(xù)非癌癥相關(guān)炎癥、免疫性疾病或終末期肝病或血液病;(2)既往有其他癌癥或伴發(fā)其他癌癥; (3)對免疫治療過敏或不耐受 (圖1)。本研究獲得空軍軍醫(yī)大學(xué)第一附屬醫(yī)院醫(yī)學(xué)倫理委員會批準(zhǔn)(KY20202077-C-1)。
1.2 臨床資料收集 收集電子病例系統(tǒng)中NSCLC患者免疫治療前的基線資料:性別、年齡、吸煙史、免疫組織化學(xué)染色結(jié)果、臨床分期、轉(zhuǎn)移部位及轉(zhuǎn)移部位數(shù)、驅(qū)動基因突變狀態(tài)、腫瘤細(xì)胞PDL1表達(dá)狀態(tài)、體力狀況評分、曾經(jīng)治療方案、免疫治療線數(shù)、白細(xì)胞計數(shù)、中性粒細(xì)胞計數(shù)、淋巴細(xì)胞計數(shù)和LDH。
1.3 評價標(biāo)準(zhǔn) 每6周根據(jù)RECIST 1.1標(biāo)準(zhǔn)[22]對免疫治療NSCLC患者進(jìn)行一次疾病評估。完全緩解指所有靶病灶消失,無新病灶出現(xiàn),且腫瘤標(biāo)志物正常,至少維持4周。部分緩解指靶病灶最大徑之和減少≥30%,至少維持4周。疾病穩(wěn)定指靶病灶最大徑之和縮小未達(dá)完全緩解,或增大未達(dá)疾病進(jìn)展。疾病進(jìn)展指靶病灶最大徑之和至少增加≥20%,或出現(xiàn)新病灶。客觀緩解率指經(jīng)治療后獲得完全緩解和部分緩解的病例數(shù)占整個可評價例數(shù)的百分比,即客觀緩解率= (完全緩解+部分緩解)/總例數(shù)×100%。疾病控制率指經(jīng)治療后獲得緩解和病變穩(wěn)定的病例數(shù)占整個可評價例數(shù)的百分比,即疾病控制率= (完全緩解+部分緩解+疾病穩(wěn)定)/總例數(shù)×100%。OS定義為從啟動免疫治療到任何原因?qū)е滤劳龅臅r間或最后一次隨訪時間(刪失),PFS 為從啟動免疫治療到疾病進(jìn)展或任何原因?qū)е滤劳龅臅r間。
1.4 觀察指標(biāo) 本研究觀察的指標(biāo):(1)免疫治療前NLR、LDH; (2)PFS 和OS。繪制NLR、LDH 的受試者工作特征曲線 (receiver operating characteristic cur ve,ROC),計算曲線下面積(area under the curve,AUC)得出NLR、LDH的截斷值。根據(jù)NLR、LDH 的截斷值分為低風(fēng)險IOPI組(0或1個因素)和高風(fēng)險IOPI組 (2個因素)。
1.5 統(tǒng)計學(xué)分析 數(shù)據(jù)分析采用IBM SPSS v.22軟件和Graph Pad Pris m 8軟件。患者基線資料中的計量資料若符合正態(tài)分布用x-±s 表示,組間比較采用t 檢驗;若符合偏態(tài)分布用M(QR)表示,組間比較用Wilcoxon秩和檢驗;計數(shù)資料用頻數(shù)(%)表示,組間比較采用χ2檢驗或Fisher精確檢驗。繪制NLR、LDH 的ROC曲線,應(yīng)用AUC確定截斷值。單因素和多因素分析采用COX 風(fēng)險比例回歸模型,把單因素有統(tǒng)計學(xué)意義的變量納入到多因素分析中,結(jié)果用風(fēng)險比 (hazard ratios,HR )、95%置信區(qū)間 (confidence inter vals,CI)表示。生存分析采用Kaplan-Meier法和log-rank檢驗。P <0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 NLR 和LDH 的截斷值 繪制NLR 和LDH的ROC,得出AUC 分別為0.671、0.649。NLR和LDH 的最大約登指數(shù)分別為1.34、1.30,對應(yīng)指標(biāo)數(shù)值分別為3.4、185,敏感度和特異度分別為75.0% 和58.8%、73.4% 和56.4%。因 此 得 出NLR 截斷值為3.4,LDH 截斷值為185 IU/L,根據(jù)NLR>3.4和LDH>185 I U/L 將患者分為低風(fēng)險IOPI組(0或1個因素)和高風(fēng)險IOPI組 (2個因素)。見圖2、3。

圖1 NSCLC患者免疫治療研究流程圖
2.2 免疫治療人群基線資料 本研究共納入88例接受免疫治療的NSCLC患者,隨訪時間13.1 (5)個月。其中男74例 (84%),年齡 (61±11)歲,66例(75%)吸煙患者;46 例 (52%)腺癌,35例(40%)鱗癌,7例(8%)其他NSCLC。有26例(30%)患者檢測PD-L1 表達(dá)量 (采用免疫組織化學(xué)法),其中20 例 (77%)陽性 (PD-L1≥1%),6例 (23%)陰性。低風(fēng)險IOPI組63 例,高風(fēng)險IOPI組25例,2組各項基線資料差異均無統(tǒng)計學(xué)意義(P 值均>0.05)。見表1。
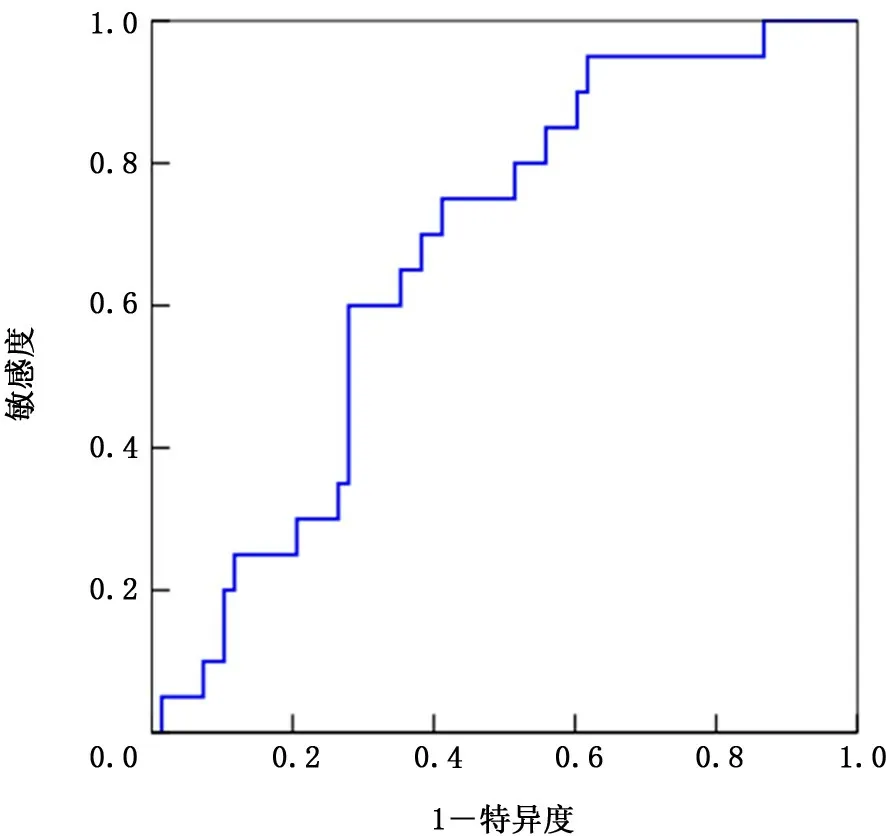
圖2 中性粒細(xì)胞與淋巴細(xì)胞比率的受試者工作特征曲線
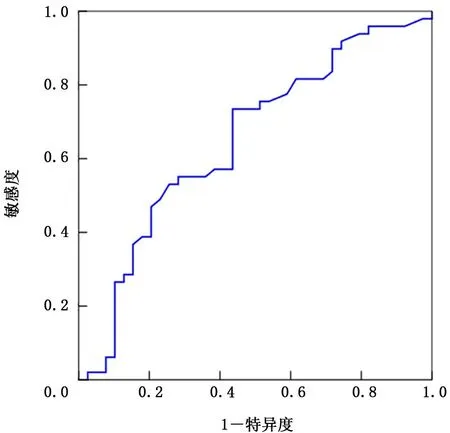
圖3 乳酸脫氫酶的受試者工作特征曲線
2.3 預(yù)后危險因素及預(yù)后分析 88例接受免疫治療的NSCLC 患者PFS 和OS 分別為11.4 (5.0)個月和12.1 (5.8)個月。通過單因素COX 風(fēng)險回歸模型分析年齡、吸煙史、轉(zhuǎn)移臟器數(shù)、免疫治療線數(shù)、病理分型、分期、NLR、LDH 及IOPI分組與PFS和OS的相關(guān)性(表2、3)。結(jié)果表明轉(zhuǎn) 移 臟 器 數(shù)≥2 個、NLR ≥3.4 組、LDH ≥185 IU/L組及高風(fēng)險IOPI組與接受免疫治療的NSCLC 患者的較差PFS 相關(guān) (P 值 均<0.05)(表2)。鱗癌患者、NLR≥3.4組、LDH≥185 IU/L組及高風(fēng)險IOPI組與接受免疫治療的NSCLC 患者的較差OS相關(guān)(P 值均<0.05)(表3)。
將單因素分析中P <0.05的變量納入到多因素COX 風(fēng)險回歸模型中進(jìn)行分析。PFS多因素分析模型1:將轉(zhuǎn)移臟器數(shù)、NLR、LDH 納入到多因素分析中,結(jié)果顯示LDH≥185 IU/L組與較差的PFS顯著相關(guān) (HR =2.48,95%CI:1.30~4.70,P =0.006);PFS多因素分析模型2:將轉(zhuǎn)移臟器數(shù)和IOPI分組納入到多因素分析模型中,結(jié)果顯示高風(fēng)險IOPI 組與較差PFS 顯著相關(guān)(HR =1.95,95% CI:1.08 ~3.53,P =0.026),見表2。OS多因素分析模型1:將病理分型、NLR、LDH 納入到多因素分析中,結(jié)果顯示鱗癌患者和LDH≥185 IU/L 組與較差的OS顯著相關(guān)(HR =3.42,95%CI:1.22~9.64,P =0.020;HR =3.28,95%CI:1.15~9.33,P =0.026);OS 多因素分析模型2:將病理分型和IOPI分組納入到多因素分析模型中,結(jié)果顯示鱗癌患者和高風(fēng)險IOPI組與較差的OS 顯著相關(guān)(HR=3.12,95%CI:1.17~8.35,P=0.023;HR =3.22,95%CI:1.29~8.06,P =0.012),見表3。以上結(jié)果表明,LDH≥185 IU/L 組和高風(fēng)險IOPI組的是NSCLC 免疫治療疾病進(jìn)展的獨立危險因素,LDH≥185 IU/L 組、高風(fēng)險IOPI組和鱗癌是死亡的獨立危險因素。
進(jìn)一步通過Kaplan-Meier 生存分析法和log-rank檢驗比較LDH 不同分組和IOPI不同分組對患者PFS 和OS 的影響。在88 例總?cè)巳褐校琇DH<185 IU/L組35例,LDH≥185 IU/L組53例。LDH <185 IU/L 組 的PFS 高 于LDH ≥185 IU/L組 [12.4 (8.2)個月比7.8 (7.5)個月],LDH<185 IU/L組1年的生存率高于LDH≥185 IU/L 組 (83.6%比56.6%),LDH≥185 IU/L組與LDH<185 I U/L組的PFS和OS比較,差異均有統(tǒng)計學(xué)意義 (P 值均<0.05)。低風(fēng)險IOPI組的PFS高于高風(fēng)險IOPI組 [11.2 (7.1)個月比7.6 (8.0)個月],低風(fēng)險IOPI組1年的生存率高于高風(fēng)險IOPI組 (77.7%比42.9%),低風(fēng)險IOPI組與高風(fēng)險IOPI組的PFS和OS比較,差異均有統(tǒng)計學(xué)意義 (P 值均<0.05),見圖4。以上結(jié)果表明,LDH≥185 IU/L 組與高風(fēng)險IOPI組與NSCLC免疫治療患者的不良預(yù)后相關(guān)。

表1 88例免疫治療非小細(xì)胞肺癌患者基線資料
3 討論
越來越多的研究結(jié)果顯示,全身炎癥反應(yīng)與腫瘤的發(fā)生、發(fā)展有著密不可分的關(guān)系[10],外周促炎狀態(tài)與癌癥患者不良預(yù)后有關(guān)[10,13,23]。多個系統(tǒng)性炎癥反應(yīng)的生物標(biāo)志物 (如C-反應(yīng)蛋白、白蛋白、LDH、中性粒細(xì)胞計數(shù)、淋巴細(xì)胞計數(shù)等)與癌癥患者不良預(yù)后相關(guān)[12-14,24]。然而,這些生物標(biāo)志物對肺癌免疫治療效果的影響尚不清楚。
本研究共88 例NSCLC 患者接受免疫治療,結(jié)果顯示總?cè)巳旱腜FS 和OS 分別為11.4 (5.0)個月和12.1 (5.8)個月。總?cè)巳旱闹形籓S與之前的研究基本一致[4,25-26],但是本研究的中位PFS較其它研究稍長,一是因為本研究一線使用免疫治療人群比例高 (38%);二是因經(jīng)濟(jì)原因,部分患者自行延長了評估病情的間隔時間,遠(yuǎn)超過每6周評估1次。
本研究發(fā)現(xiàn)LDH≥185 IU/L 組是NSCLC 免疫治療疾病進(jìn)展和死亡的獨立危險因素,LDH≥185 IU/L組比LDH<185 IU/L 組的疾病進(jìn)展和死亡風(fēng)險均明顯增加 (HR =2.48,95%CI:1.30~4.70,P =0.006;HR =3.28,95%CI:1.15~9.33,P =0.026)。既往研究發(fā)現(xiàn)即使在有氧條件下,癌細(xì)胞為滿足快速增長和增殖的需求,消耗高水平的葡萄糖,導(dǎo)致乳酸產(chǎn)量增加。這一過程被稱為War bur g 效應(yīng),是由代謝酶LDH 催化的[27]。血清LDH 水平升高與許多實體腫瘤的不良預(yù)后有關(guān),如黑色素瘤、肺癌等[27-29]。目前LDH沒有統(tǒng)一的截斷值,范圍從200~1 000 IU/L 或1~2.5倍正常值高限。Mezquita等[21]發(fā)現(xiàn)接受免疫治療的NSCLC 患者中LDH≥正常值高限的患者與較差的PFS 和OS 相關(guān) (HR =1.43,95%CI:1.04~4.67,P =0.040;HR =1.36,95%CI:1.02~1.83,P=0.040),這與本研究結(jié)果基本一致。
本研究單因素結(jié)果顯示NLR≥3.4組與較差的PFS和OS相關(guān),但多因素分析結(jié)果顯示NLR≥3.4組與PFS和OS無明顯的相關(guān)性。NLR 的預(yù)后價值已經(jīng)在不同類型的癌癥中得到驗證。在肺癌免疫治 療 中,Bagley 等[15]和 Soyano 等[16]的研究顯示高NLR與NSCLC免疫治療中較差的OS和PFS相關(guān)。這與本研究結(jié)果稍有不同,可能由于樣本量和截斷值的問題。目前NLR 缺乏統(tǒng)一的截斷值(2.0~5.0)[30],Jiang等[30]研究發(fā)現(xiàn)不同的NLR 截斷值與OS獲益之間無相關(guān)性,而Mei等[31]發(fā)現(xiàn)較高的NLR 截斷值與更差的PFS相關(guān)。因此需要進(jìn)一步擴(kuò)大樣本或開展前瞻性研究,明確NLR 在接受免疫治療NSCLC的獨立預(yù)后價值。

表2 88例免疫治療非小細(xì)胞肺癌患者無進(jìn)展生存期的單因素和多因素分析
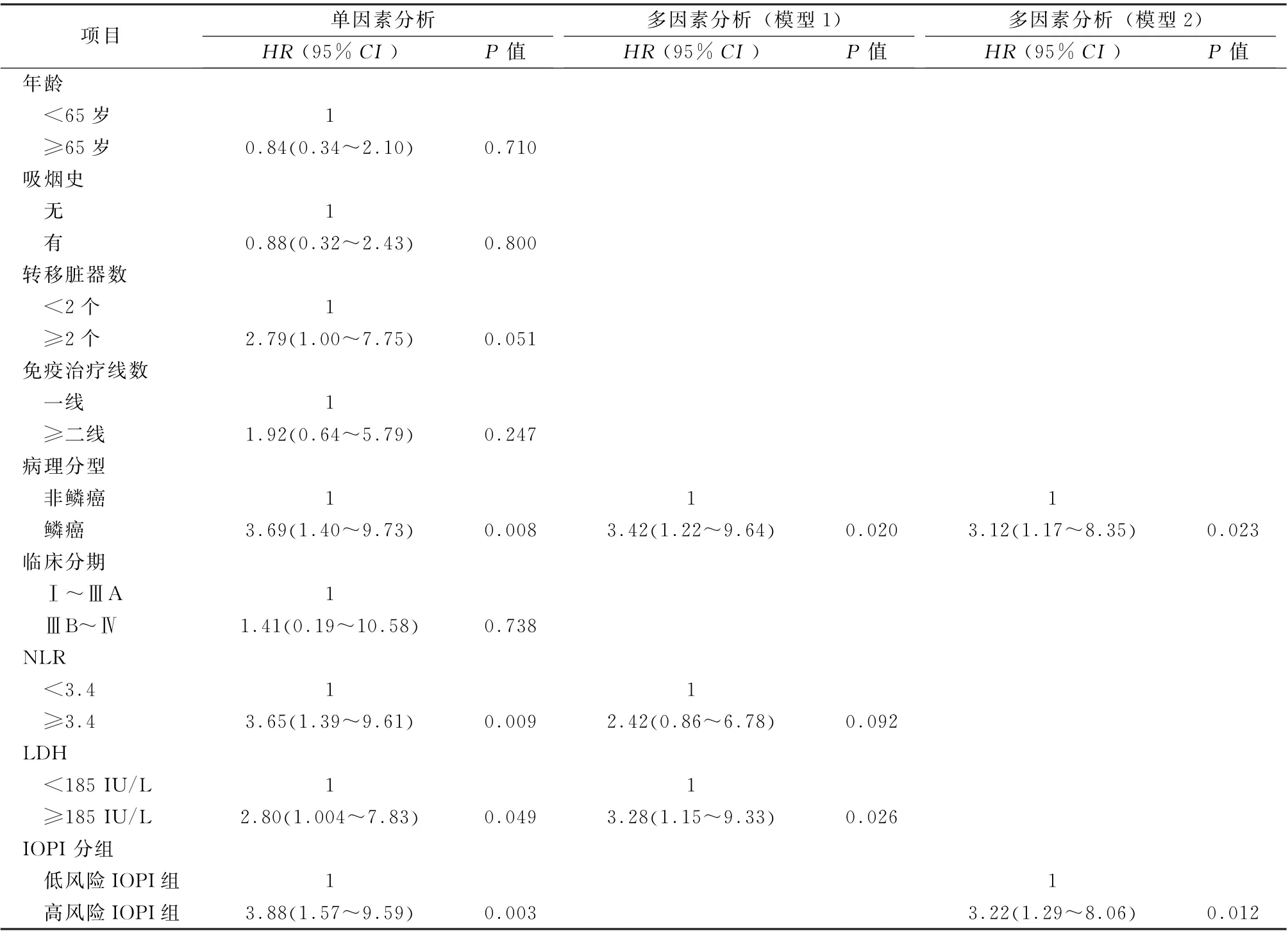
表3 88例免疫治療非小細(xì)胞肺癌患者總生存期的單因素和多因素分析

圖4 LDH、IOPI與無進(jìn)展生存期和總生存期的關(guān)系 A:LDH 與無進(jìn)展生存期的關(guān)系;B:LDH 與總生存期的關(guān)系;C:IOPI與無進(jìn)展生存期的關(guān)系;D:IOPI與總生存期的關(guān)系
由于免疫系統(tǒng)的復(fù)雜性及動態(tài)變化的特性,完美的免疫治療預(yù)測生物標(biāo)志物難以確定,可以通過協(xié)同不同的生物標(biāo)志物來進(jìn)一步提高其預(yù)測能力。因此本研究將單因素分析有統(tǒng)計學(xué)意義的預(yù)后因素LDH≥185 IU/L 及NLR≥3.4合成高風(fēng)險IOPI組,結(jié)果顯示高風(fēng)險IOPI組比低風(fēng)險IOPI組的疾病進(jìn)展和死亡風(fēng)險明顯增加 (P 值均<0.05)。既往研究也有很多類似的聯(lián)合指標(biāo),如使用衍生的中性粒細(xì)胞與淋巴細(xì)胞的比率聯(lián)合LDH 組成肺癌免疫預(yù)后指數(shù)[20-21],或使用NLR、LDH 聯(lián)合C-反應(yīng)蛋白組成Gustave Roussy 免疫評分[19],均與NSCLC免疫治療的預(yù)后明顯相關(guān)。
本研究依然存在一定的局限性。首先,本研究屬于回顧性研究,因此小部分臨床數(shù)據(jù)存在缺失或不完整的問題。其次,部分患者PD-L1 的表達(dá)狀態(tài)未知,而已知狀態(tài)的部分患者檢測方法也未知。因為很多患者免疫治療屬于二線或后線治療,PD-L1的檢測并不是強(qiáng)制性要求的。而且有研究發(fā)現(xiàn)一些患者無論PD-L1表達(dá)水平如何甚至是陰性,都表現(xiàn)出臨床獲益[7]。綜上所述,本研究表明高LDH 和高風(fēng)險IOPI組為NSCLC免疫治療患者不良預(yù)后的獨立危險因素。而組合指標(biāo)IOPI更可能成為NSCLC免疫治療的預(yù)測因子,有助于臨床醫(yī)師篩選出無法從免疫治療獲益的患者,避免不必要的不良反應(yīng)和花費。
利益沖突所有作者均聲明不存在利益沖突

