非注射用中成藥說明書內容質量評價與完善建議
周旭,肖輝,王艷萍,聶鶴云,吳勇奇,陳雙龍,朱衛豐
江西中醫藥大學循證醫學研究中心,江西 南昌 330004
據統計,2014 年中成藥工業總產值達6107 億元,近10 年年增長率均超10%;2016 年藥店銷售的中成藥占所有藥品近半總份額(47.2%)[1-2]。但伴隨規模不斷擴增,中成藥規范化使用和管理問題日益突出。有調查表明,93%中成藥處方由西醫師開出,94.9%的西醫師曾開出中成藥處方,但大部分西醫師不了解中成藥藥性和配伍禁忌、辨證論治,僅憑模糊感覺用藥,導致療效降低、加重患者經濟負擔,甚至引發嚴重的安全問題[3]。造成該困境的主要原因之一是當前缺乏內容完整清晰、證據充足的中成藥說明書指導西醫師臨床用藥。
目前已有研究調查中藥注射劑說明書的內容缺陷問題,發現普遍存在功能主治表述不規范、藥物相互作用不明確和特殊人群用藥方法不清楚等[4-6]。非注射用中成藥說明書的內容質量尚不清楚。因注射和非注射用中成藥在藥理特點、治療對象及應用范圍等方面差異顯著,故不能簡單將注射劑說明書評價結果擴展至非注射劑。本研究隨機抽取846 份非注射用中成藥說明書,評價和總結各類說明書內容缺陷的發生率和可能原因,旨在為促進非注射用中成藥規范化管理提供依據。
1 資料與方法
1.1 數據來源
檢索和收集《中華人民共和國衛生部藥品標準.中藥成方制劑》、《國家基本藥物目錄:2018 年版》[7]和《國家基本醫療保險、工傷保險和生育保險藥品目錄(2017 年版)》[8]收錄的所有上市非注射用中成藥,共計5196 種。
1.2 抽樣方法
本研究樣本量估算公式為n=(U1-α/2/δ)2×P×(1-P),式中α為Ⅰ類錯誤概率,δ為容許誤差,P為主要結局樣本率。取α=0.05,δ=3%,P 參考周偉龍等[9]對本研究主要關注的安全性內容缺項率的調查結果,取值0.192,計算出最小樣本量為663 份。對所有中成藥進行順序編號,采用Excel2016 為每種中成藥產生隨機數字,按隨機數字排序后篩選前1000種中成藥。篩選中主要排除不同生產廠家/商品名的同種中成藥,僅保留首次出現的品種。若篩選結果未達到最小樣本量,則進一步擴大篩選樣本。
1.3 說明書獲取途徑
通過網絡數據庫和實地收集結合的方式獲取說明書原文。檢索關鍵詞包括“說明書”“使用說明”“包裝”。檢索網絡數據庫包括國家食品藥品監督管理總局(http://www.nmpa.gov.cn)、藥智網(http://www.yaozh.com)和各說明書對應的藥企官網,若上述數據未收錄說明書原文,則輔以百度圖片搜索引擎、中國知識資源總庫(CNKI)、中國學術期刊數據庫(萬方數據)、中文科技期刊數據庫(維普網)和中國生物醫學文獻數據庫檢索;若仍無法獲得,則從江西中醫藥大學附屬醫院藥房獲取說明書實物。因說明書質量評價標準基于2006 年國家食品藥品監督管理總局發布的《中藥、天然藥物處方藥說明書格式內容書寫要求及撰寫指導原則》(以下簡稱《指導原則》)[10]和《中成藥非處方藥說明書規范細則》[11],故只納入2006 年后發布的非注射用中成藥說明書。
1.4 評價方法
1.4.1 評價內容
處方藥評價內容包括《指導原則》要求列出的25個項目,其中【核準日期】和【修訂日期】分開評價,非必需項目【警示語】和【特殊藥品、外用藥品標識】未納入評價;對非處方藥,從【注意事項】提取孕婦及哺乳期婦女、兒童和老年3 種特殊人群用藥信息,與處方藥合并評價。對非處方藥的評價不涉及《中成藥非處方藥說明書規范細則》不要求列出的【臨床試驗】【藥理毒理】和【藥代動力學】3 項。
1.4.2 評價指標
①完全缺項:某項目完全無內容。②位置錯誤:因《指導原則》要求處方藥說明書單列【孕婦及哺乳期婦女用藥】【兒童用藥】和【老年用藥】3 項,若未按要求單列,如列入【注意事項】則評為“位置錯誤”。③內容無效:指某項目雖有內容但對指導用藥無實質意義,如【不良反應】和【禁忌】項中僅說明“尚不明確”“請遵醫囑”等;并計算缺項+無效數/率。④內容不全:某項目未提供《指導原則》要求的所有信息,如【成份】中未列全部藥物組成,或缺輔料。
1.5 質量控制
用Microsoft Access 2016 軟件建立說明書內容數據庫和表單,首先預提取和評價20 份說明書,根據提取結果修改完善數據庫設計。然后由2 名評價員(肖輝和王艷萍)進行獨立、重復的說明書數據提取和質量評價。若提取或評價結果有不一致之處,由二者討論解決,若無法達成一致則由項目負責人裁定。
1.6 統計學方法
采用SPSS23.0 統計軟件進行分析。對每個項目各評價指標進行頻數和百分比的描述性統計。統計僅處方藥需提供的項目時,在分母中剔除非處方藥數。由一名評價員(聶鶴云)進行統計分析,另一名評價員(吳勇奇)驗證結果。
2 結果與分析
2.1 抽樣結果
隨機排序并篩選前1000 種藥品,篩除同種藥品后,最終獲得846 種非注射用中成藥。其中處方藥599種、非處方藥247 種。通過網絡數據庫獲得電子圖片版說明書829 份,實地獲取說明書17 份。
2.2 完全缺項率
處方藥說明書項目中,幾乎所有說明書(99.5%)均無【藥代動力學】,其次為【臨床試驗】(93.0%缺項)和【藥理毒理】(69.4%缺項)。處方藥和非處方藥均需列出的項目中,【藥物相互作用】缺項率最高,達67.6%;其次為【老年用藥】【兒童用藥】【孕婦及哺乳期婦女用藥】【核準日期】和【修改日期】,分別為57.0%、51.8%、42.7%、25.5%和16.9%;另有少量說明書無【規格】(0.8%)、【貯藏】(0.5%)和【包裝】(0.2%)項目。其余項目均無缺項。詳見圖1。

圖1 846 種非注射用中成藥說明書內容完全缺項情況
2.3 內容無效
進一步分析說明書內容對指導用藥是否無效,【不良反應】和【禁忌】內容無效率最高,分別為72.1%和56.1%;無效表述主要為“尚不明確”。29.9%說明書【藥物相互作用】除“如與其他藥物同時使用可能會發生藥物相互作用,詳情請咨詢醫師或藥師”外無實質內容。【注意事項】無效率為25.2%,主要表述為“尚不明確”“在醫生指導下服用”和“請遵醫囑”。3 種特殊人群【老年用藥】【兒童用藥】【孕婦及哺乳期婦女用藥】內容無效率分別為25.5%、25.4%和25.1%,主要表述為“遵醫囑”和“尚不明確”。另有0.2%說明書中【藥代動力學】【藥理毒理】內容無效。
合并計算完全缺項和內容無效總數后,缺項+無效率從高到低依次為:【藥代動力學】(99.8%)、【藥物相互作用】(97.5%)、【臨床試驗】(93.0%)、【老年用藥】(82.0%)、【兒童用藥】(77.1%)、【不良反應】(72.1%)、【藥理毒理】(69.8%)、【孕婦及哺乳期婦女用藥】(67.7%)、【禁忌】(56.1%)、【核準日期】(25.5%)、【注意事項】(25.2%)、【修改日期】(16.9%)。詳見表1。
2.4 位置錯誤
599 份處方藥說明書中,分別有339 份(56.6%)、243 份(40.6%)和239 份(39.9%)錯將“孕婦及哺乳期婦女用藥”“兒童用藥”和“老年用藥”內容寫入【注意事項】中。
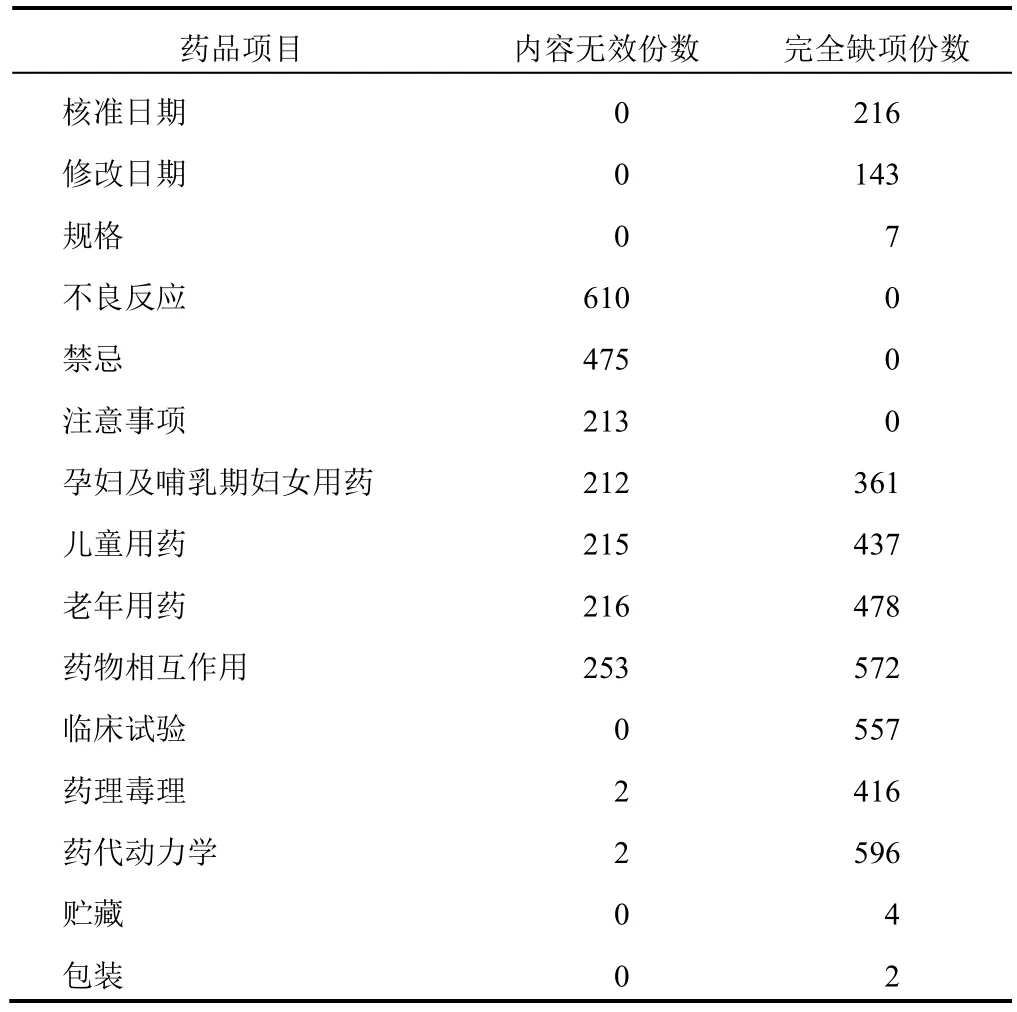
表1 846 種非注射用中成藥說明書內容無效和缺項情況
2.5 內容不全
基本信息類項目的內容不全情況為:①《指導原則》規定【成份】中應列出所有處方組成和輔料(國家一級保密方除外),本研究納入的846 種中成藥有4 種為國家保密方,其余842 種中成藥的說明書中631份(74.9%)缺輔料內容、55 份(6.5%)未列出全部處方組成且缺輔料內容。②《指導原則》規定【性狀】應描述藥品外形、顏色、氣、味,但38.9%說明書缺氣,10.3%缺味,4.3%缺氣和味,0.7%同時缺外形、氣和味。③57.1%說明書【包裝】項目中缺包裝材料內容。④【生產企業】項目中,13.8%說明書缺網址,6.7%缺注冊地址,22.7%同時缺注冊地址和網址。
用藥指導項目的內容不全情況為:①16 份(1.9%)說明書【功能主治】缺少以中醫辨證用藥角度描述的“功能”內容。②《指導原則》規定【用法】需至少包含給藥途徑、方式和時間等基本內容,【用量】需提供劑量和療程內容,納入說明書【用法】中23 份(2.8%)缺給藥方式、14 份(1.7%)缺給藥途徑、223 份(26.4%)同時缺給藥方式和時間、83 份(9.8%)同時缺給藥途徑和時間,【用量】項目中81.3%說明書缺療程內容。
此外,183 份有【藥理毒理】內容的說明書中,170 份(92.9%)缺毒理內容。見表2。
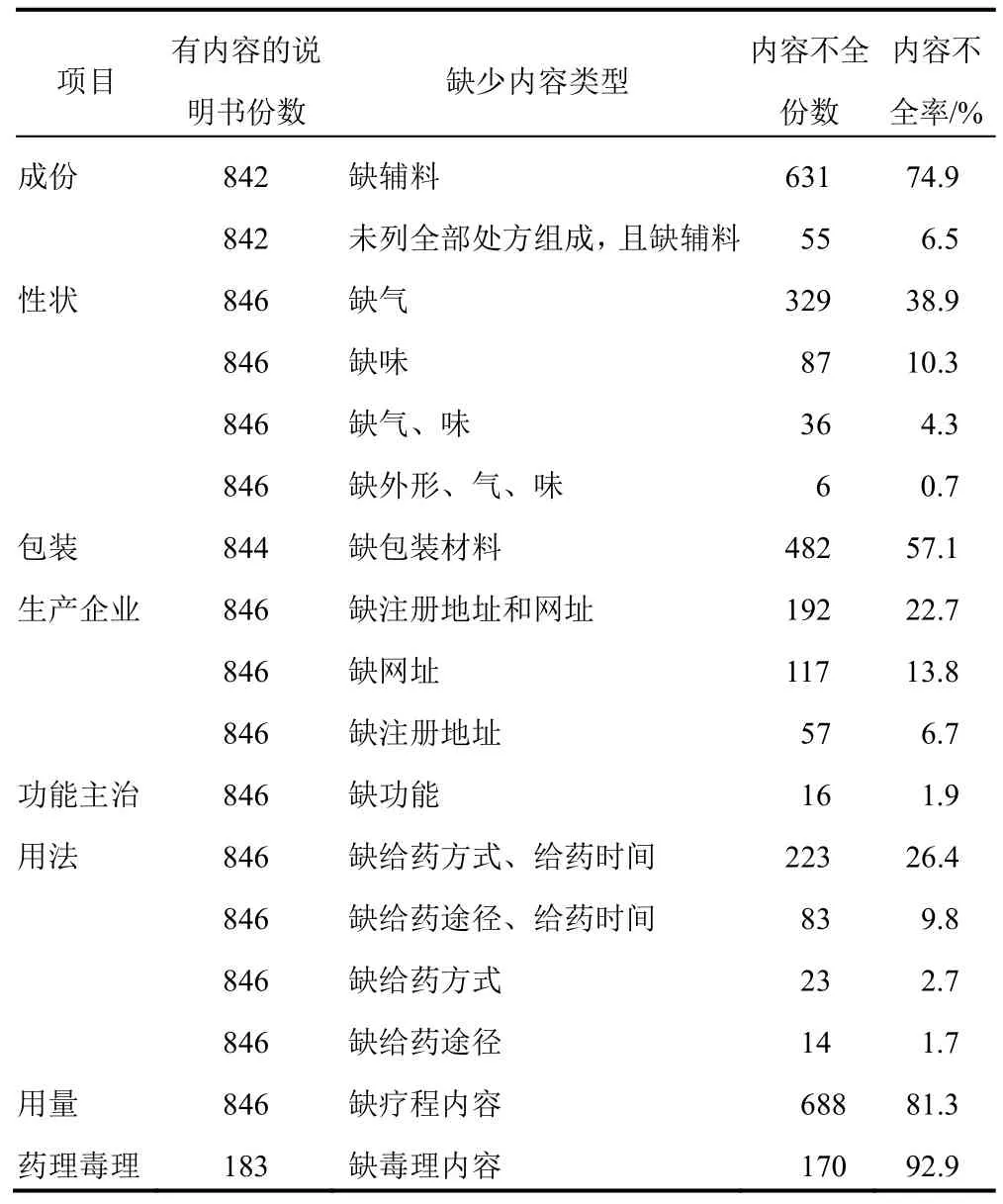
表2 846 種非注射用中成藥說明書內容不全情況
3 討論
3.1 說明書存在問題
本研究顯示,當前非注射用中成藥說明書的不足之處主要有四方面。①缺乏安全性信息:集中表現在【不良反應】【禁忌】和【藥物相互作用】等完全缺項率高或僅填充“尚不明確”“請遵醫囑”和“如與其他藥物同時使用可能會發生藥物相互作用,詳情請咨詢醫師或藥師”等無效信息,對醫師和患者的合理用藥均無實質指導作用[9,12-13]。②處方藥缺乏藥理毒理和臨床研究信息:【藥代動力學】【臨床試驗】和【藥物相互作用】缺項+無效率在90%以上,【藥理毒理】【老年用藥】【兒童用藥】和【孕婦及哺乳期婦女用藥】缺項+無效率均大于60%。③處方藥特殊人群用藥信息位置混亂:《指導原則》明確規定了處方藥說明書需單列【孕婦及哺乳期婦女用藥】【兒童用藥】和【老年用藥】項目,但仍有約半數處方藥說明書將相關內容寫進【注意事項】項目中。④部分項目信息不全:【成份】【性狀】【包裝】【功能主治】【用法】【用量】【藥理毒理】【生產企業】等均有一定比例說明書未提供完整信息。
3.2 說明書存在問題的原因
導致非注射用中成藥說明書內容欠完善的主要原因為當前政策法規尚未嚴格規定說明書編撰和內容來源標準。因歷史原因,早期非注射用中成藥上市無需嚴格開展療效和安全性評價,故《指導原則》允許對【孕婦及哺乳期婦女用藥】【兒童用藥】【老年用藥】【藥物相互作用】【臨床試驗】【藥理毒理】和【藥代動力學】7 項標示“如未進行該項相關研究,可不列此項”及對【不良反應】【禁忌】和【注意事項】3 項標示“尚不明確”。因規定寬松,藥企無需耗費大量資金開展相關臨床研究,導致說明書無可引之證。但這些說明書內容是醫生和患者獲取循證醫學證據的主要來源,缺項可能直接造成對癥不準確、特殊人群用量錯誤和引發不良反應等問題。
對于【不良反應】等安全性項目,即使有第三方證據,藥企也可能因利益沖突或信息滯后而未能及時更新說明書內容。如2014 年張小巧[14]報告了21 例腦心通膠囊相關不良反應,包括11 例胃痛、6 例惡心嘔吐、3 例食欲不振和1 例嗜睡,但該藥2015 年更新的說明書中【不良反應】仍為“尚不明確”;2009 年張碧華等[15]報告17 例西黃丸相關皮疹、瘙癢、過敏等不良反應,但2016 年版的西黃丸說明書中【不良反應】也為“尚不明確”。
3.3 說明書修改完善建議
盡管注射和非注射用處方中成藥說明書制定均以《指導原則》為標準,但與現有注射劑說明書的調查結果比較[16],本研究結果中非注射用中成藥說明書【藥物相互作用】【藥理毒理】【老年用藥】【兒童用藥】【孕婦及哺乳期婦女用藥】等項目完全缺項率高于注射劑說明書。該差異的根本原因是藥監部門更重視中藥注射劑的臨床證據生產和不良事件監測,并出臺了規范中藥注射劑說明書內容的系列政策法規。因此,非注射用中成藥說明書內容的進一步規范也需依靠藥監部門的法規政策建設。基于本研究結果,筆者從法規政策層面提出以下非注射用中成藥說明書的修訂完善建議。
第一,建議藥監部門全面制定非注射用中成藥說明書各項目報告規范,要求藥企提供當前可得最佳證據信息,并定期更新。證據可源自研究文獻和藥監部門監測數據等。對于大多數中成藥,當前藥理毒理和臨床研究水平不足以支撐中成藥說明書的全部內容。因此,若當前尚無相關證據,可由藥監部門責令藥企出資、由權威第三方評價機構開展上市后藥理毒理和臨床研究評價。
第二,因非處方藥發生安全性問題的可能性小,當前法規政策對非處方藥要求相對寬松。但非處方藥使用體量龐大,不良反應真實發生數未必少,故醫生患者仍有從說明書中獲得詳盡藥理機制、療效和安全性信息的需求。因此,建議同處方藥一樣,要求非處方藥將【不良反應】【禁忌】【注意事項】【特殊人群用藥】【臨床試驗】【藥理毒理】等安全性項目內容作為強制修訂完善內容。此外,因絕大部分中成藥成分復雜,無法開展藥代動力學研究,【藥代動力學】項目不符合中成藥特色,可不做要求。
第三,雖然國家食品藥品監督管理總局在2017年連續發布《中成藥規格表述技術指導原則》和《中成藥通用名稱命名技術指導原則》等中成藥說明書內容規范法規文件,但本研究結果顯示,目前非注射用中成藥說明書的多項基本信息仍存在內容不全情況。尤其是部分說明書【成份】未列出所有主料和輔料、【功能主治】缺乏從中醫角度描述藥品功能等問題可能影響正確用藥。《指導原則》對上述項目的編制細節已有詳細規定,故內容不全的原因是藥企未按規定嚴格執行。因此,建議藥監部門加強對說明書細節信息的審核,督促藥企補充完善所有細節信息。
4 結語
現有非注射用中成藥說明書制定標準已落后于中成藥快速發展現狀,進一步完善勢在必行。新標準的制定可借鑒化學藥品經驗,重視對高級別證據的要求,并充分考慮中醫藥診療特點和我國實際醫療和社會環境,實行種類和風險的分類分級管理,逐步推進完善和執行。完善說明書內容將促進提高非注射用中成藥的療效和安全性,助推我國構建中西醫并重、中西藥并用的大健康服務體系。

