糖通飲對2 型糖尿病大鼠糖脂代謝的影響
馬 歡,高楠楠,陳俞如,肖 瑛,2,潘艷伶,3*
(1.貴州醫科大學,貴州 貴陽 550004;2.貴州省常見慢性疾病發病機制及藥物研究重點實驗室,貴州貴陽 550025;3.貴州醫科大學附屬醫院,貴州 貴陽 550004)
伴隨肥胖人數的快速增多,2 型糖尿病 (type 2 diabetes mellitus,T2DM) 的發病率逐漸增加,預計到2040年患者將達到6.42 億[1]。T2DM 是由于胰島素分泌減少和(或) 胰島素敏感性降低所導致的葡萄糖耐量降低和高血糖為特征的一類常見內分泌疾病[2],隨著對T2DM 病理生理研究的不斷深入,大量的藥物已被應用于治療糖尿病和阻止其進展,然而,大部分藥物有一定不良反應,如乳酸性酸中毒、低血糖、水腫等[3],因此,尋找更安全有效地預防和治療藥物是非常必要的。近年來中醫藥治療T2DM以其良好的療效、較低的不良反應而備受關注[4],糖通飲在臨床及前期實驗中已被證實對T2DM 具有較好的治療作用[5-8],但其分子作用機制并未完全清楚。本研究擬觀察糖通飲對T2DM 大鼠糖脂代謝、胰島素水平和氧化應激等生化指標的影響,并從分子水平研究該方對JNK 信號通路的影響,以探尋其分子作用機制,為臨床應用提供實驗依據。
1 材料
1.1 動物 SPF 級SD 雄性大鼠50 只,體質量(180±20)g,由解放軍第三軍醫大學實驗動物中心提供,生產許可證號SCXK (軍) 2012-0011,飼養于貴州醫科大學臨床醫學實驗中心動物房,自由攝水攝食,并保持墊料干燥,定時予以更換。飼養條件:溫度21~26 ℃,相對濕度40%~60%。實驗動物使用許可證號SYXK (黔) 2015-005。
1.2 試劑與藥物 糖通飲(方藥組成為生地黃12 g、山藥15 g、山茱萸15 g、茯苓15 g、澤瀉9 g、丹皮10 g、黃芪15 g、丹參15 g、地骨皮15 g、草決明15 g),由貴州醫科大學附屬醫院中藥房提供。鏈脲佐菌素(STZ,北京索萊寶科技有限公司,批號615K0321);FFA、SOD、MDA 試劑盒(南京建成生物工程研究所,批號分別為20180613、20180608、20180606);逆轉錄試劑盒、熒光定量PCR 試劑盒 (日 本 TaKaRa 公 司,批號分別 為 AI40771A、AI21033A);兔SP 試劑盒(北京中杉金橋生物技術有限公司,批號K185910H)。
2 方法
2.1 造模、分組 50 只SPF 級SD 雄性大鼠適應性飼養1周后,按體質量隨機取出10 只作為正常組,給予基礎飼料喂養,其余大鼠給予高脂飼料(普通飼料58%,精煉豬油20%,糖20%,膽固醇2%,由貴州醫科大學動物房提供)喂養8 周,誘發胰島素抵抗,之后進行1~3 次小劑量(20~30 mg/kg) 腹腔注射1%鏈脲佐菌素(STZ) 制備T2DM 模型;正常組腹腔注射相應劑量的檸檬酸-檸檬酸鈉緩沖液。STZ 注射72 h 后,尾靜脈采血測定餐后血糖,以餐后血糖≥16.7 mmol/L[9],且尿量和飲水量明顯增多者為T2DM 模型制備成功。將40 只造模成功的大鼠按餐后血糖值隨機分為模型組及糖通飲低、中、高劑量組,每組10 只。
2.2 給藥 糖通飲中藥水煎濃縮成1 g/mL 煎劑,按照大鼠與成人等效劑量折算,低劑量組按10 g/kg (相當于成人公斤體質量用藥量的5 倍) 灌胃給藥,中劑量組按20 g/kg(相當于成人千克體質量藥量的10 倍) 灌胃給藥,高劑量組按30 g/kg (相當于成人千克體質量藥量的15 倍) 灌胃給藥,正常組及模型組給予等容量雙蒸水灌胃,以上各組均每天灌胃1 次,連續8 周。實驗過程中,因灌胃、大鼠自身免疫力低下等原因死亡7 只,其中模型組、低劑量組和中劑量組各2 只,高劑量組1 只。
2.3 標本采集 給藥8 周后,大鼠禁食不禁水12 h,尾靜脈采血測量空腹血糖,腹腔注射10%水合氯醛300 mg/kg,大鼠麻醉后快速開腹,腹主動脈采血并迅速摘除胰腺組織,將血液靜置30 min 后3 000 r/min 離心10 min,分離血清,保存于-20 ℃冰箱中,以檢測FINS、TG、TC、FFA、SOD及MDA。將胰腺組織分別置于-80 ℃冰箱和4%多聚甲醛中,以檢測胰腺組織中JNK 信號通路相關因子JNK1、PDX-1 mRNA 及蛋白表達。
2.4 指標檢測
2.4.1 空腹血糖(fasting blood glucose,FBG)、空腹血清胰島素(Fasting serum lisulin,FINS) FBG 水平采用葡萄糖氧化酶法檢測,FINS 水平采用ELISA 法測定,并計算胰島素抵抗指數 (HOMA-IR),公式為HOMA-IR=FBG×FINS/22.5。
2.4.2 血清生化指標 采用全自動生化儀檢測TG、TC 水平,按照試劑盒操作步驟,用分光光度計比色檢測FFA 水平,黃嘌呤氧化酶法測定SOD 活力,硫代巴比妥酸顯色法測定MDA 水平。
2.4.3JNK1、PDX-1 mRNA 表達 采用實時熒光定量PCR法,引物由英濰捷基(上海) 貿易有限公司合成,見表1。2-ΔΔCt計算各組基因相對表達量,并進行統計分析。

表1 引物序列
2.4.4 JNK、PDX-1 蛋白表達 采用免疫組化法。切片常規脫蠟至水,抗原熱修復,滴加JNK1 (1 ∶150)、PDX-1抗體(1 ∶150),4 ℃過夜,滴加二抗,滴加SABC 復合物,DAB 顯色,蘇木素復染,常規脫水,透明,封片,計算平均光密度值。光鏡下觀察JNK1、PDX-1 蛋白陽性表達,以細胞內出現的淡黃色至棕黃色顆粒作為陽性細胞,顏色越深,表示蛋白表達量越高。
2.5 統計學分析 采用SPSS 17.0 軟件進行分析,計量資料以() 表示,組間比較采用單因素方差分析和t檢驗。P<0.05 表示差異具有統計學意義。
3 結果
3.1 糖通飲對T2DM 大鼠空腹血糖的影響 給藥前及給藥8 周后,模型組大鼠空腹血糖與正常組相比均升高(P<0.01)。給藥前,糖通飲各劑量組大鼠空腹血糖與模型組相比無明顯差異(P>0.05);給藥8 周后,糖通飲各劑量組大鼠空腹血糖與模型組相比降低(P<0.01),并具有劑量依賴性,但各劑量組之間比較,差異無統計學意義(P>0.05)。見圖1。
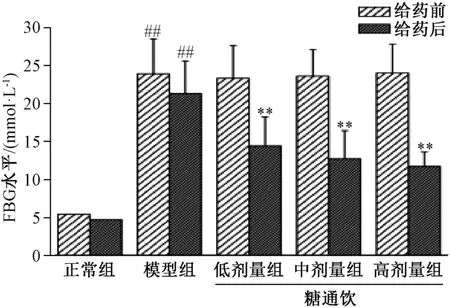
圖1 糖通飲對T2DM 大鼠空腹血糖的影響
3.2 糖通飲對T2DM 大鼠空腹血清胰島素和胰島素抵抗指數的影響 模型組大鼠空腹血清胰島素與正常組相比無明顯差異(P>0.05),糖通飲各劑量組與模型組相比亦然(P>0.05)。模型組大鼠胰島素抵抗指數與正常組相比增加(P<0.01),糖通飲各劑量組大鼠胰島素抵抗指數與模型組相比降低(P<0.01),并具有劑量依賴性,但各劑量組之間比較,差異無統計學意義(P>0.05)。見圖2。

圖2 糖通飲對T2DM 大鼠血清胰島素和胰島素抵抗指數的影響
3.3 糖通飲對T2DM 大鼠脂代謝的影響 與正常組相比,模型組大鼠血清TG、TC、FFA 水平均升高(P<0.01);與模型組相比,糖通飲各劑量組血清TG、TC、FFA 水平降低(P<0.05,P<0.01),并具有劑量依賴性。見圖3。

圖3 糖通飲對T2DM 大鼠脂代謝的影響
3.4 糖通飲對T2DM 大鼠氧化應激的影響 與正常組相比,模型組大鼠血清SOD 水平降低(P<0.01),MDA 水平升高(P<0.01);與模型組相比,糖通飲各劑量組大鼠血清SOD 水平升高(P<0.01),MDA 水平降低(P<0.05,P<0.01),并具有劑量依賴性。見圖4。
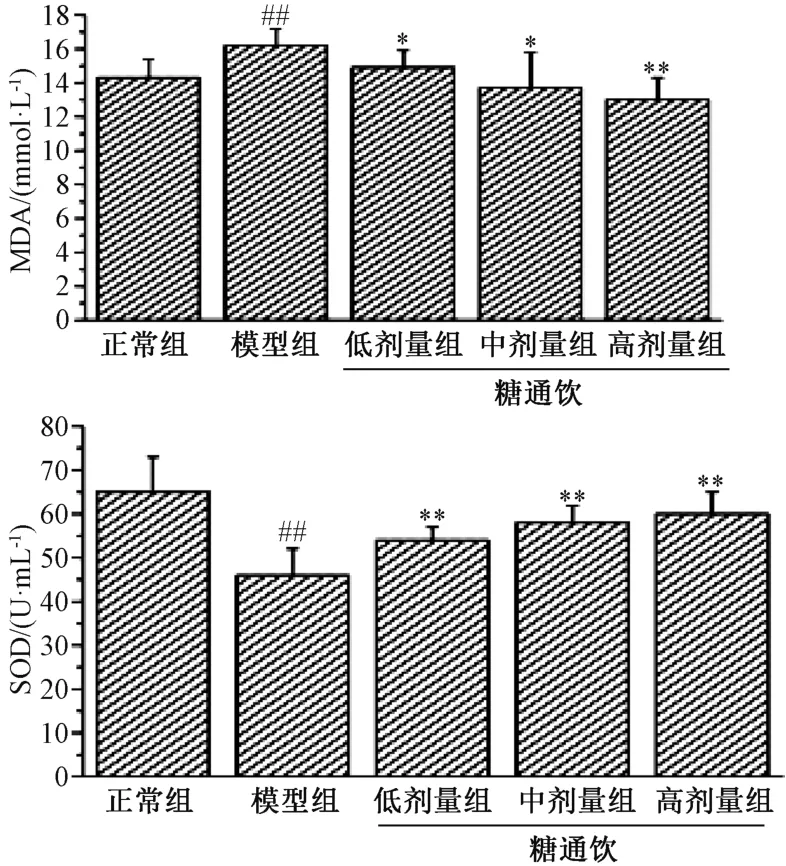
圖4 糖通飲對T2DM 大鼠血清SOD、MDA 水平的影響
3.5 糖通飲對T2DM 大鼠胰腺組織JNK1、PDX-1 mRNA表達的影響 與正常組相比,模型組大鼠胰腺組織JNK1 mRNA 表達升高(P<0.01),PDX-1 mRNA 表達降低(P<0.01);與模型組相比,糖通飲各劑量組大鼠胰腺JNK1 mRNA 表達降低(P<0.05),PDX-1 mRNA 表達升高(P<0.05,P<0.01),并具有劑量依賴性。見圖5。
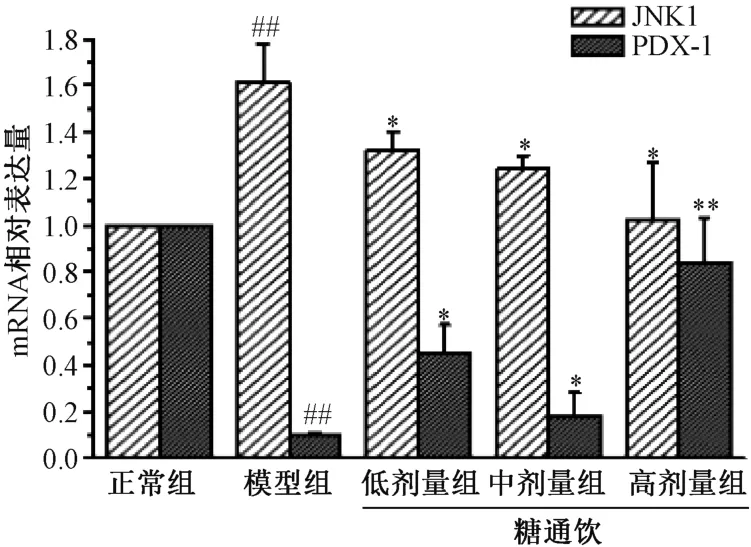
圖5 糖通飲對T2DM 大鼠胰腺組織JNK、 PDX-1 mRNA表達的影響
3.6 糖通飲對T2DM 大鼠胰腺組織JNK1、PDX-1 蛋白的影響 JNK1 主要定位于胰島的細胞漿,模型組胰島部染色較深,正常組和糖通飲各劑量組染色較淺;PDX-1 主要定位于胰島的細胞核,模型組胰島組織陽性細胞數較少,正常組和糖通飲各劑量組陽性細胞數較多。與正常組相比,模型組大鼠胰腺組織JNK1 蛋白陽性細胞表達升高(P<0.01);與模型組相比,糖通飲各劑量組陽性細胞表達降低(P<0.01),并呈劑量依賴性;與正常組相比,模型組PDX-1 蛋白陽性細胞數降低(P<0.01);與模型組相比,糖通飲各劑量組PDX-1 蛋白陽性細胞數增加(P<0.01),并呈劑量依賴性。見圖6。
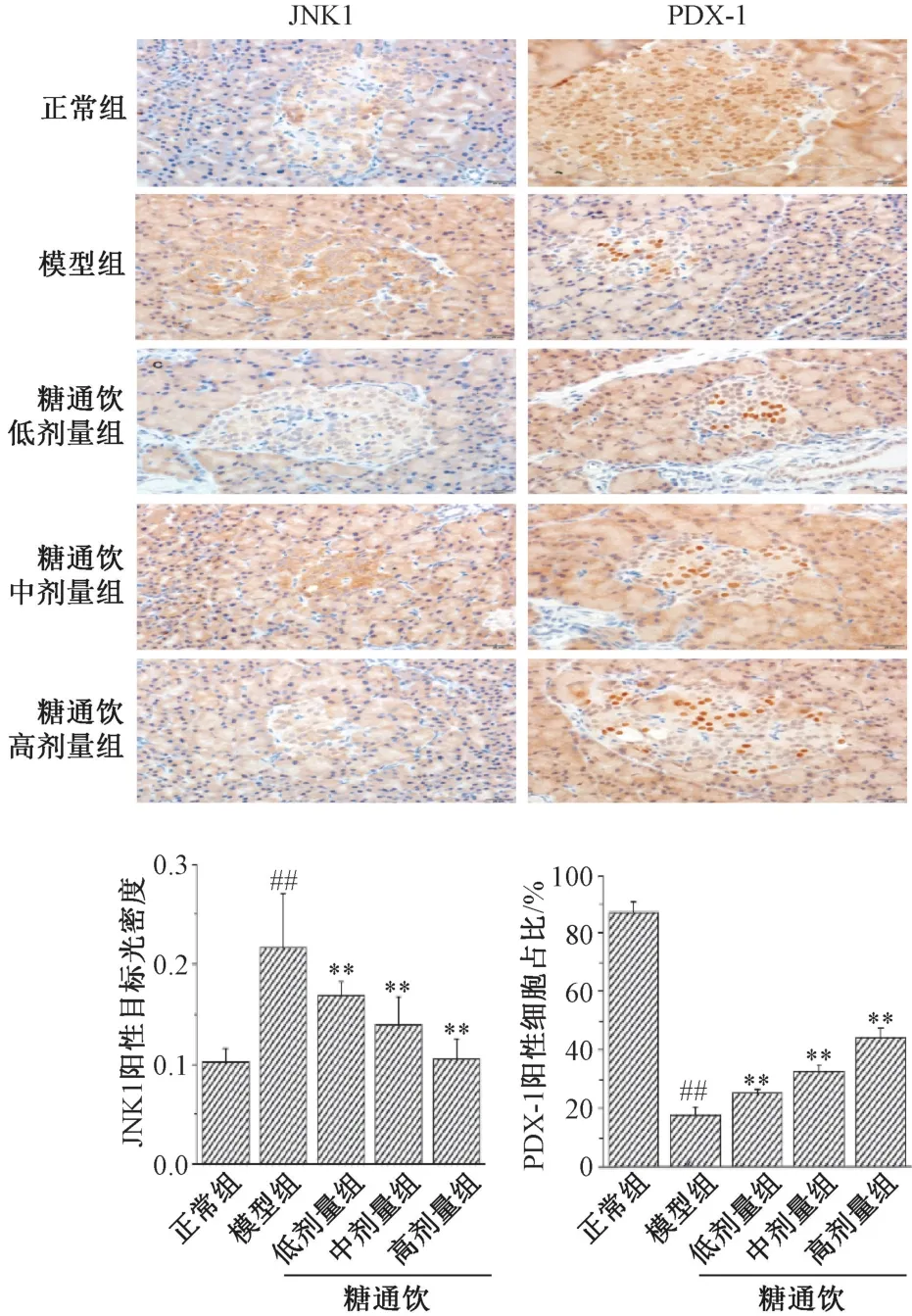
圖6 糖通飲對T2DM 大鼠胰腺組織JNK1 和PDX-1蛋白表達的影響(×400)
4 討論
全國名老中醫凌湘力教授針對T2DM 氣陰兩虛為本、瘀血阻絡為標的基本病機特點創制了經驗方“糖通飲”,該方在六味地黃丸的基礎上改熟地黃為生地黃,并配伍黃芪、丹參、地骨皮、草決明而成,具有益氣養陰、活血化瘀之功[9-12]。據現代藥理學研究證實,黃芪中的苷類、黃酮類成分和多糖類成分有很好的降糖和增強胰島素敏感性的作用[9,11];丹參可減少氧化應激損傷、降脂降壓;地骨皮、草決明可促進胰島β 細胞分泌胰島素,具有降糖降脂的作用。此方在臨床治療T2DM 的運用中也取得頗為滿意的效果[12]。在本實驗中再次證明中藥方劑糖通飲可劑量依賴性地降低T2DM 大鼠的血糖。
糖、脂代謝紊亂是T2DM 發生和發展的重要標志,而胰島素抵抗是引起糖、脂代謝紊亂的關鍵環節,持續高血脂水平所產生的脂毒性可導致高活性反應分子性氧簇和活性氮簇生成增多,因此啟動氧化應激機制,損傷胰島β 細胞,加重胰島素抵抗,繼而影響糖代謝[13]。FFA 增多可促進胰島素受體底物1 的絲氨酸發生磷酸化,進而抑制胰島素信號通路的活化,從而導致胰島素抵抗[14]。TG 和TC 的升高,可引起胰島β 細胞內脂類過量堆積,使胰島β 細胞功能受損,進而加劇胰島素抵抗程度[15]。本實驗結果顯示,T2DM 模型組大鼠血清FFA、TG 和TC 水平均明顯升高,證明存在脂質代謝紊亂,應用糖通飲后,可劑量依賴性地降低2 型糖尿病大鼠血清FFA、TG 和TC 水平,改善大鼠的高脂狀態。
氧化應激可以促進胰島素抵抗的發生和進一步加劇脂代謝紊亂。氧化應激與脂代謝之間存在密切聯系,脂代謝水平升高會增加耗氧量,進而產生大量的ROS,過量的ROS 又會導致脂肪、蛋白質等大分子變性,從而造成胰腺組織受損,反過來影響脂代謝,發生脂代謝紊亂[16]。SOD為體內抗氧化防御系統的重要組成部分,而MDA 水平的高低直接反映了機體氧化應激水平的嚴重程度。氧化應激反應引起體內SOD 活性降低,導致機體氧自由基大量產生,對本身缺乏抗氧化酶的胰島β 細胞更易造成氧損傷,引起胰島β 細胞功能受損,胰島素分泌減少[17]。本研究發現,T2DM 模型組大鼠血清SOD 水平明顯,血清MDA 明顯升高,說明糖尿病時機體氧化應激反應增強。糖通飲可劑量依賴性地升高T2DM 大鼠血清SOD,降低血清MDA,提示糖通飲具有抗氧化作用,這可能是其改善T2DM 大鼠胰島素抵抗及糖、脂代謝紊亂的作用機制。
胰島素抵抗是指在胰島素靶組織(骨骼肌組織、脂肪組織、肝組織等) 中胰島素促進葡萄糖攝取和利用的能力下降,進一步引起糖代謝紊亂[18]。在T2DM 患者中,胰島素抵抗的發生率超過80%,是T2DM 早期的主要特征,因此,改善胰島素抵抗是治療T2DM 的有效途徑。HOMA-IR是研究和評價胰島素抵抗的重要指標[19]。本實驗結果顯示,模型組大鼠HOMA-IR 值與正常組大鼠相比明顯升高,而其血清胰島素濃度與正常組大鼠無明顯差異,表明模型組大鼠存在胰島素抵抗,胰島素抵抗的原因是由于胰島素與其受體的親和力降低,而非胰島素的數量減少所致。糖通飲可明顯降低T2DM 大鼠HOMA-IR 值,對血清胰島素無明顯影響,提示糖通飲可能通過增加胰島素與受體的親和力,從而改善胰島素抵抗。此外,糖通飲無明顯促進胰島素分泌的作用,對胰島組織具有一定保護作用。
c-Jun 氨基末端激酶 (c-Jun N-terminal kinase,JNK)由一組絲氨酸/蘇氨酸激酶組成,屬于絲裂原活化蛋白激酶家族中重要的一員,對氧化應激較為敏感,激活JNK 信號通路是氧化應激引起胰島β 細胞損傷的主要機制[20]。激活胰島β 細胞中JNK 可抑制胰腺十二指腸同源盒(PDX-1)轉錄因子和胰島素靶基因的轉錄,減少血糖升高時胰島素的分泌,產生胰島素抵抗[21]。本實驗結果顯示T2DM 模型組大鼠胰腺組織JNK的mRNA 和蛋白表達明顯增加,PDX-1 的mRNA 和蛋白表達明顯降低,糖通飲干預后JNK1 的mRNA 和蛋白表達量顯著下降,PDX-1 的mRNA 和蛋白的表達量顯著升高,表明糖通飲可抑制JNK 信號通路的過度激活,從而降低氧化應激水平和改善胰島素抵抗,進而改善T2DM 大鼠糖脂代謝。本實驗結果還顯示糖通飲對上述各項指標的影響具有劑量依賴性,大劑量組的治療效果優于中、低劑量組,此結果為優化糖通飲的臨床用藥劑量提供了實驗依據。