基于AMPK/PPARα/STAT3途徑探討姜黃素對血管壁巨噬細胞形成的影響
陳旭 溫賢銘 劉子由
【摘要】 目的:基于腺苷酸活化蛋白激酶(AMPK)/過氧化物酶體增殖物激活受體α(PPARα)/信號轉導子和轉錄激活因子3(STAT3)途徑探討姜黃素對血管壁巨噬細胞形成的影響。方法:本研究時間為2020年6-7月,將人單核細胞株THP-1細胞分為空白對照組、脂多糖(LPS)組、LPS+辛伐他汀組、LPS+姜黃素組,每組20個。將80只小鼠隨機分為空白對照組、模型組、辛伐他汀組和姜黃素組,每組20只。比較各組人單核細胞株THP-1細胞遷移的數目、HMGB1和MCP-1蛋白表達水平、AMPK/PPARα/STAT3 mRNA相對表達量,比較各組小鼠血管壁巨噬細胞含量。結果:LPS組細胞的遷移能力、HMGB1和MCP-1蛋白表達水平均較空白對照組顯著升高,LPS+辛伐他汀組和LPS+姜黃素組均較LPS組下降,且LPS+姜黃素組明顯低于LPS+辛伐他汀組,差異均有統計學意義(P<0.05)。四組細胞遷移能力、HMGB1和MCP-1蛋白表達水平比較,差異均有統計學意義(P<0.05)。LPS組細胞AMPK和PPARα mRNA、蛋白相對表達量均較空白對照組顯著降低,而STAT3 mRNA、蛋白相對表達量升高,LPS+辛伐他汀組和LPS+姜黃素組細胞AMPK和PPARα mRNA、蛋白相對表達量均較LPS組升高,STAT3 mRNA、蛋白相對表達量均降低,且LPS+姜黃素組細胞AMPK和PPARα mRNA、蛋白相對表達量均較LPS+辛伐他汀組升高,STAT3 mRNA、蛋白相對表達量均降低,差異均有統計學意義(P<0.05)。體外實驗中四組細胞AMPK/PPARα/STAT3 mRNA、蛋白相對表達量比較,差異均有統計學意義(P<0.05)。模型組血管壁巨噬細胞含量明顯高于空白對照組,辛伐他汀組和姜黃素組均明顯低于模型組,姜黃素組顯著低于辛伐他汀組,差異均有統計學意義(P<0.05)。四組血管壁巨噬細胞含量比較,差異有統計學意義(P<0.05)。結論:姜黃素能夠顯著抑制LPS誘導的THP-1細胞遷移及血管壁巨噬細胞的形成過程,可能通過調節AMPK/PPARα/STAT3途徑發揮作用,效果優于辛伐他汀。
【關鍵詞】 腺苷酸活化蛋白激酶 過氧化物酶體增殖物激活受體α 信號轉導子和轉錄激活因子3
姜黃素 巨噬細胞
Effect of Curcumin on Formation of Vascular Wall Macrophages by AMPK/PPARα/STAT3 Pathway/CHEN Xu, WEN Xianming, LIU Ziyou. //Medical Innovation of China, 2021, 18(24): 0-028
[Abstract] Objective: To investigate the effect of Curcumin on the formation of vascular wall macrophages by adenylate activated protein kinase (AMPK)/peroxisome proliferator activated receptor α (PPARα)/signal transductor and transcriptional activator 3 (STAT3) pathways. Method: The research period was from June to July 2020, human mononuclear cell line THP-1 cells were divided into blank control group, lipopolysaccharide (LPS) group, LPS+Simvastatin group and LPS+Curcumin group, 20 cases in each group. Eighty mice were randomly divided into blank control group, model group, Simvastatin group and Curcumin group, 20 mice in each group. The number of human mononuclear cell line THP-1 cell migration, the protein expression levels of HMGB1 and MCP-1,
and the relative mRNA expression levels of AMPK/PPARα/STAT3 were compared among four groups, the content of macrophages in the blood vessel wall of four group were compared. Result: The migration ability, HMGB1 and MCP-1 protein expression levels of cells in LPS group were significantly increased compared with blank control group, while those in LPS+Simvastatin group and LPS+Curcumin group were decreased compared with LPS group, and LPS+Curcumin group was significantly lower than that in LPS+Simvastatin group, the differences were statistically significant (P<0.05). Comparison of cell migration ability, HMGB1 and MCP-1 protein expression levels among four groups, the differences were statistically significant (P<0.05). The mRNA and protein relative expression levels of AMPK and PPARα in LPS group were significantly decreased compared with blank control group, while the mRNA and protein relative expression levels of STAT3 were increased, the mRNA and protein relative expression levels of AMPK and PPARα in LPS+Simvastatin and LPS+Curcumin groups were increased compared with LPS group, the mRNA and protein relative expression levels of STAT3 were decreased, and the mRNA and protein relative expression levels of AMPK and PPARα in LPS+Curcumin group were increased compared with LPS+Simvastatin group, while the mRNA and protein relative expression levels of STAT3 were decreased, the differences were statistically significant (P<0.05). Comparison of AMPK/PPARα/STAT3 mRNA and protein relative expression levels among four groups in vitro, the differences were statistically significant (P<0.05). The content of macrophages in the vascular wall in model group was significantly higher than that in blank control group, and Simvastatin group and Curcumin group were significantly lower than that in model group, and Curcumin group was significantly lower than that in Simvastatin group, the differences were statistically significant (P<0.05). Comparison of the content of macrophages in the blood vessel wall among four groups, the difference was statistically significant (P<0.05). Conclusion: Curcumin can significantly inhibit LPS induced THP-1 Cell Migration and the formation of vascular wall macrophages, possibly by regulating AMPK/PPARα/STAT3 pathway plays a role, and the effect is better than simvastatin.
[Key words] Adenylate activated protein kinase Peroxisome proliferator activated receptor α Signal transducer and activator of transcription 3 Curcumin Macrophage
First-author’s address: The First Affiliated Hospital of Gannan Medical College, Ganzhou 341000, China
doi:10.3969/j.issn.1674-4985.2021.24.006
動脈粥樣硬化是由內皮細胞損傷暴露、誘導循環血漿中單核細胞系變形,與暴露的內皮細胞中特定分子錨定并移入血管壁,促進巨噬細胞衍生泡沫細胞形成,即為粥樣斑塊的早期[1-3]。姜黃素是從中藥姜黃的根莖中提取得到的多酚類化合物,給予姜黃素能夠顯著降低ApoE-/-小鼠動脈粥樣硬化病變中巨噬細胞的數量,也能降低兔主動脈內皮細胞中粘附分子的表達,提示姜黃素能夠從多個靶點干預動脈粥樣硬化的形成和發展[4-6]。本實驗進一步從腺苷酸活化蛋白激酶(AMPK)/過氧化物酶體增殖物激活受體α(PPARα)/信號轉導子和轉錄激活因子3(STAT3)信號通路探討姜黃素對血管壁巨噬細胞形成的影響機制。現報道如下。
1 材料與方法
1.1 材料 本研究時間為2020年6-7月,人單核細胞株THP-1細胞,由上海生物科學研究所細胞資源中心提供;ApoE-/-小鼠80只,雌性小鼠40只,雄性小鼠40只,將其分為4組,每組10只雌性小鼠和10只雄性小鼠,平均重量(25.56±5.34) g,該小鼠由上海SLAC實驗室提供,姜黃素(西安天豐生物科技有限公司),生產批號:118-39-5,純度≥98%。
1.2 方法
1.2.1 實驗步驟
1.2.1.1 體外細胞實驗 將人單核細胞株THP-1細胞分為空白對照組(n=20個)、脂多糖(LPS)組(5 μg/mL,n=20個)、LPS+辛伐他汀組(LPS 5μg/mL+辛伐他汀5 μmol/L,n=20個)、LPS+姜黃素組(姜黃素80 μmol/L預處理THP-1細胞2 h,然后5 μg/mL LPS刺激THP-1細胞0.5 h,n=20個)。每組各需要20個人單核細胞株THP-1細胞,將20個單核細胞株THP-1細胞放入Transwell小室中,每個Transwell小室中放入一個單核細胞株THP-1細胞。采用Transwell遷移實驗檢測THP-1細胞的遷移能力,ELISA法檢測細胞培養液腺苷酸活化蛋白激酶(HMGB1)和單核細胞趨化蛋白-1(MCP-1)的表達水平,RT-PCR和Western blot法分別檢測AMPK、PPARα和STAT3 mRNA和蛋白的表達量。細胞培養:采用含10%胎牛血清+100 U/mL青霉素+100 U/mL鏈霉素的RPIM-1640培養基培養THP-1細胞,置于37 ℃,5% CO2培養箱中,隔天換液。細胞接種密度為2×105/mL,用肉豆蔻酸佛波酯刺激24 h。
1.2.1.2 體內動物實驗 體內實驗采用載脂蛋白E(ApoE)小鼠隨機分為空白對照組(n=20)、模型組(n=20)、辛伐他汀組(0.2 mg/kg,n=20)和姜黃素組(80 mg/kg,n=20),除空白對照組外,其余各組皮下注射血管緊張素Ⅱ(AngⅡ)1.44 mg/(kg·d),連續6周,空白對照組給予等量生理鹽水皮下注射。實驗結束后處死小鼠,制作主動脈切片。采用CD68免疫組織化學染色法計算小鼠血管壁巨噬細胞的含量。
1.2.2 檢測方法
1.2.2.1 Transwell遷移試驗 將巨噬細胞鍍在24孔Transwell小室的下腔內,各處理組的THP-1細胞懸液加入上腔。在×1 000視野下觀察遷移到下腔的THP-1細胞數目。
1.2.2.2 RT-PCR法 使用TRIzol試劑提取細胞總RNA,逆轉錄試劑盒進行互補DNA合成,設置反應體系和反應條件,圖像分析儀掃描凝膠密度,分析得到mRNA的相對含量。
1.2.2.3 Western blot法 使用放射免疫沉淀試劑LS提取總蛋白質,用10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離約30 μg蛋白裂解液,轉移到聚偏二氟乙烯膜上,用抗PPARα、AMPK、STAT3抗體(1︰1 000稀釋度)和GAPDH(1︰2 000稀釋度),然后分別與次級抗體孵育。放射自顯影技術進行增強化學發光培養。
1.2.2.4 CD68免疫組織化學染色法 10%水合氯醛麻醉小鼠,收集主動脈制作成5 μm厚切片,CD68免疫組織化學染色,顯微鏡下觀察血管壁巨噬細胞數目。
1.3 觀察指標 比較各組人單核細胞株THP-1細胞遷移的數目;比較各組體外細胞實驗HMGB1和MCP-1蛋白表達水平;比較各組體外實驗
AMPK/PPARα/STAT3 mRNA相對表達量;比較各組小鼠血管壁巨噬細胞含量。
1.4 統計學處理 采用SPSS 21.0軟件對所得數據進行統計分析,計量資料用(x±s)表示,兩兩比較采用t檢驗,多組比較采用方差分析;計數資料以率(%)表示,比較采用字2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 體外實驗中四組細胞遷移能力比較 空白對照組、LPS組、LPS+辛伐他汀組、LPS+姜黃素組細胞數目分別為(3.5±1.1)、(15.6±3.4)、(10.2±3.1)、(7.3±2.4)個。LPS組細胞的遷移能力較空白對照組顯著升高,LPS+辛伐他汀組和LPS+姜黃素組較LPS組下降,且LPS+姜黃素組明顯低于LPS+辛伐他汀組,差異均有統計學意義(P<0.05)。四組細胞遷移能力比較,差異有統計學意義(F=73.889,P=0.000)。
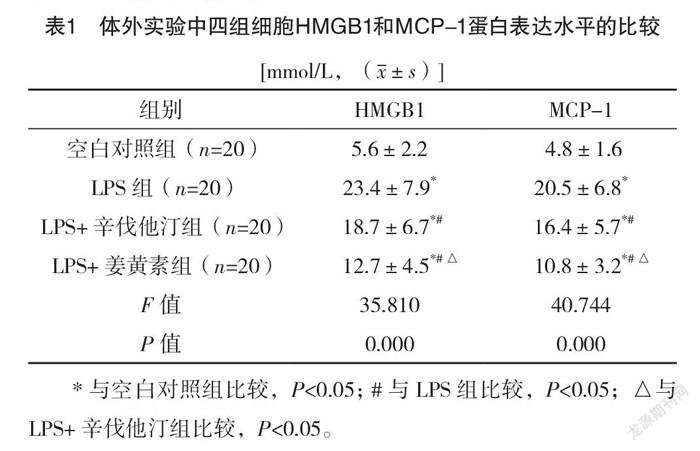
2.2 體外實驗中四組細胞HMGB1和MCP-1蛋白表達水平比較 LPS組細胞HMGB1和MCP-1蛋白表達水平均較空白對照組顯著升高,LPS+辛伐他汀組和LPS+姜黃素組均較LPS組下降,且LPS+姜黃素組明顯低于LPS+辛伐他汀組,差異均有統計學意義(P<0.05)。體外實驗中四組細胞HMGB1和MCP-1蛋白表達水平的比較,差異均有統計學意義(P<0.05)。見表1。
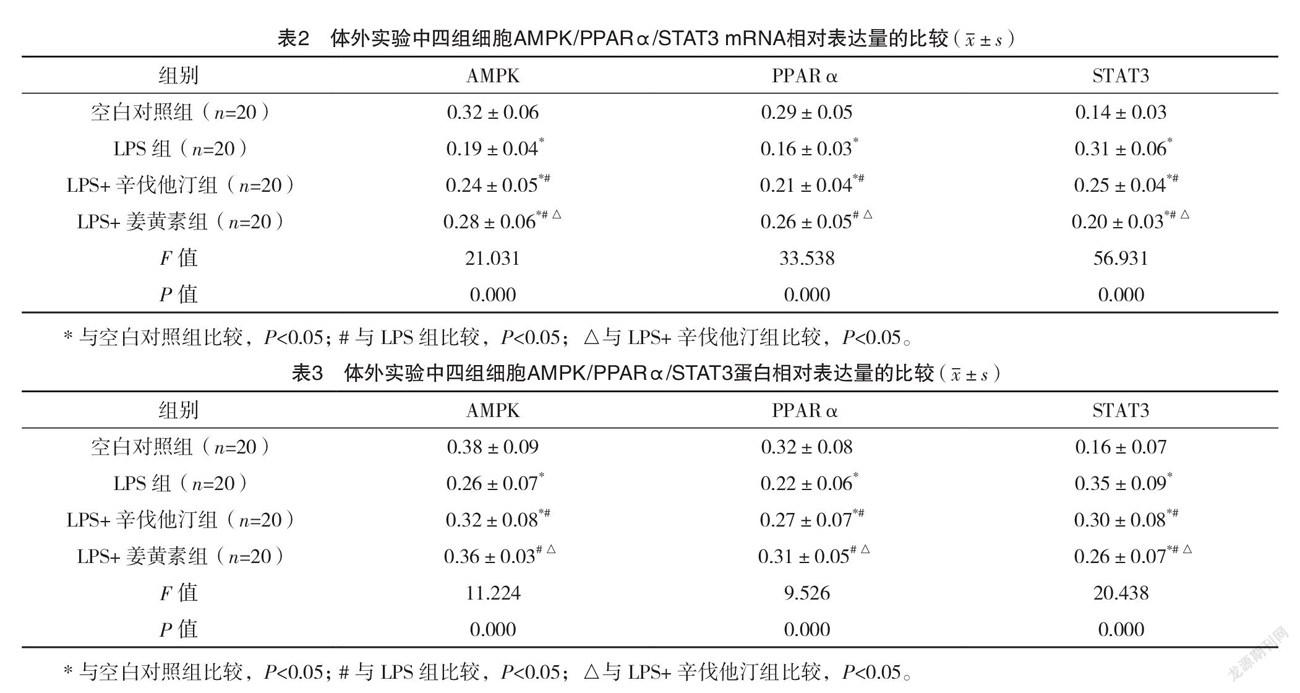
2.3 體外實驗中四組細胞AMPK/PPARα/STAT3 mRNA相對表達量比較 LPS組細胞AMPK和PPARα mRNA相對表達量均較空白對照組顯著降低,而STAT3 mRNA相對表達量升高,LPS+辛伐他汀組和LPS+姜黃素組細胞AMPK和PPARα mRNA相對表達量均較LPS組升高,STAT3 mRNA相對表達量均降低,且LPS+姜黃素組細胞AMPK和PPARα mRNA相對表達量均較LPS+辛伐他汀組升高,STAT3 mRNA相對表達量均降低,差異均有統計學意義(P<0.05)。體外實驗中四組細胞AMPK/PPARα/STAT3 mRNA相對表達量的比較,差異均有統計學意義(P<0.05)。見表2。
2.4 體外實驗中四組細胞AMPK/PPARα/STAT3蛋白相對表達量的比較 LPS組細胞AMPK和PPARα蛋白相對表達量均較空白對照組顯著降低,而STAT3蛋白相對表達量升高,LPS+辛伐他汀組和LPS+姜黃素組細胞AMPK和PPARα蛋白相對表達量均較LPS組升高,STAT3蛋白相對表達量均降低,且LPS+姜黃素組細胞AMPK和PPARα蛋白相對表達量均較LPS+辛伐他汀組升高,STAT3蛋白相對表達量降低,差異均有統計學意義(P<0.05)。體外實驗中四組細胞AMPK/PPARα/STAT3蛋白相對表達量的比較,差異均有統計學意義(P<0.05)。見表3。
2.5 體內動物實驗中四組血管壁巨噬細胞含量的比較 體內動物實驗顯示,空白對照組、模型組、辛伐他汀組、姜黃素組的細胞數目分別為(3.4±1.1)、(15.6±3.4)、(10.2±3.2)、(7.6±2.5)個。模型組血管壁巨噬細胞含量明顯高于空白對照組,辛伐他汀組和姜黃素組均明顯低于模型組,姜黃素組顯著低于辛伐他汀組,差異均有統計學意義(P<0.05)。四組血管壁巨噬細胞含量比較,差異有統計學意義(F=30.236,P=0.000)。
3 討論
姜黃素通常被用于膳食香料和食品著色劑等方面[7-8],當機體每日攝入姜黃素450~8 000 mg,持續1~4個月,可顯著降低收縮壓、血清甘油三酯和低密度脂蛋白水平,降低心血管病發生風險,明顯改善內皮功能[9-11]。
本研究結果提示動脈硬化的單核細胞具有較強的遷移能力,是粥樣硬化斑塊形成的主要因素。辛伐他汀具有抑制單核細胞遷移的能力,并且姜黃素的抑制效應更強于辛伐他汀[12-14]。HMGB1和MCP-1蛋白均是單核細胞激活后釋放的主要活性分子,表示單核細胞吞噬病原體和異物的能力,也是單核細胞向巨噬細胞和平滑肌下泡沫樣細胞轉化的主要活性因子[15-17]。AMPK/PPARα/STAT3途徑參與了動脈粥樣硬化的形成過程,同時姜黃素能夠通過抑制AMPK/PPARα/STAT3途徑進而影響動脈粥樣硬化的形成[18-20]。體內實驗發現,模型組血管壁巨噬細胞含量明顯高于空白對照組,辛伐他汀組和姜黃素組明顯低于模型組,且姜黃素組顯著低于辛伐他汀組。姜黃素具有減少動脈粥樣硬化不同動物模型中動脈瘤變的發展作用。
綜上所述,姜黃素能夠顯著抑制LPS誘導的THP-1細胞遷移及血管壁巨噬細胞的形成過程,可能通過調節AMPK/PPARα/STAT3途徑發揮作用,效果優于辛伐他汀。
參考文獻
[1]朱靜和,錢雷,蔣鳳,等.白細胞介素37對動脈粥樣硬化患者單核巨噬細胞脂蛋白相關磷脂酶A2的抑制作用[J].中華老年心腦血管病雜志,2020,22(8):873-875.
[2]仲崇琦,孫文慧,楊俊強,等.姜黃素類似物H8對糖尿病大鼠心臟的保護作用[J].天津醫藥,2020,48(7):630-634.
[3]譚位華,桂培根,陸煜,等.姜黃素通過FGF21促進泡沫細胞膽固醇流出[J].中華中醫藥學刊,2020,38(11):237-240.
[4]宋莉平,王宇.姜黃素抗泌尿系統腫瘤的研究進展[J].遼寧中醫雜志,2021,48(2):214-217.
[5]劉國濤,王軍.中藥姜黃在創面治療中的研究進展[J].遼寧中醫藥大學學報,2020,22(9):118-122.
[6]陳冬萍,肖建民,董志會,等.左旋聚乳酸對單核細胞來源巨噬細胞M1/M2極化的影響及姜黃素的干預作用[J].廣東醫學,2020,41(11):1139-1144.
[7]丁秀娟,劉百奇,王靈君,等.姜黃素對冠狀動脈粥樣硬化危險因素的影響[J].中國醫藥指南,2020,18(17):39-40.
[8]鄧禮明,熊國祚.姜黃素煙酸酯對輻射誘導的巨噬細胞IL-1β、IL-18表達的影響[J].中國現代醫學雜志,2020,30(11):7-10.
[9]劉國安,許欣欣,李貴琛,等.姜黃素在生化和細胞體系的抗氧化與促氧化作用[J].西北師范大學學報(自然科學版),2020,56(3):82-89.
[10]郭福佳,周香,袁正強.單核細胞趨化蛋白-1與早發冠心病及其傳統危險因素關系的研究進展[J].嶺南心血管病雜志,2020,26(3):352-355.
[11]范愛月,吳相君,邵愛民,等.姜黃素對動脈粥樣硬化家兔血脂、炎性因子及內皮功能的影響[J].中國中醫藥科技,2020,27(3):373-375.
[12]董佳梓,魏云濤,許環宇,等.電針“足三里”對慢性疲勞綜合征大鼠骨骼肌腺苷酸活化蛋白激酶/過氧化物酶體增殖物活化受體γ共激活因子α信號通路基因表達的影響[J].針刺研究,2018,43(6):335-340.
[13]楊曦,劉玉潔,邢邯英,等.絲裂原活化蛋白激酶信號通路對軟脂酸培養的肌細胞過氧化物酶體增殖物激活受體γ輔激活子表達的調控作用[J].中國糖尿病雜志,2017,25(11):1016-1020.
[14]李知行,張海華,藍丹純,等.電針對高脂誘導胰島素抵抗大鼠肝臟腺苷酸活化蛋白激酶信號轉導通路相關蛋白表達的影響[J].針刺研究,2019,44(1):12-16,60.
[15]田翰林,常柏,田文靜.血糖波動對人臍靜脈血管內皮細胞腺苷酸活化蛋白激酶和過氧化物酶增殖物激活受體γ共激活因子1α的影響[J].安徽醫藥,2019,23(2):250-253.
[16]張倩,梁曉春.線粒體功能異常與腺苷酸活化蛋白激酶/過氧化物酶體增殖活化受體γ共激活因子1α信號途徑在糖尿病周圍神經病變機制中的作用[J].中國醫學科學院學報,2018,40(1):122-127.
[17]馬歡,劉敏,邢邯英,等.5-氨基-4-甲酰胺咪唑核糖核苷酸對軟脂酸誘導的C2 C12細胞線粒體功能相關蛋白表達的影響[J].中華老年醫學雜志,2018,37(2):211-214.
[18]李瑩,黃南渠,李園園,等.AMPK/SIRT1-PPARγ-PGC1α-BACE1信號通路及其相關因子在阿爾茨海默病病理改變中的作用[J].醫學綜述,2019,25(5):850-855,861.
[19]王俊偉,馬劍達,荊俊,等.過氧化物酶體增殖物激活受體γ輔激活因子1β促進破骨細胞活化的調控機制[J].中華醫學雜志,2019,99(46):3638-3644.
[20]徐子涵,蔡佳宇,李婧,等.姜黃素對類風濕關節炎破骨細胞分化中核因子κB受體活化因子基因及蛋白表達的影響[J].安徽醫藥,2019,23(10):1917-1920.
(收稿日期:2020-09-23) (本文編輯:姬思雨)

