自制低壓吹氧裝置對胸腔鏡手術患者呼吸功能和炎性因子的影響
陳珊,劉勝強,何胤琰
單肺通氣(OLV)技術促進了胸科手術的發展,目前廣泛應用于食管、肺葉及縱隔等手術,但也是肺損傷的危險因素,且胸科手術患者術后出現肺部并發癥的風險性也明顯高于其他手術[1]。越來越多的研究表明,OLV 是引起肺損傷的獨立危險因素[2],任何OLV 都是非生理性的,均可導致組織性的肺損傷,OLV時呼吸機設置的通氣模式對急性肺損傷的影響也逐漸受到麻醉醫師的關注[3]。本研究模擬文丘里管自制低壓吹氧裝置用于萎陷肺吹氧,擬觀察其對胸腔鏡手術患者呼吸功能和炎性因子的影響。報道如下。
1 資料與方法
1.1 一般資料 收集2018 年12 月至2020 年10 月杭州市中醫院收治的擬全身麻醉下行胸腔鏡下肺葉切除術(一葉肺切除術,左右不限)患者60 例,排除標準:(1)嚴重的心血管疾病者;(2)中樞神經系統障礙者;(3)手術前3個月內發生呼吸系統急性炎癥性疾病者;(4)手術時間>4h 者;術中出血量>1 000 ml 者。本研究經醫院醫學倫理研究委員會審查并批準,并與患者簽署了知情同意書。其中男35 例,女25 例;年齡40 ~65 歲;ASA 分級為Ⅰ~Ⅱ級;體質量指數(BMI)為18 ~25 kg/m2;術前心電圖、血生化指標及電解質均在正常范圍內,心、肺及腎功能良好。
1.2 分組及方法 采用隨機數字表法分為觀察組及對照組,各30 例。對照組予非通氣側管空置,通大氣;觀察組予單肺通氣后將venturi 管低壓吹氧裝置用于非通氣肺吹氧(氧氣流量表5L/min,venturi管旋至30%的刻度處連接非通氣側導管)。術前常規禁食8 h,禁飲4 h,入室后開放外周靜脈,連接監護儀并粘貼腦電雙頻指數(BIS)電極片,局部麻醉下予橈動脈穿刺測壓及右側頸內靜脈穿刺置管。兩組患者均采用靜脈注射咪唑安定0.02 ~0.04 mg/kg,舒芬太尼0.5 g/kg,丙泊酚1.0 ~2.0 mg/kg,順式阿曲庫胺0.2 mg/kg 誘導插管,在可視喉鏡輔助下行雙腔氣管插管術,并采用可視纖維支氣管鏡確定導管位置進行雙肺隔離,連接麻醉機,設置通氣模式為IPPV,之后行單肺通氣潮氣量5 ~6 ml/kg,呼吸頻率14 ~16 次/min,吸呼比(I∶E)為1∶1.5,呼氣末正壓為 5 cmH2O(1 cmH2O≈98 Pa),術中限制氣道壓Ppeak<30 cmH2O,術中靜脈輸注異丙酚4~8 mg·kg-1·h-1、瑞芬太尼0.2 ~1.0 g·kg-1·min-1以維持麻醉,間斷靜脈注射阿曲庫銨維持肌松,根據BIS 值維持在40 ~60 以調節麻醉深度,術中血壓波動不超過基礎血壓的30%,根據液體丟失量和失血量指導補液和輸血,中心靜脈壓(CVP)維持在6 ~l0 cmH2O,尿量保持l ml·kg-1·h-1以上。
1.3 觀察指標 依次在麻醉誘導前(T0)、OLV即刻(T1)、OLV 30 min(T2)、OLV 90 min(T3)及術畢(T4)患者采集橈動脈血樣2 ml,用血氣分析儀測定二氧化碳分壓(PaCO2)與氧分壓(PaO2)指標,計算肺泡-動脈氧分壓差(PA-aDO2)、氧合指數(OI)和肺順應性(CL),并記錄患者術后肺功能異常的發生情況。于T0、T1、T2、T3 及T4 時刻采集橈動脈血樣5ml,采用酶聯免疫吸附ELISA法檢測各時刻的血漿白介素-1(IL-1)的濃度,采用凝膠阻滯EMSA測定各時刻的中性粒細胞核因子F- B B(NF- B)DNA結合活性。
1.4 統計方法 數據采用SPSS 16.0 軟件分析,計量資料以均數±標準差表示,采用 檢驗;計數資料采用2檢驗。<0.05 為差異有統計學意義。
2 結果
2.1 一般情況比較 兩組年齡、性別、體質量、手術時間、OLV 時間、術中出血量及總輸液量差異均無統計學意義(均>0.05),見表1。
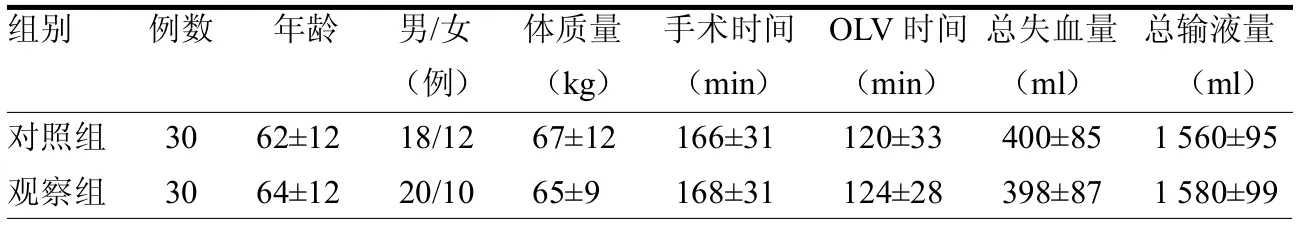
表1 兩組一般資料比較
2.2 IL-1 濃度及N F- BDNA 結合活性的比較 T0、T1 時刻兩組IL-1 濃度和NF- B DNA 結合活性差異均無統計學意義(≤0.75,均>0.05),在T2、T3 及T4 時刻,兩組血漿IL-1 濃度和NF- B DNA 結合活性均較T0 及T1 時刻升高(≥3.46,均<0.05)。觀察組T2、T3及T4 時刻血漿IL-1 濃度和NF- B DNA結合活性均低于對照組(≥2.14,均<0.05),見表2。
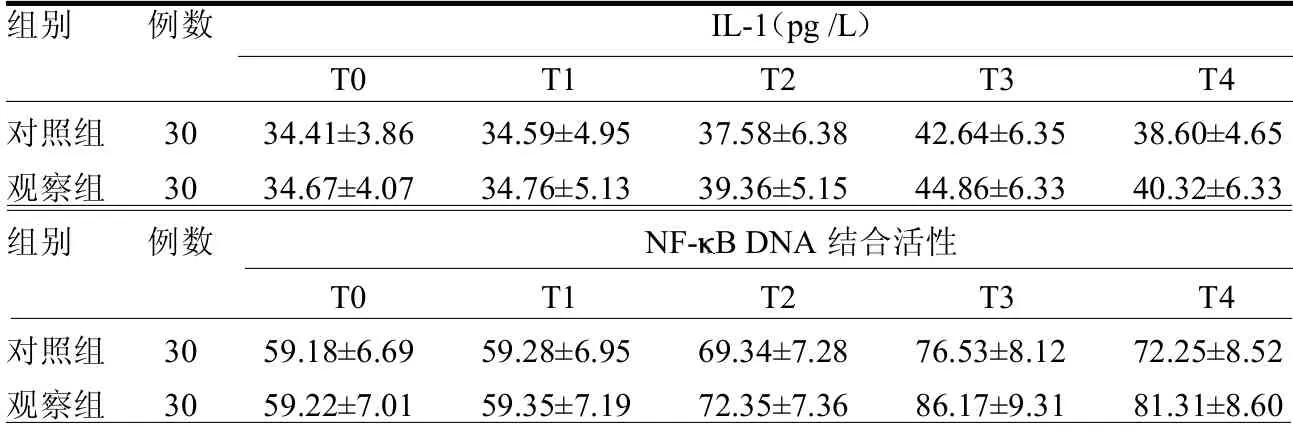
表2 2 兩組不同時刻IL-1 濃度和NF- B DNA 結合活性比較
2.3 PA-aDO2、CI及OI比較 在T0、T1時刻,兩組PA-aDO2、CI 及OI 差異均無統計學意義(≤0.87,均>0.05)。在T2、T3 及T4 時刻,兩組PA-aDO2均較T0 及T1 時刻高(≥3.16,均<0.05),且均遵循先升后降的模式,峰值出現在T3 時刻。觀察組T2、T3、T4 時刻PA-aDO2均低于對照組(≥3.63,均<0.05)。在T2、T3 及T4 時刻,兩組CI 和OI 均較T0 及T1 時刻下降(≥2.67,均<0.05),且均遵循先降后升的模式,谷值出現在T3 時刻;觀察組T2、T3 及T4 時刻的CI 和OI 均高于對照組(≥2.34,均<0.05),見表3。
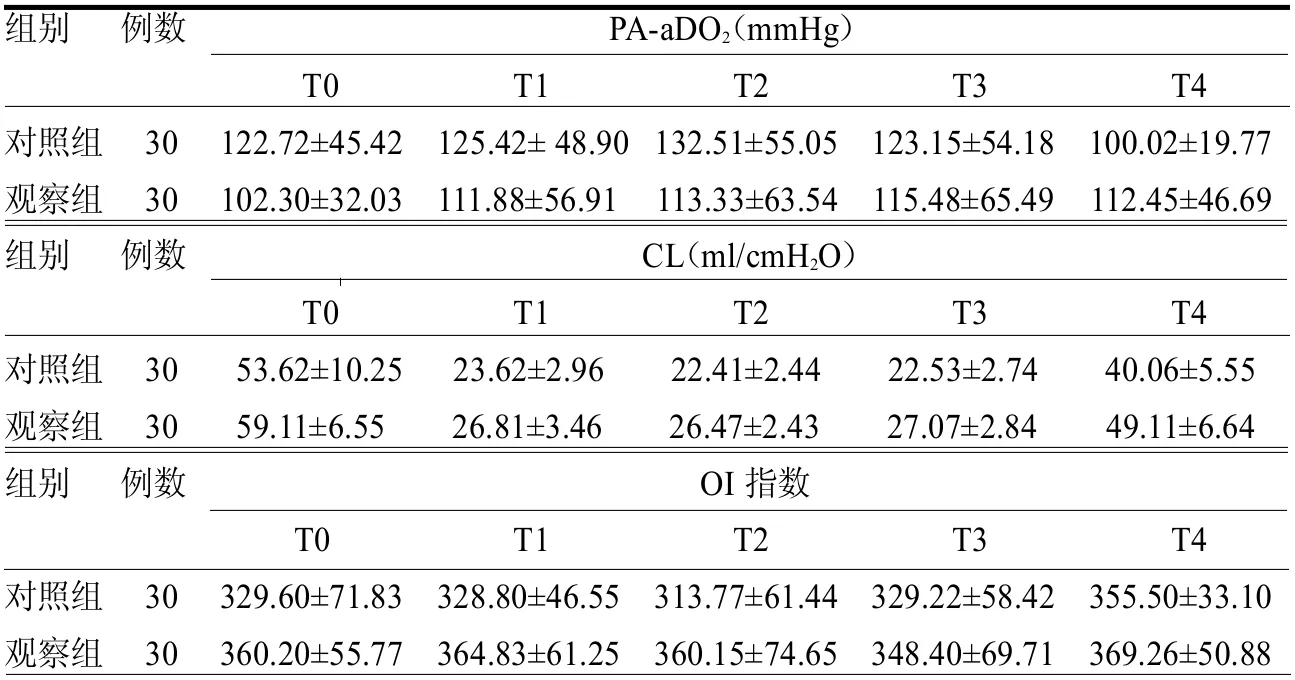
表3 兩組T0、T1、T2、T3 及T4 時刻PA-aDO2、OI 和CI 比較
3 討論
胸腔鏡手術由于受到如患者年齡、麻醉藥物等多種因素的影響,加上手術本身以及機械OLV 均可造成急性肺損傷[4],并通過炎性介質、氧自由基等信號通路導致肺間質和肺泡水腫。研究表明,>1 h OLV 被認為是肺復張后嚴重氧化應激導致肺損傷,進而引起心血管并發癥的潛在原因[5]。OLV 時,萎陷肺有血流但無通氣,而另一側肺雖有通氣,但側臥位會導致肺血流的增加,通氣/血流(V/Q)減低,從而產生肺內分流以及低氧血癥[6];當非通氣側肺停止機械通氣時,肺內血液重新分布并處于低灌注狀態,此時會刺激炎性介質釋放,促進內皮細胞包糖多被的降解[7],增加呼吸膜通透性進而導致肺損傷。隨著對麻醉機OLV 相關性肺損傷的日益關注,個體化肺保護性通氣策略已逐漸被應用于臨床[7]。肺保護性通氣策略主要包括聯合小潮氣量(5~6ml/kg)、PEEP(5 cmH2O)以及肺復張手法等[8],都被證實能有效地減輕圍術期肺部炎癥反應,降低術后并發癥的發生率[9]。
本研究運用自制低壓吹氧裝置,根據預試驗結果,將文丘里管旋至30%刻度處,接氧氣流量表為5L/min,文丘里直接連接于雙腔管患側導管處,導管末端(相當于患側肺)的氧氣壓力為1 ~2 mmHg,用于患側肺術中持續吹氧,結果顯示低壓吹氧可以提高OLV 的PaO2,同時并未造成患側肺膨脹而妨礙術者操作。OI 是反映肺換氣功能的指標,指標參數越大說明肺換氣功能越好;CL 指標則反映了肺臟的順應性。本研究結果提示自制低壓吹氧裝置可改善OLV 患者OI 和CL,進一步改善由于手術原因所導致的患者肺泡閉陷的情況,顯著提高通氣/血流比,從而達到減少肺內異常分流的效果,而這一結果的直接表現則是PaO2明顯上升,與之前的實驗結果相呼應。
干擾素-(TNF- )是一種細胞調節因子,與多種炎癥因子的分泌直接相關,其介導分泌的IL-1能激活炎癥細胞,啟動炎癥反應[10]。同時能夠作用于轉錄因子NF- B激活黏附因子表達,誘導IL-1 等炎癥因子分泌,因此,NF- B和IL-1的水平在某種意義上可反應OLV 后肺損傷的嚴重程度。
本研究結果顯示,兩組術前血清IL-1 及NF- B 水平差異無統計學意義(>0.05),OLV 30 min后兩組血清IL-1 及NF- B 濃度開始上升,提示胸腔鏡手術可導致炎癥介質釋放增加,90 min 后兩組值均達到高峰,說明隨著手術的進行,炎癥因子的釋放逐漸增加,這可能是多因素共同作用的結果;術畢兩組患者血清IL-6、NF- B 開始下降,但仍高于術前水平,提示術后兩組患者肺損傷開始逐漸恢復,且需要一定的時間。
綜上所述,自制低壓吹氧裝置能使患者在OLV 期間維持更好的氧合,抑制炎癥因子NF- B 和IL-1 的活性,減輕圍術期肺損傷,減少術后肺不張發生率。

