長鏈非編碼RNA HOX 轉錄反義RNA/miR-124參與乳腺癌細胞轉移的調控研究
張輝
研究表明,長鏈非編碼 RNA(LncRNA)能通過募集多梳蛋白復合物并使其定位到HOXD 基因位點,從而促進乳腺癌的發生與發展[1]。HOX 轉錄反義RNA(HOTAIR)是一種反式LncRNA,在乳腺癌組織中處于高表達狀態,且與腫瘤細胞轉移有關[2]。microRNA 是一類較短的非編碼RNA分子,在直腸癌組織中,miR-124 可通過抑制信號傳導抑制腫瘤的生長。研究表明,miR-124 在乳腺癌組織中表達水平較低,可能與患者病情進展有關[3]。本研究擬觀察LncRNA HOTAIR/miR-124 參與乳腺癌細胞轉移的調控情況,報道如下。
1 資料與方法
1.1 一般資料 收集2018 年2 月至2020 年3 月浙江省溫州市中醫院收治的行乳腺癌切除術患者87 例,納入標準:(1)既往無放、化療史,無免疫及內分泌治療史;(2)臨床資料完整;(3)患者及家屬對本次研究知情,并自愿簽訂知情同意書。排除標準:(1)合并其他惡性腫瘤或血液系統疾病者;(2)孕產婦;(3)HIV 陽性者;(4)精神疾病患者。收集患者腫瘤組織及癌旁組織,并經病理學檢查確診為乳腺癌。其中年齡33 ~73 歲,平均(52.3±12.7)歲;TNM 分期[4]為Ⅰ期36 例,Ⅱ期28 例,Ⅲ期14 例,Ⅳ期9 例。
1.2 方法
1.2.1 細胞株與主要試劑 人正常乳腺上皮細胞 MCF-10A、乳腺癌細胞MCF-7、MDA-MB-231 及T-470(上海鈺博生物科技有限公司);Trizol 試劑(Thermo Fisher);山羊抗小鼠IgG(qRTPCR)試劑盒(美國Ambion 公司);miR-124 逆轉錄引物(上海海方生物技術有限公司);細胞增殖測定試劑盒CCK8(吉滿生物科技有限公司);E-cadherin、Vmentin、Snail、Slug、Zebl、SP1、GAPDH-抗(美國Abcam公司);Invasion和Migration試劑盒(美國Cell Biolabs)。
1.2.2 RT-qPCR測定 乳腺癌組織及癌旁組織按照試劑說明書提取組織總RNA 并溶于20 l DEPC 水中,-80℃冷藏備用。采用反轉錄試劑盒將RNA反轉錄成cDNA,采用RT-qPCR 法測定HOTAIR和miR-124表達情況。HOTAIR表達水平測定:選擇組織和血清中穩定表達的-actin 作為內參,HOTAIR 引物及-actin 由Primer5 軟件進行設計,經BLAST 比對后進行合成。引物序列:actin 上游5’-TCCTCTCCCAAGTCCACACA-3’,下游5’- GCACGAAGGCTCATCATTCA- 3’;HOTAIR 上游5’-GGTAGAAAAAGCAACCACGAAGC-3’,下 游 5’-ACAT-AAACCTCTGTCTGTGAGTGCC-3’。采用2-△△Ct法計算各組mRNA 的相對表達量。
1.2.3 細胞增殖、侵襲以及轉移能力的測定 MDA-MB-231、T-47D 細胞分別轉染miR-陰性對照(miR-NC)、miR-124模擬物。轉染后的細胞采用CCK8 試劑盒于24、48、72 及96h,在450nm 波長處測定吸光度值。使用Invasion和Migration試劑盒測定轉染后穿透膜的細胞數目。將MCF-7 細胞進行處理,分為穩定高表達HOTAIR 的MCF-7 細胞株(HOTAIR組)、感染對照空病毒的MCF-7 細胞株(感染組)和未處理MCF-7 細胞株(空白組)。Transwell 小室培養,棄上清,加入多聚甲醛固定細胞,以0.01%結晶紫進行細胞染色,在光學顯微鏡下計數穿膜細胞數,隨機選擇5個視野,計算平均值。
1.2.4 pMIR-SP1 的3’UTR熒光報告載體構建及熒光素酶活性檢測 構建pMIR-SP1 的3’UTR 載體。轉染后分為4 組:miR-NC 和pMIR-SP1 的3’UTR組,miR-124 模擬物和pMIRSP1 的3’UTR 轉染組,miR-NC 和突變型pMIRSP1 的3’UTR 組,miR-124 和突變型pMIR-SP1 的3’UTR組。再與質粒pRLTK共轉染HEK293 細胞,24 h后使用雙熒光素酶報告基因檢測系統處理裂解細胞,檢測熒光強度。
1.2.5 Western blot 法 裂解轉染后的MDA-MB-231、T-47D細胞,以12000r/min離心10min,收集上清。miR-124:分別采用SP1 的一抗,GAPDH 的一抗孵育過夜后,加入山羊抗小鼠IgGHRP標記抗體孵育45min。HOTAIR:分別孵育E-cadherin、Vmentin、Snail、Slug、Zebl和GAPDH一抗及二抗。PBS 洗滌后,ECL 顯色。
1.3 統計方法 數據采用SPSS22.0 軟件分析,計量資料采用均數±標準差表示,采用 檢驗;采用GraphPad Prism 5.0軟件進行圖像繪制。<0.05 為差異有統計學意義。
2 結果
2.1 HOTAIR 在乳腺癌組織中的表達各期乳腺癌組織中HOTAIR 表達均高于癌旁組織(均<0.05)。見表1。
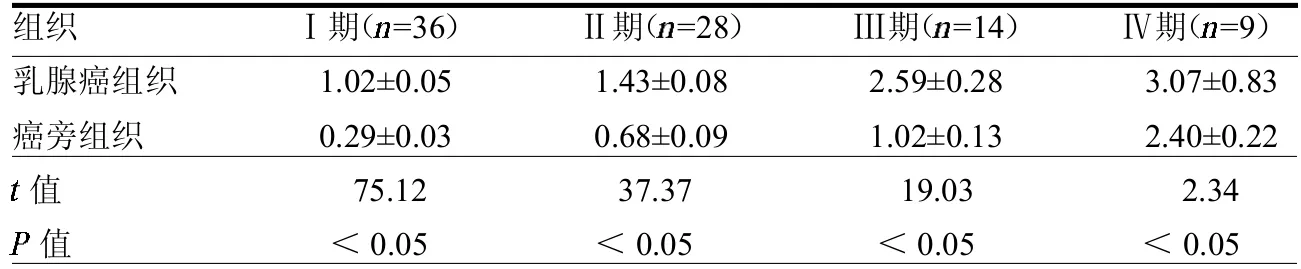
表1 HOTAIR 在乳腺癌組織和癌旁組織中的表達
2.2 MCF-7 細胞系侵襲比較 HOTAIR 組穿膜細胞數(123±8)個/視野,顯著高于感染組(33±9)個/視野,差異具有統計學意義(=69.71<0.05);空白組穿膜細胞數(32±6)個/視野,與感染組差異無統計學意義(=0.86>0.05)。
2.3 MCF-7 細胞發生上皮-間質細胞轉化情況 HOTAIR 組E-cadherin 蛋白表達顯著下降,Vimentin 蛋白和Slug 表達顯著增加,Snail和Zebl表達水平無明顯變化。見圖1。
2.4 miR-124 在乳腺癌細胞系中的表達水平 miR-124 在乳腺癌細胞系MCF-7(2.1±0.18)、MDA-MB-231(1.0±0.08)及T-470(1.1±0.1)中的表達水平顯著低于人正常乳腺上皮細胞MCF-10A(3.2±0.25),差異均有統計學意義(≥6.51,均<0.05)。
2.5 miR-124 過表達抑制乳腺癌細胞系的增殖、侵襲和轉移 與轉染miR-NC比較,轉染 miR-124 模擬物在 MDAMB-231 和T-47D 中的表達水平顯著提高(封三彩圖3a、b)。與轉染miR-NC 比較,轉染miR-124模擬物能顯著抑制乳腺癌細胞的增殖(封三彩圖3c、d)、侵襲(封三彩圖3e)及遷移能力(封三彩圖3f)。
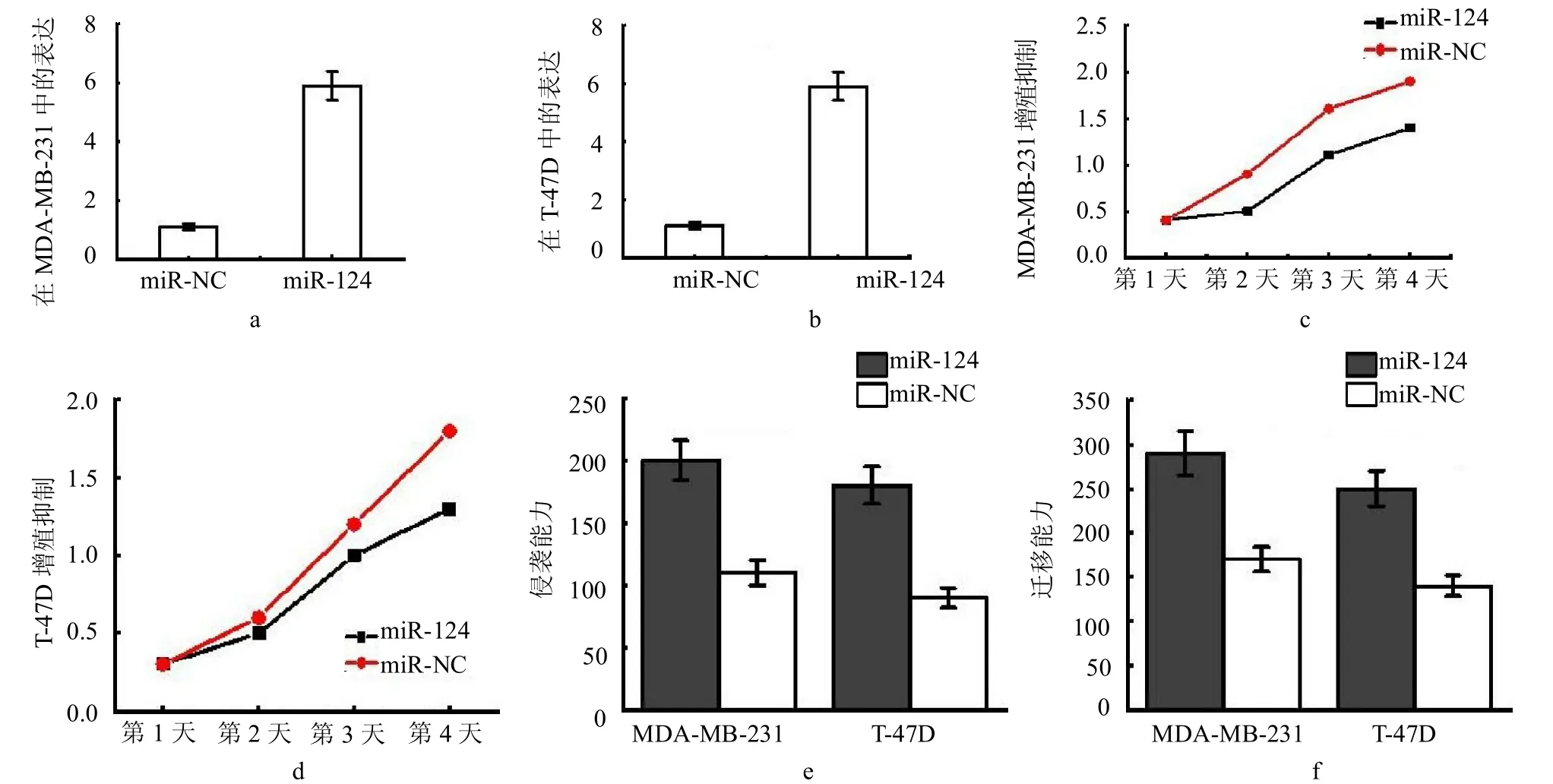
圖3 a:MDA-MB-231 中表達水平;b:在T-47D 中表達水平;c:對MDA-MB-231 增殖抑制作用;d:對T-47D 增殖抑制作用;e:乳腺癌細胞侵襲能力;f:乳腺癌細胞遷移能力
2.6 miR-124 靶基因SPI鑒定及過表達后對SP1 表達的抑制 與轉染miR-NC和pMIRSP1 的3’UTR 比較,轉染miR-124 模擬物和pMIRSP1 的3’UTR的熒光強度顯著降低;與轉染miR-NC比較,轉染miR-124 模擬物后SP1mRNA和SP1 蛋白質表達水平顯著降低。
3 討論
HOTAIR 是LncRNA 的重要成員之一,其可通過與相關復合體結合并使染色體封閉,造成基因沉默[4]。葉柳青等[5]研究表明,在乳腺癌轉移性表征中,HOTAIR呈高表達狀態,是其他表征的數百至數千倍,且高于其在乳腺癌原發灶的表達水平。此外,HOTAIR 還可以增強乳腺癌細胞的放療抵抗,增加疾病的治療難度[6]。Vimentin 蛋白是間質性腫瘤和上皮源性腫瘤的鑒別標志;Slug、Snail和Zebl是細胞發生EMT時的轉錄因子。本研究中,HOTAIR 在乳腺癌組織中的表達水平較高,且HOTAIR 組乳腺癌細胞穿膜細胞數量較多。說明HOTAIR 參與了乳腺癌的發展,并且可以提高腫瘤細胞的侵襲能力。HOTAIR 組E-cadherin蛋白表達下降,Vimentin 蛋白和Slug 表達增加。說明HOTAIR 可能通過調節Slug 促進乳腺癌細胞發生EMT,從而促進腫瘤細胞進行侵襲和轉移。
Slug 基因是miR-124 基因靶點之一,并與miR-124 的表達水平呈負相關。本研究結果顯示,miR-124在乳腺癌細胞中的表達水平低于人正常乳腺上皮細胞。說明乳腺癌的發展可能與miR-124低表達有關。轉染miR-124 模擬物在MDA-MB-231 和T-47D中的表達水平提高,且轉染miR-124 模擬物能抑制乳腺癌細胞的增殖、侵襲及遷移能力。說明miR-124 過表達后可抑制乳腺癌細胞的增殖、侵襲和遠處轉移。本次研究通過構建pMIR-SP1 的3’UTR 熒光報告載體,檢測鑒定miR-124 靶基因SP1,轉染miR-124 模擬物后顯示SP1 mRNA 和SP1 蛋白質表達水平降低。說明miR-124過表達可抑制SP1,而miR-124 低表達可能是乳腺癌發展重要原因。
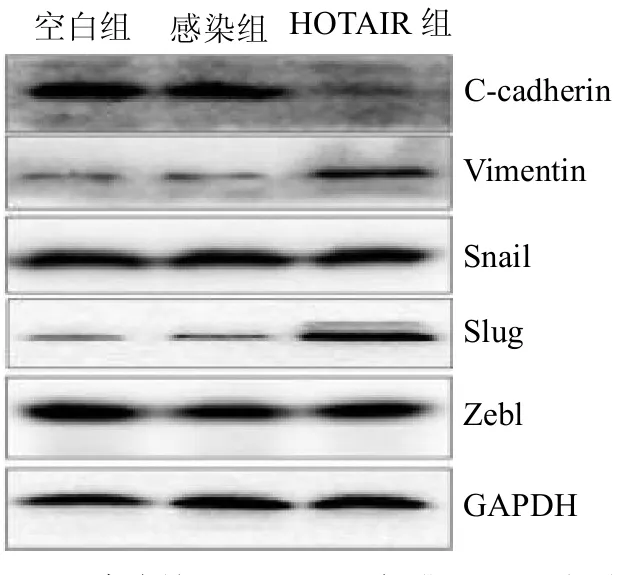
圖1 高表達HOTAIR 可促進MCF-7 細胞發生上皮-間葉細胞轉化
綜上所述,HOTAIR 在乳腺癌組織中過表達,可誘導乳腺癌細胞發生EMT,從而促進腫瘤細胞侵襲及轉移;miR-124在乳腺癌組織中過表達,可通過調控轉錄因子SP1 抑制乳腺癌細胞的增殖、侵襲和轉移。

