秸稈添加量對土壤生物固氮速率和固氮菌群落特征的影響
李旭,董煒靈,宋阿琳,李艷玲,盧玉秋,王恩召,劉雄舵,王萌,范分良
秸稈添加量對土壤生物固氮速率和固氮菌群落特征的影響
李旭,董煒靈,宋阿琳,李艷玲,盧玉秋,王恩召,劉雄舵,王萌,范分良
中國農業科學院農業資源與農業區劃研究所/農業農村部植物營養與肥料重點實驗室,北京 100081
【】研究不同秸稈添加量對土壤固氮速率及固氮菌群落結構的影響,為我國秸稈還田及化肥減施增效提供支持。采用室內培養試驗,除對照(C0: 0)外共設5個秸稈添加梯度(C1:0.2mg·g-1;C2:1.0mg·g-1;C3:2.0mg·g-1;C4:4.0mg·g-1;C5:10.0mg·g-1),采用15N2標記的方法,在黑暗條件下培養28d后收集土壤樣品,進而對生物固氮速率進行定量,利用Illumina PE250高通量測序和熒光定量PCR技術分析固氮功能基因的豐度及群落特征。隨著秸稈添加量的增加,土壤硝態氮含量顯著下降,銨態氮含量無顯著變化,土壤pH有下降趨勢。同時,生物固氮速率顯著增加,C3、C4及C5處理在培養期間(28d)潛在固氮速率為87—96kgN·hm-2·a-1,相比于對照提高了38.1%—52.4%。各處理固氮微生物基因拷貝數變化范圍為5.48×107—9.20×107copies/(g soil),其中,相比于C0,C4及C5處理固氮微生物基因拷貝數均顯著提高(<0.05)。隨著秸稈添加量的增加,C4、C5水平的香農-威爾指數顯著低于其他4個處理(<0.05),其他4個處理多樣性無顯著差異。主成分分析(PCoA)結果顯示土壤固氮微生物群落結構主要因秸稈添加量差異而聚集為不同組別。固氮微生物在門水平上分為變形桿菌(Proteobacteria),藍細菌(Cyanobacteria),厚壁菌(Firmicutes)和放線菌(Actinobacteria)和螺旋體菌(Spirochaetes)。隨著秸稈添加量的增加,藍細菌相對豐度有先增加再降低的趨勢;在屬水平上,不同優勢菌屬對秸稈添加量的響應存在明顯差異,慢生根瘤菌()為數量最豐富菌屬,隨著秸稈添加量的增加,C5相較于C0、C1、C2、C3水平相對豐度差異顯著(<0.05),顯著增加了12.07%—14.13%。與生物固氮速率呈正相關的賀氏偽枝藻屬()隨著秸稈添加量的增加其相對豐度逐漸增加,但當秸稈添加量達C5水平其相對豐度反而降低(<0.05)。同時,最小偏二乘路徑分析(PLS-PM),冗余分析(RDA)及相關性分析表明生物固氮速率和土壤固氮微生物群落受秸稈添加量和NO3--N含量影響較大。土壤生物固氮速率隨著秸稈添加量的增加而增加,秸稈對固氮的促進作用主要源于秸稈添加降低了土壤NO3--N含量,進而促進慢生根瘤菌()、賀氏偽枝藻屬()和固氮螺菌屬()等固氮菌屬微生物的生長。根據本試驗結果計算,相比于不添加秸稈,添加秸稈4.0mg·g-1后,土壤生物固氮速率約增加26kg N·hm-2·a-1,可顯著降低我國氮肥需求。
固氮微生物;秸稈還田;固氮速率;15N2定量;
0 引言
【研究意義】生物固氮通過少數固氮原核微生物體內的固氮酶系統,將大氣中的N2催化轉化為植物可利用的形式,每年可為農田生態系統提供氮素輸入40—70 Tg N,是農業生態系統中氮素的重要來源之一[1-4]。生物固氮分為共生固氮和非共生固氮。據報道,作物生物量中約有24%的氮素來自非共生固氮[5-6]。近年來,過度施用氮肥導致的一系列環境問題和不斷增加的經濟成本都要求我們盡可能提高生物固氮的潛力[7-9]。秸稈還田后可補充大量有機碳源和能量,改善土壤理化性質并提高土壤細菌和非共生固氮微生物的數量和活性[10-11],從而促進生物固氮[12-13]。因此,充分利用秸稈資源,發揮非共生固氮微生物的固氮潛力對農田生態系統氮素輸入及農業生產具有重要意義。【前人研究進展】非共生固氮微生物的群落組成及其固氮酶活性受到土壤水分和溫度,土壤質地及pH,微量元素,養分有效性(N、P)和碳源可利用性等多種土壤和環境因子的綜合影響[14-18]。由這些因素引起的固氮微生物群落多樣性及結構的變化,可較好地反應其生物固氮的能力[15,19-20]。一些研究表明土壤中固氮酶活性與可利用的植物殘茬量和分解率成正相關[21-23],作物秸稈還田后可以改變固氮群落結構的組成,增加基因豐度并促進生物固氮[14,20,24-27],但在一些研究中這種關系還不明確[28-29]。此外,有研究發現固氮速率顯示出對固氮微生物多樣性增加的飽和趨勢[15]。有研究表明,在作物秸稈投入的情況下,非共生固氮微生物的固氮潛力可在2—4周的短時間內達到1—12 kg N·hm-2[21,30];另一項測量澳大利亞非共生固氮潛力的研究表明,非共生固氮對作物生長的貢獻可能小于10 kg N·hm-2·a-1,但在土壤氮含量較低且碳源充足的情況下,固氮效率可能會更高,在理想(溫暖,潮濕)條件下新鮮秸稈投入,或可使固氮潛力高達30—38 kg N·hm-2·a-1[11,31]。目前關于秸稈投入對非共生固氮影響的研究說法不一,可能是由兩方面原因造成:秸稈還田量不同,已有的研究秸稈還田多為全量添加或非限制性的[11-21],例如Roper在早期田間試驗中,秸稈還田量為4.5 t·hm-2,測得固氮速率約為1.1 kg N·hm-2·a-1,關于不同秸稈添加量與固氮微生物固氮速率的定量研究少之又少;關于非共生固氮微生物的固氮能力的研究,絕大多研究采用乙炔還原法(ARA)間接測定,但可能會造成固氮速率的錯誤估計,由于測定條件的影響,乙炔還原法(ARA)中C2H2﹕N2的比值可能明顯偏離理論轉換因子,須使用15N2方法對其進行校正[32],15N2方法作為定量生物固氮潛力的唯一直接方法,有著良好的靈敏度和精確度[33]。以往的研究表明,變形桿菌(Proteobacteria)和藍細菌(Cyanobacteria)是土壤中豐富的固氮微生物[34];同時參與分解玉米秸稈和固氮過程的包括根瘤菌()、中華根瘤菌()及部分未培養的固氮微生物[35]。受限于多數固氮菌難以培養及早期克隆測序不能全面了解固氮菌群落特征,秸稈投入如何影響固氮菌群落特征仍需進一步探索。【本研究切入點】上述研究表明,土壤固氮微生物對秸稈投入數量的響應有差異,同時測定方法也存在局限。近年來,隨著我國“減肥增效”政策的推進,秸稈還田引起人們的廣泛關注,在促進生物固氮能力方面,我們對于秸稈還田后如何影響固氮微生物群落及其固氮酶活性仍缺乏清晰地認識,同時由于多數固氮微生物難以培養,使用15N2同化方法,高通量測序等方法對秸稈還田促進生物固氮能力進行研究勢在必行。【擬解決的關鍵問題】采用15N2方法,揭示秸稈添加量與土壤固氮速率和固氮菌群落特征的關系,以期為秸稈還田促進農業生產提供參考。
1 材料與方法
1.1 試驗設計
供試土樣取樣自河南省洛陽市孟津縣旱地耕層土(0—20 cm)(北緯N34°52′55.74″,東經E112.24′14.98″),土壤類型為潮土,其基礎理化性質為:土壤pH為6.89,土壤有機質36.95 g·kg-1,銨態氮含量8.80 mg·kg-1,硝態氮含量11.00 mg·kg-1,速效磷28.47 mg·kg-1,有效鉀210 mg·kg-1,土壤過2 mm篩,去除植物殘根和石塊等雜質,混勻備用。
土壤預培養(25℃,黑暗條件)7 d后,準確稱取5.0 g干土等重的鮮土于20 mL滅菌螺口玻璃瓶中,除對照(C0:0)外分別添加粉碎玉米秸稈(C1:0.2 mg·g-1;C2:1.0 mg·g-1;C3:2.0 mg·g-1;C4:4.0 mg·g-1;C5:10.0 mg·g-1),混合均勻后,加入1.20 mL無菌水平衡水分至60%田間持水量,隨后加橡膠塞用鋁蓋旋緊并檢查氣密性。15N2處理使用真空泵將玻璃瓶抽成真空,用純O2反復置換3次以保證瓶中不含N2,隨后瓶內氣體被置換為15N2﹕O2(v/v= 4﹕1),每7天按照上述方法重新置換氣體,為避免可能的污染和對固氮速率的高估[36],15N2氣體使用前均采用OHYAMA等[37]的方法進行清洗后使用。采用實驗室空氣作為對照,每7天敞口曝氣30 min,所有處理黑暗條件下25℃培養28 d。
1.2 樣品采集及指標測定
在培養第28天對樣品進行破壞性取樣,土壤取出后混合均勻,一部分4℃保存,用于理化性質及固氮速率測定,待測完無機氮后,風干磨細用于其他土壤理化指標的測定,其中NO3--N和NH4+-N使用0.01mol·L-1CaCl2浸提,后續比色測定;土壤速效磷用0.5 mol·L-1NaHCO3浸提,鉬銻抗比色法測定;土壤速效鉀用1mol·L-1醋酸銨浸提,原子吸收儀測定;土壤pH用快速pH測定儀測定;土壤有機質采用K2Cr2O7氧化外加熱法;稱取少量15N2處理土壤,置于烘箱70℃烘干72 h,隨后研磨過100目篩后送樣,使用元素分析儀串聯同位素質譜儀(IsoPrime100)測定土壤樣品中的15N豐度。然后,通過比較15N2處理的土壤相對于對照原子豐度的差異,計算生物固氮(biological N2fixation),計算公式如下:
BNF(μg·g-1DW)= total Nsample(μg·g-1DW)×atom%15Nexcess
式中,BNF(μg·g-1DW)為生物固氮量;atom%15Nexcess=atom%15Nsample-atom%15Ncontrol;total Nsample為總氮含量。另一部分存于-80℃,用于土壤DNA提取。
1.3 DNA提取、PCR擴增和測序
使用FastDNA SPIN Kit for Soil 試劑盒(MP Biomedicals,USA)提取土壤總DNA,隨后使用1%瓊脂糖凝膠電泳檢驗DNA提取質量,用NanoDrop 2000微量分光光度計(Thermo Scientific,USA)檢測其濃度和純度,保存至-20℃備用。
將提取的DNA原液稀釋至約10 ng·μL-1作為PCR擴增模板,采用two-step PCR法進行擴增。第一輪擴增引物為帶有16 bp頭部序列的polF(TGC GAY CCS AAR GCB GAC TC),polR(ATS GCC ATC ATY TCR CCG GA),擴增體系為25 μL,包含:2.5 μL 10×buffer,2 μL dNTP,0.25 μL rTaq(Takara)、10 μmol·L-1的前后引物各1 μL、1 μL模板DNA和17.25 μL ddH2O,每個樣品3個重復。第一輪PCR擴增程序:95℃預變性3 min后,95℃變性30 s,62℃退火30 s,72℃延伸60 s,循環40次,循環結束后72℃保持10 min,4℃條件下結束。將同一樣本的3次重復的DNA擴增混勻后,用1%的瓊脂糖凝膠電泳檢測。第二輪擴增使用第一輪擴增產物作為模板DNA,前引物為長度為16 bp的不同barcode引物,后引物為polR(ATS GCC ATC ATY TCR CCG GA),擴增體系為50 μL,包括:5 μL 10×buffer,4 μL dNTP,0.5 μL rTaq(Takara)、10 μmol·L-1的前后引物各2 μL、2 μL模板DNA和34.5 μL ddH2O,每個樣品3次重復,擴增程序循環次數為10次,其他設定同第一輪。擴增引物及策略參照GABY等[38-39]的方法。
將同一樣本的3次重復的DNA擴增混勻后,用1%的瓊脂糖凝膠電泳檢測。使用PicoGreen試劑盒測定所得PCR產物濃度,等摩爾量混勻后,采用DNA純化試劑盒(TIANGEN Biotech,Beijing,China)進行純化回收,按照每個樣本的測序量要求,進行相應比例的混合。混合后的樣品通過Illumina Hiseq2500 PE250平臺(Novogene公司)進行序列測定,測序數據已上傳至GSA數據庫(GSA編號:CRA002883)。
1.4 絕對定量PCR(qPCR)
qPCR采用ABI 7900實時定量PCR系統進行檢測,選用的熒光試劑是SYBR Premix Ex TaqTMⅡ。qPCR的標準曲線制作方法如下:以對照組土樣提取DNA為模板進行PCR擴增,擴增引物是ploF(TGC GAY CCS AAR GCB GAC TC)和polR(ATS GCC ATC ATY TCR CCG GA),體系如上所述,檢查PCR產物并使用DNA純化試劑盒(TIANGEN Biotech,Beijing,China)純化回收產物;使用pMDTM18-T Vector Cloning Kit(TaKaRa Bio Inc.)試劑盒將回收純化后的PCR產物與pMD18載體連接;最后使用MiniBEST Plasmid Purification Kit Ver.4.0(TaKaRa Bio Inc.)質粒純化試劑盒對菌液進行質粒提取與純化,使用NanoDrop 2000微量分光光度計(Thermo Scientific,USA)檢測其濃度和純度,計算質粒拷貝數并逐步稀釋到108—101拷貝數備用[40-41]。qPCR擴增引物是ploF(TGC GAY CCS AAR GCB GAC TC)和polR(ATS GCC ATC ATY TCR CCG GA),擴增體系為15 μL,包含7.5 μL 2×SYBR Premix Ex Taq II、0.3 μL 50×ROX Reference Dye、10 μmol·L-1的前后引物各0.6 μL、2 μL DNA模板和4.0 μL ddH2O,每個樣品3次重復。擴增程序:95℃預變性30 s,95℃解鏈5 s,62℃退火30 s,72℃延伸60 s,83℃采集信號10 s,40個循環。
1.5 生物信息學分析
高通量測序數據經過數據質控,進行序列拼接、過濾并去除嵌合體后得到高質量序列。隨后以97%相似性水平進行分類操作單元(OTU)聚類,使用數據庫進行物種分類注釋及后續分析[42]。
1.6 數據處理
試驗數據采用Excel 2010和SPSS 21軟件進行統計分析,利用ANOVA進行單因素方差分析,利用Duncan法進行多重比較(<0.05)。土壤理化性質與固氮群落指標及其功能菌屬spearman相關關系采用R中的“psych”包分析;群落結構差異及環境因子對群落結構影響的主坐標(PCoA)和冗余分析(RDA)由R中的“vegan”包完成;偏最小二乘路徑分析建模(PLS-PM)由R中的“plspm”分析完成。作圖軟件為Microsoft Excel及R中“pheatmap”及“ggplot2”包。
2 結果
2.1 不同秸稈添加量對土壤理化性質及生物固氮的影響
由表1可知,秸稈添加培養后,隨著秸稈添加量增加,土壤pH及NO3--N含量均呈下降趨勢,與C0相比,土壤NO3--N含量顯著下降,土壤的NH4+-N含量各處理之間無顯著差異。利用15N2同化方法對固氮速率定量以衡量固氮酶活性,不同秸稈添加量處理的固氮微生物的固氮速率,相比于不添加秸稈處理(C0),處理C2、C3、C4及C5土壤潛在固氮能力顯著增加(<0.005)。隨著秸稈添加量的增加,C3、C4及C5處理之間固氮速率無顯著性差異,在培養期間(28 d)潛在生物固氮可達到2.71—3.05 μg N·g-1DW,約為0.10—0.11 mg N·kg-1DW·d-1,相比C0固氮速率提高了35.5%—52.5%。
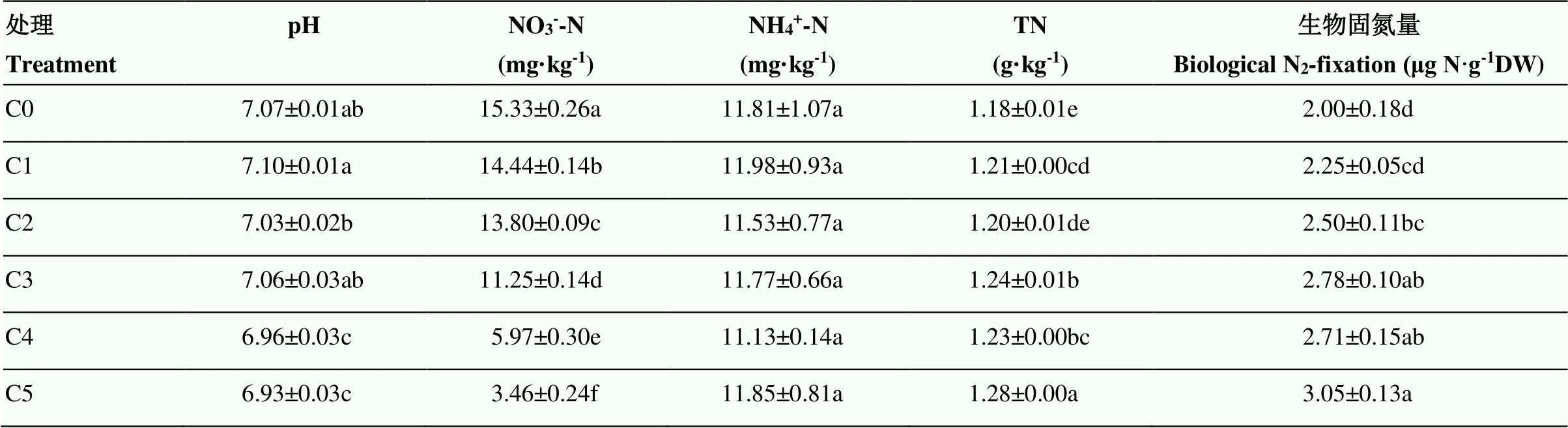
表1 不同處理的土壤理化性質及生物固氮
表格中數據均為平均值±標準誤,n=4;同一列不同字母表示處理之間差異顯著(<0.05)
Data are means±SE, n=4; Means with no letter in common are significantly different among treatments at<0.05 level; 秸稈添加量Straw addition C0: 0, C1: 0.2 mg·g-1, C2: 1.0 mg·g-1, C3: 2.0 mg·g-1, C4: 4.0 mg·g-1, C5: 10.0 mg·g-1
2.2 固氮微生物群落多樣性及群落組成
圖1-A為基于97%相似度的OTU數據,采用加權(Weighted Unifrac)算法分別對不同秸稈添加量的微生物群落結構的主成分分析結果。其中,第一主成分和第二主成分的方差貢獻率分別為10.97%和8.96%,累計方差貢獻率為19.93%;在第一軸上,C0、C1與C4、C5在第一軸上能夠很好地分開,解釋量為10.97%。
圖1-B為15N2處理對應不同秸稈添加量土壤中的固氮微生物基因拷貝數,各處理固氮微生物基因拷貝數為5.48×107—9.20×107copies/(g soil)。其中,相比于C0,C4及C5處理固氮微生物基因拷貝數均顯著提高,顯著提高了固氮微生物數量和活性(<0.05)。當秸稈添加量達到4.0 mg·g-1后,再增加秸稈添加量對土壤固氮微生物基因拷貝數無顯著影響。圖1-C為固氮微生物群落結構香農-威爾指數多樣性分析結果,香農-威爾指數越高,微生物群落多樣性越豐富,反之亦然。其中,C4、C5水平的香農-威爾指數顯著低于其他4個處理(<0.05),其他4個處理多樣性無顯著差異。
圖1-D為不同秸稈添加量下門水平下固氮微生物群落結構相對豐度,不同處理固氮微生物群落組成主要為變形桿菌(Proteobacteria)、藍細菌(Cyanobacteria)、厚壁菌(Firmicutes)、放線菌(Actinobacteria)和螺旋體細菌(Spirochaetes)。隨著秸稈添加量的增加,C2、C3、C4和C5相比C0水平藍細菌的相對豐度顯著增加(<0.05),但當秸稈添加量達到10.0mg·g-1時,其相對豐度反而有所降低。對于變形桿菌,C3和C4水平相較于C0、C1、C5水平其相對豐度顯著減少(<0.05)。對于厚壁菌,C4相較于C0、C1、C2水平的相對豐度下降極為顯著(<0.01),C5水平相對于C0、C1、C2和C3水平其相對豐度下降極為顯著(<0.01)。對于放線菌,C5相較于C0、C1、C2和C3水平顯著減少(<0.05)。對于螺旋體門細菌,C2、C3、C4和C5相較于C0水平下相對豐度顯著增加(<0.05)。
圖1-E為屬水平下不同秸稈添加量下固氮微生物群落結構相對豐度,包含22個優勢功能菌屬(相對豐度大于1%),其中包括多種α-型、β-型、γ-型變形菌(Proteobacteria),以及一種藍細菌,如賀氏偽枝藻屬()。慢生根瘤菌()為最豐富菌屬,隨著秸稈添加量的增加,C5相較于C0、C1、C2、C3水平相對豐度差異顯著(<0.05),顯著增加了12.07%—14.13%。賀氏偽枝藻屬()隨著秸稈添加量的增加其相對豐度逐漸增加,但當秸稈添加量達C5水平其相對豐度反而降低(<0.05)。屬和屬的相對豐度隨著秸稈添加量逐漸增加,但當秸稈添加量達C4和C5水平其相對豐度相較于C3反而顯著降低(<0.05)。隨著秸稈添加量增加,相對豐度成增加趨勢的屬有sp.和屬。此外,中華根瘤菌()和固氮螺菌(),在秸稈添加水平達到C5水平其相對豐度才顯著增加(<0.05)。隨著秸稈添加量的增加,相對豐度呈下降趨勢的屬有弧菌屬()、硫紅螺旋菌屬()、弗蘭克菌屬()、太陽桿菌屬()及屬。
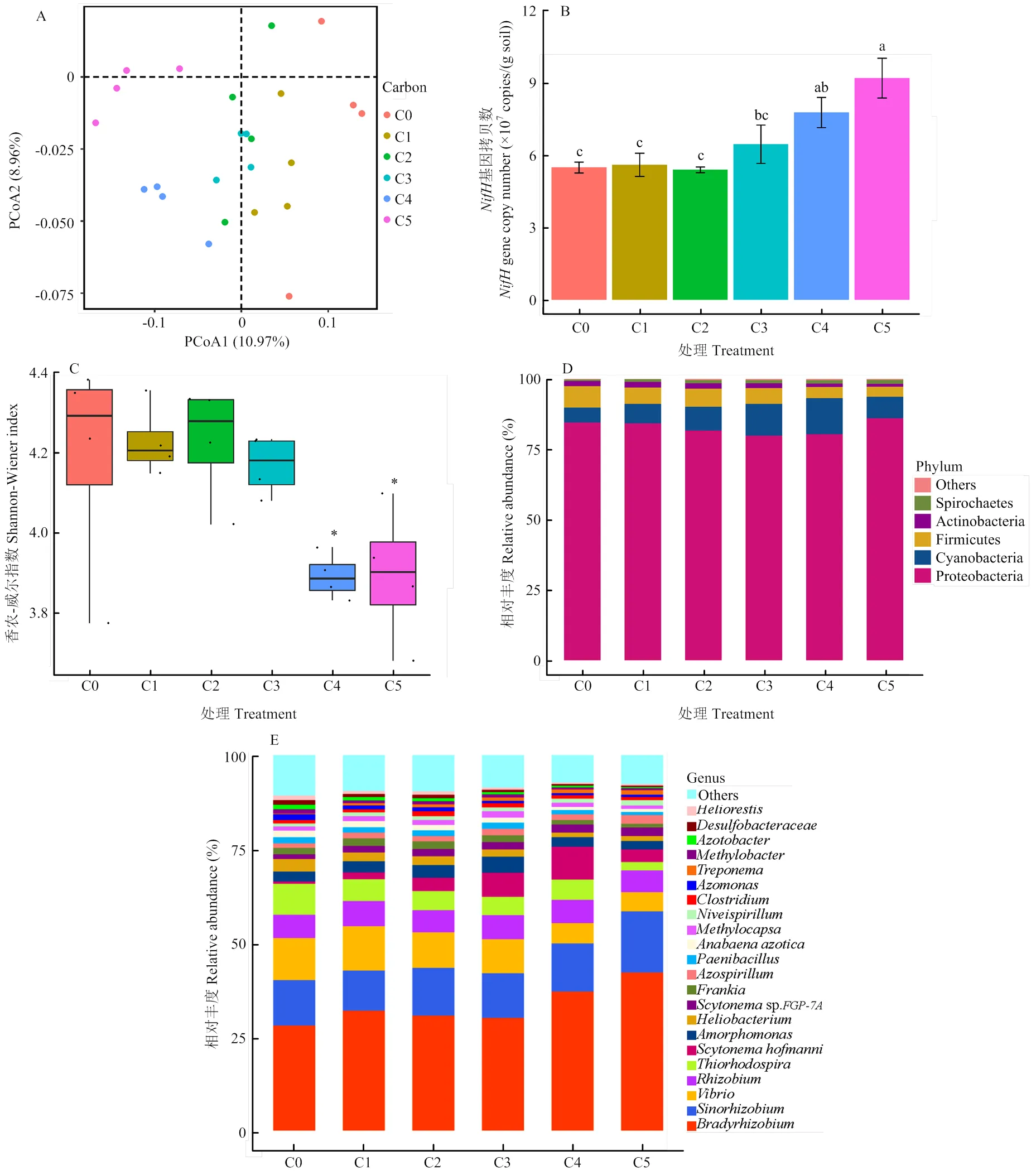
不同字母表示不同秸稈添加量處理差異達到顯著水平(P<0.05),*表示P<0.05
2.3 相關性分析
表2為環境因子與土壤固氮微生物群落的Spearman相關性分析。相關性分析表明,基因拷貝數與秸稈添加量(=0.708,<0.005)呈顯著正相關,但與pH(=-0.623,<0.005)和NO3--N含量(=-0.737,<0.005)呈顯著負相關,其中,NO3--N含量與基因拷貝數相關性最強。固氮速率與秸稈添加(= 0.804,<0.005)和TN(=0.598,<0.005)呈顯著正相關,與NO3--N含量(=-0.828,<0.005)呈顯著負相關,其中,NO3--N含量與固氮速率相關性最強。
圖2-A為群落組成結構同環境因子的冗余分析(RDA)結果表明,所檢測的環境因子對土壤固氮微生物群落結構差異解釋量為35.54%,RDA1和RDA2解釋量分別為28.38%和3.67%,生物固氮量(BNF)及土壤環境因子中的NO3--N含量和pH的影響作用達到顯著。如圖2-B所示,使用PLS-PM方法來研究不同秸稈添加量(straw addition)、培養后土壤pH及有效氮濃度(NO3-、NH4+)、基因豐度(),固氮微生物群落結構(communitystructure PCoA)和生物固氮(BNF)之間的關系。其中,路徑系數表示變量之間線性關系(直接效應)的方向和強度,間接效應為預測變量和響應變量之間路徑系數相乘,潛在變量之間總效應是二者的加和,擬合優度(GoF)表示模型的質量。分析表明,隨著秸稈添加量的增加,秸稈添加與NO3-含量和pH呈顯著負相關,其中,與NO3-含量負相關系數最大(-0.93)。NO3-含量與群落結構顯著正相關(0.65),與基因豐度呈負相關(-0.69),表明秸稈添加后,固氮微生物對土壤NO3-的利用導致了群落結構的顯著變。此外,群落結構與BNF顯著負相關(-0.87),表明在群落結構改變后,對BNF造成顯著影響。盡管pH在秸稈添加后顯著變化且與BNF有著直接的顯著相關性,但與間接效應相抵消后,pH對BNF總效應僅為0.43。通過觀察各變量之間的總效應,可以發現秸稈添加(0.67)、NO3-(-0.89)及微生物群落結構(-0.87)對生物固氮速率影響較大;秸稈添加(-0.85)及NO3-(-0.70)對微生物群落結構影響較大。
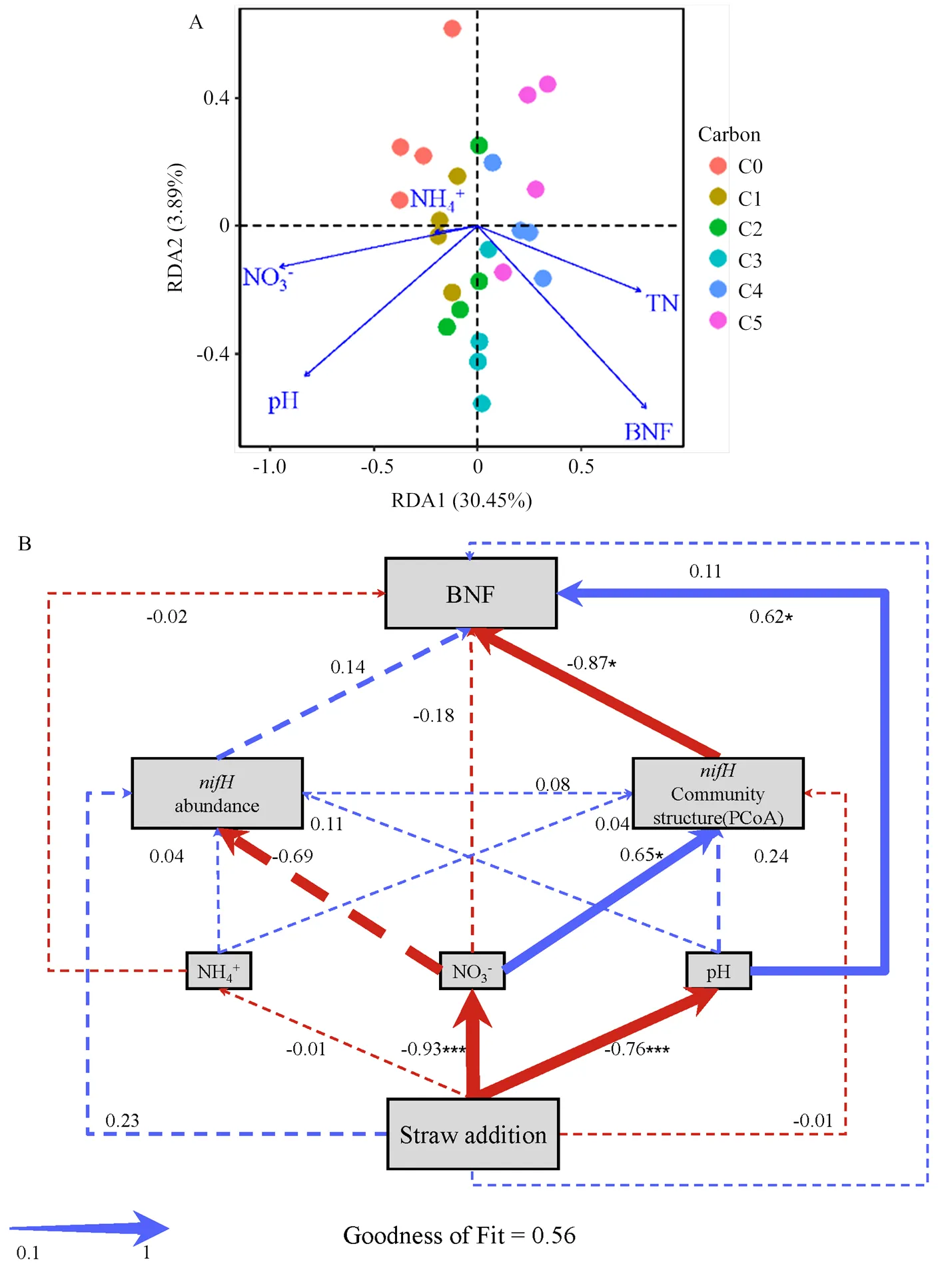
***,**,*分別表示P<0.001,P<0.01,P<0.05。圖3同 ***, **, * mean P<0.001, P<0.01, P<0.05 respectively. The same as Fig.3
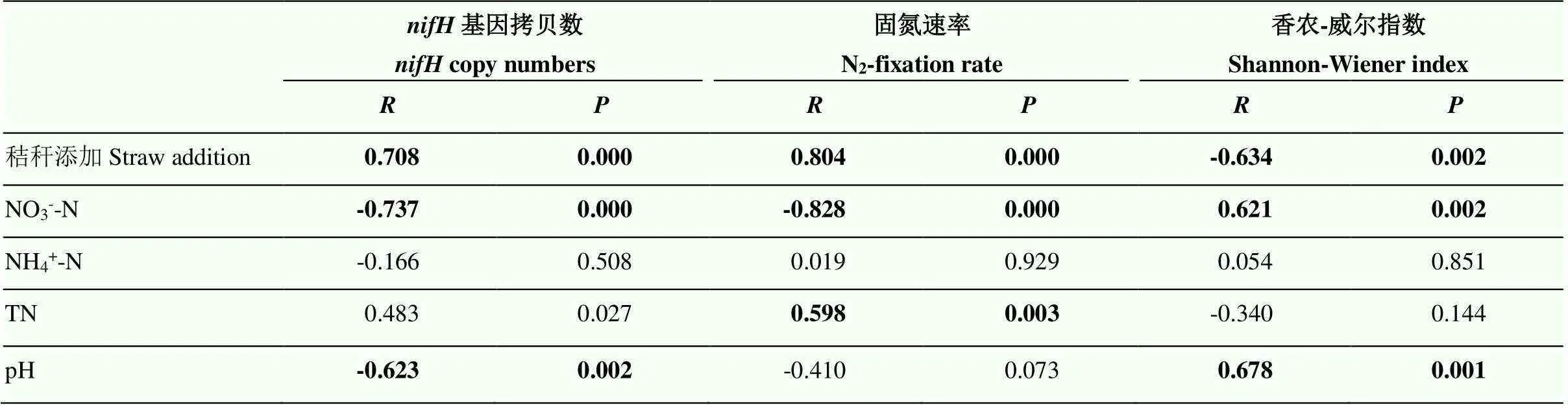
表2 環境因子與土壤固氮微生物豐度、多樣性和固氮速率的相關性分析
粗體數字表示相關性顯著,<0.005
The bold numbers represent significant correlations with<0.005
圖3為固氮微生物優勢功能菌屬與土壤理化性狀及生物固氮速率的Spearman相關性分析。分析表明,屬水平上大多數優勢土壤固氮微生物相對豐度與土壤硝態氮及生物固氮量顯著相關。其中,土壤中的優勢功能菌屬(>1%)、、sp.、和等屬與生物固氮速率呈顯著正相關,此外,等屬也與生物固氮速率呈顯著正相關,但其相對豐度為較低水平;而、、和sp.等屬與生物固氮速率呈顯著負相關。NO3--N對菌屬相對豐度影響與BNF的趨勢相反,且有著較強的相關性,土壤pH的趨勢和NO3--N類似,如和sp.相對豐度與BNF呈顯著正相關,而與NO3--N和pH呈顯著負相關。
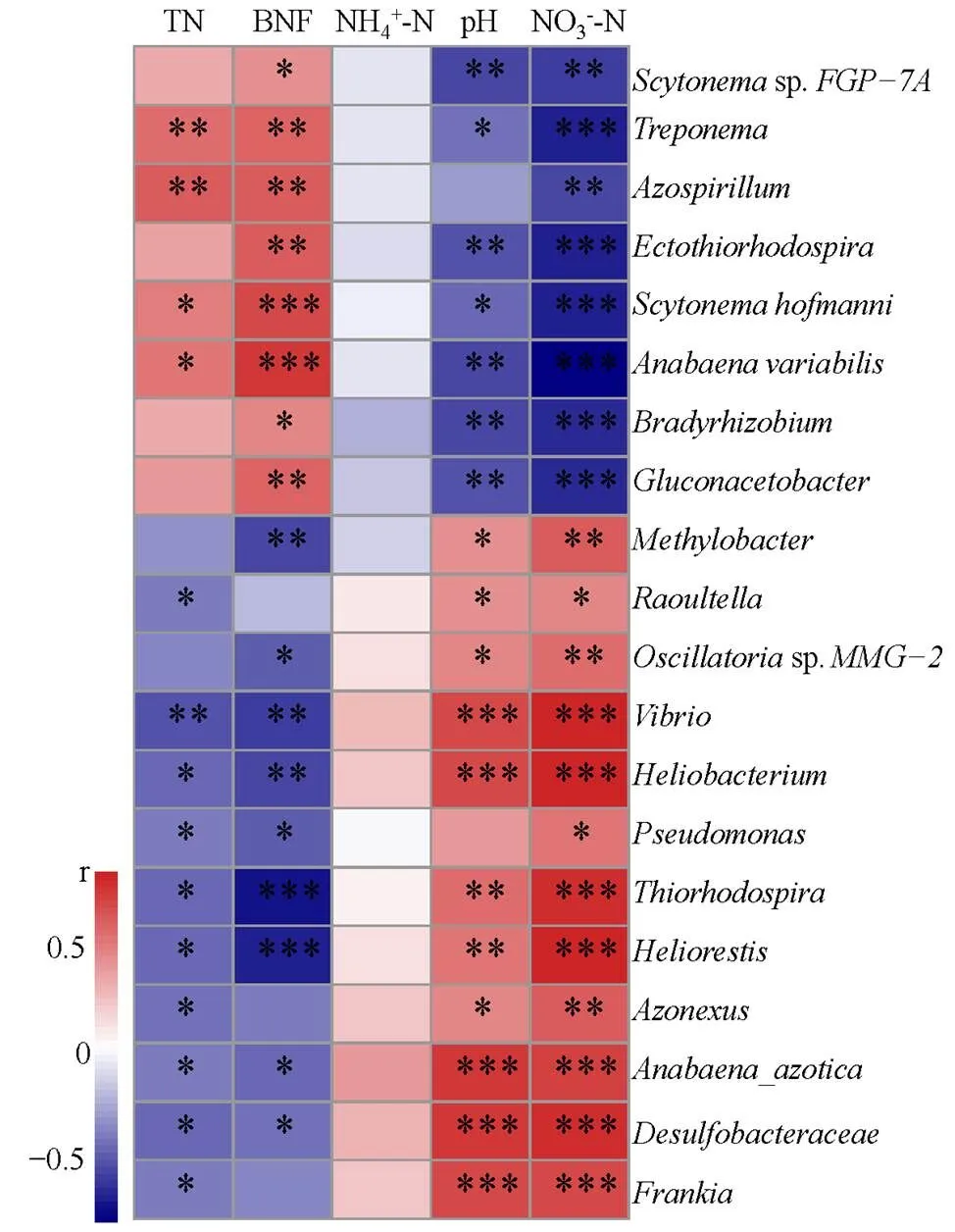
圖3 土壤固氮微生物功能菌屬與土壤理化性狀及固氮速率的Spearman相關性分析
3 討論
許多研究表明,秸稈添加后補充的大量有機碳源和能量會導致土壤中微生物群落利用無機態氮,提高土壤中細菌和非共生固氮微生物的數量和活性[10-11],從而促進生物固氮[12-13]。有機物料添加有利于促進基因豐度及固氮功能的維持[43-45],但其對固氮微生物的影響可能也與有機物料的數量有關[46]。在本研究中,與C0相比,除C1(0.2 mg·g-1)處理固氮速率增加不顯著外,其余處理固氮速率均顯著提高,但隨著秸稈添加量增加到C3(2.0 mg·g-1)水平后,固氮速率不再顯著增加。秸稈中含有纖維素和半纖維素,土壤中只有少數幾種固氮微生物()能夠直接利用秸稈進行固氮[47],大多數固氮微生物依賴于其他微生物將其分解為較小的產物。過量秸稈的添加并不代表其滿足微生物生長所需的可利用碳源,進而導致固氮速率不再顯著增加。相關性分析表明固氮速率與NO3--N含量呈顯著負相關(表2),與秸稈添加量呈顯著正相關。此外,固氮速率與TN含量呈顯著正相關可能歸因于秸稈添加輸入的大量有機氮源。
碳源的數量是導致微生物群落競爭的重要因子,很大程度上決定了微生物活性和群落結構組成[48]。本研究中,當秸稈添加量達到C4水平后,增加秸稈添加量對基因豐度無顯著影響(圖1-B)。相關性分析表明,基因豐度與秸稈添加量呈顯著正相關,與NO3--N含量呈顯著負相關(<0.001)。以往的研究發現固氮速率顯示出對固氮微生物多樣性增加的飽和趨勢[15]。在本研究中也發現了類似的趨勢,當秸稈添加量達到C3水平后,香農-威爾指數顯著下降,表明隨著秸稈的過量添加,碳源可利用性的限制導致了固氮微生物的群落競爭,群落多樣性顯著下降。
以往的研究表明參與玉米秸稈分解的微生物主要包括變形桿菌、厚壁菌及放線菌,如、和等[35]。、及Cyanobacteria是土壤中較為常見的固氮微生物[38]。在本研究中,固氮微生物主要包含多種α-型、β-型、γ-型變形菌(Proteobacteria),以及藍細菌(Cyanobacteria)。在屬水平上主要由、、、、和等屬組成。其中,可參與秸稈分解且為最豐富菌屬,不僅可與豆科植物共生固氮,作為根際細菌也可促進非豆科植物生長[49],隨著秸稈添加量的增加,其相對豐度顯著增加了12.07%—14.13%(圖1-E)。、和等屬的相對豐度隨著秸稈添加量逐漸增加,但當秸稈添加量一定水平后其相對豐度反而顯著降低(<0.05)。隨著秸稈添加量的增加,、、和等屬相對豐度呈下降趨勢。作為優勢菌屬,與生物固氮速率呈顯著正相關(<0.05),但其與固氮速率的相關性不如,這可能與其作為兼性固氮菌,會優先支持自身營養生長而不是用于固氮有關;同時,秸稈添加有增加相對豐度的趨勢,其與生物固氮速率呈顯著正相關(<0.01),進一步表明碳源的數量對固氮微生物群落結構的影響。此外,sp.、和等屬與BNF均呈顯著正相關。上述結果表明,碳源的數量是影響土壤固氮微生物群落特征的關鍵因素。
除了上述分析,本研究還采用了PLS-PM分析和RDA分析方法,結果均表明土壤固氮微生物群落結構的差異與NO3--N含量緊密相關。之前的研究表明,當銨態氮含量較低的情況下投入有機物料,硝態氮的利用更加顯著,進而導致土壤NO3--N含量下降[50]。結合Spearman相關性分析結果,說明隨著秸稈量的增加,導致土壤中硝態氮的降低,與生物固氮速率呈顯著正相關且與硝態氮呈顯著負相關的功能菌屬諸如和sp.等菌屬的相對豐度顯著增加,從而促進了固氮微生物對N2的固定。固氮微生物群落多樣性在秸稈添加量達到C3水平后顯著下降(圖1-C),生物固氮速率在秸稈添加量達到C3水平后無顯著差異(表1),雖然表明碳源可利用性對生物固氮的制約,但添加秸稈后在培養期間(28 d)潛在固氮總量可達到2.71—3.05 μg N·g-1DW,約為0.10—0.11 mg N·kg-1DW·d-1,相比C0固氮速率提高了35.5%—52.5%。以上結果說明了適量添加秸稈后可顯著提高生物固氮潛力并改變固氮菌群落結構特征。
據統計,2011年,我國通過秸稈還田投入有機碳儲量平均為0.89 Mg C·hm-2 [51],秸稈資源對促進生物固氮潛力有十分積極的意義。本研究表明,C0處理固氮速率為0.07 mg N·kg-1DW·d-1,若以平均土壤容重1.2 g·cm-3來計算,固氮速率約為63 kg N·hm-2·a-1;C3、C4和C5處理固氮速率約為87—96 kg N·hm-2·a-1。與以往研究不同的是,本研究通過15N2方法進行定量,肯定了非共生固氮在水分和溫度適宜的條件下對氮素投入的重要作用;土壤固氮微生物多樣性在秸稈添加量達到C3(2.0 mg·g-1)水平后顯著下降,與固氮速率顯著正相關的部分優勢功能菌屬相對豐度在秸稈添加量達到C4(4.0 mg·g-1)水平后顯著下降。為盡可能提高土壤生物固氮潛力,綜合考慮固氮微生物多樣性、基因拷貝數及生物固氮速率等條件,在本研究基礎上得出最佳秸稈添加水平應為4.0 mg·g-1,其潛在固氮總量約為87 kg N·hm-2·a-1,相比對照提高了38.1%。本研究結果進一步表明,土壤固氮微生物多樣性及群落結構對碳源數量具有明顯響應,可明顯提高土壤固氮潛力,對秸稈還田數量調節土壤固氮微生物群落結構及促進生物固氮具有重要指導意義。然而,由于固氮微生物對環境變化十分敏感,田間條件下秸稈還田對固氮微生物群落及生物固氮的調控作用尚需進一步研究。
4 結論
不同秸稈添加量對土壤固氮菌群落特征具有明顯影響,添加秸稈后,土壤固氮微生物基因拷貝數呈增加趨勢,土壤固氮微生物多樣性在秸稈添加量達到2.0 mg·g-1后顯著下降,與固氮速率顯著正相關的部分優勢功能菌屬相對豐度在秸稈添加量達到4.0 mg·g-1后顯著下降。相比于不添加秸稈,添加秸稈4.0 mg·g-1后,可增加土壤生物固氮速率約為26 kg N·hm-2·a-1。固氮微生物群落結構因秸稈添加量不同而聚集為不同組別。因此,秸稈添加對固氮微生物多樣性和群落結構的調控作用主要受碳源的數量影響。此外,固氮微生物群落結構及優勢功能菌屬相對豐度與固氮速率及NO3--N含量緊密相關,表明秸稈添加后因其較高的C/N比,使得固氮微生物增加對無機態氮(NO3--N)的利用,顯著提高固氮微生物的數量和活性,從而促進生物固氮。此外,秸稈添加后造成土壤NO3--N含量的差異可能是驅動土壤固氮微生物群落組成的重要環境因子。
[1] VITOUSEK P M,MENGE D N, REED S C, CLEVELAND C C. Biological nitrogen fixation: rates, patterns and ecological controls in terrestrial ecosystems. Philosophical Transactions of the Royal Society B: Biological Sciences, 2013, 368(1621): 20130119.
[2] CLEVELAND C C, TOWNSEND A R, SCHIMEL D S, FISHER H, HOWARTH R W, HEDIN L O, PERAKIS S S, LATTY E F, VON FISCHER J C, ELSEROAD A, WASSON M F. Global patterns of terrestrial biological nitrogen (N2) fixation in natural ecosystems. Global Biogeochemical Cycles, 1999, 13(2): 623-645.
[3] GALLOWAY J N, TOWNSEND A R, ERISMAN J W, BEKUNDA M, CAI Z, FRENEY J R, MARTINELLI L A, SEITZINGER S P, SUTTON M A. Transformation of the nitrogen cycle: recent trends, questions, and potential solutions. Science, 2008, 320(5878): 889-892.
[4] HERRIDGE D F, PEOPLES M B, BODDEY R M. Global inputs of biological nitrogen fixation in agricultural systems. Plant and Soil, 2008, 311(1/2): 1-18.
[5] LADHA J K, TIROL-PADRE A, REDDY C K, CASSMAN K G, VERMA S, POWLSON D S, VAN KESSEL C, DE B R D, CHAKRABORTY D, PATHAK H. Global nitrogen budgets in cereals: A 50-year assessment for maize, rice, and wheat production systems. Scientific Reports, 2016, 6(1): 1-9.
[6] ROPER M M, GUPTA V V S R. Enhancing non-symbiotic N2fixation in agriculture. The Open Agriculture Journal, 2016, 10(1): 7-27.
[7] GOOD A G, BEATTY P H. Fertilizing nature: a tragedy of excess in the commons. PLoS Biology, 2011, 9(8): e1001124.
[8] ZENG J, LIU X J, SONG L, LIN X G, ZHANG H Y, SHEN C C, CHU H Y. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition. Soil Biology & Biochemistry, 2016, 92: 41-49.
[9] BEATTY P H, GOOD A G. Plant science. Future prospects for cereals that fix nitrogen. Science, 2011, 333(6041): 416-417.
[10] 楊濱娟, 黃國勤, 錢海燕. 秸稈還田配施化肥對土壤溫度、根際微生物及酶活性的影響. 土壤學報, 2014, 51(1): 150-157.
YANG B J, HUANG G Q, QIAN H Y. Effects of straw incorporation plus chemical fertilizer on soil temperature, root micro-organisms and enzyme activities. Acta Pedologica Sinica, 2014, 51(1): 150-157. (in Chinese)
[11] GUPTA V V S R, ROPER M M, ROGET D K. Potential for non-symbiotic N2-fixation in different agroecological zones of southern Australia. Soil Research, 2006, 44(4): 343-354.
[12] 趙亞麗, 郭海斌, 薛志偉, 穆心愿, 李潮海. 耕作方式與秸稈還田對土壤微生物數量、酶活性及作物產量的影響. 應用生態學報, 2015, 26(6): 1785-1792.
ZHAO Y L, GUO H B, XUE Z W, MU X Y, LI C H. Effects of tillage and straw returning on microorganism quantity,enzyme activities in soils and grain yield. Chinese Journal of Applied Ecology, 2015, 26(6): 1785-1792. (in Chinese)
[13] 潘劍玲, 代萬安, 尚占環, 郭瑞英. 秸稈還田對土壤有機質和氮素有效性影響及機制研究進展. 中國生態農業學報, 2013, 21(5): 526-535.
PAN J L, DAI W A, SHANG Z H, GUO R Y. Review of research progress on the influence and mechanism of field straw residue incorporation on soil organic matter and nitrogen availability. Chinese Journal of Eco-Agriculture, 2013, 21(5): 526-535. (in Chinese)
[14] NELSON D R, MELE P M. The impact of crop residue amendments and lime on microbial community structure and nitrogen-fixing bacteria in the wheat rhizosphere. Soil Research, 2006, 44(4): 319-329.
[15] HSU S F, BUCKLEY D H. Evidence for the functional significance of diazotroph community structure in soil. The ISME Journal, 2009, 3(1): 124-136.
[16] TENG Q, SUN B, FU X, LI S, CUI Z, CAO H. Analysis of nifH gene diversity in red soil amended with manure in Jiangxi, South China. The Journal of Microbiology, 2009, 47(2): 135-141.
[17] LINDSAY E A, COLLOFF M J, GIBB N L, WAKELIN S A. The abundance of microbial functional genes in grassy woodlands is influenced more by soil nutrient enrichment than by recent weed invasion or livestock exclusion. Applied and Environmental Microbiology, 2010, 76(16): 5547-5555.
[18] REED S C, CLEVELAND C C, TOWNSEND A R. Functional ecology of free-living nitrogen fixation: A contemporary perspective. Annual Review of Ecology, Evolution, and Systematics, 2011, 42(1): 489-512.
[19] REED S C, TOWNSEND A R, CLEVELAND C C, NEMERGUT D R. Microbial community shifts influence patterns in tropical forest nitrogen fixation. Oecologia, 2010, 164(2): 521-531.
[20] WAKELIN S A, GUPTA V V S R, FORRESTER S T. Regional and local factors affecting diversity, abundance and activity of free-living, N2-fixing bacteria in Australian agricultural soils. Pedobiologia, 2010, 53(6): 391-399.
[21] ROPER M. Field measurements of nitrogenase activity in soils amended with wheat straw. Australian Journal of Agricultural Research, 1983, 34(6): 725-739.
[22] PéREZ C A, CARMONA M R, ARMESTO J J. Non-symbiotic nitrogen fixation during leaf litter decomposition in an old-growth temperate rain forest of Chiloé Island, southern Chile: Effects of singleversusmixed species litter. Austral Ecology, 2010, 35(2): 148-156.
[23] CUSACK D F, SILVER W, MCDOWELL W H. Biological nitrogen fixation in two tropical forests: ecosystem-level patterns and effects of nitrogen fertilization. Ecosystems, 2009, 12(8): 1299-1315.
[24] WAKELIN S A, COLLOFF M J, HARVEY P R, MARSCHNER P, GREGG A L, ROGERS S L. The effects of stubble retention and nitrogen application on soil microbial community structure and functional gene abundance under irrigated maize. FEMS Microbiology Ecology, 2007, 59(3): 661-670.
[25] FORBES M, BROOS K, BALDOCK J, GREGG A, WAKELIN S. Environmental and edaphic drivers of bacterial communities involved in soil N-cycling. Soil Research, 2009, 47(4): 380-388.
[26] POLY F, RANJARD L, NAZARET S, GOURBIERE F, MONROZIER L J. Comparison ofgene pools in soils and soil microenvironments with contrasting properties. Applied and Environmental Microbiology, 2001, 67(5): 2255-2262.
[27] TANAKA H, KYAW K M, TOYOTA K, MOTOBAYASHI T. Influence of application of rice straw, farmyard manure, and municipal biowastes on nitrogen fixation, soil microbial biomass N, and mineral N in a model paddy microcosm. Biology and Fertility of Soils, 2005, 42(6): 501-505.
[28] ROPER M M, SMITH N A. Straw decomposition and nitrogenase activity (C2H2reduction) by free-living microorganisms from soil: Effects of pH and clay content. Soil Biology and Biochemistry, 1991, 23(3): 275-283.
[29] KEELING A A, COOK J A, WILCOX A. Effects of carbohydrate application on diazotroph populations and nitrogen availability in grass swards established in garden waste compost. Bioresource Technology, 1998, 66(2): 89-97.
[30] ROPER M M, TURPIN J E, THOMPSON J P. Nitrogenase activity (C2H2reduction) by free-living bacteria in soil in a long-term tillage and stubble management experiment on a vertisol. Soil Biology and Biochemistry, 1994, 26(8): 1087-1091.
[31] UNKOVICH M, BALDOCK J. Measurement of asymbiotic N2fixation in Australian agriculture. Soil Biology and Biochemistry, 2008, 40(12): 2915-2921.
[32] KEUTER A, VELDKAMP E, CORRE M D. Asymbiotic biological nitrogen fixation in a temperate grassland as affected by management practices. Soil Biology and Biochemistry, 2014, 70: 38-46.
[33] CHALK P M, HE J Z, PEOPLES M B, CHEN D.15N2as a tracer of biological N2fixation: A 75-year retrospective. Soil Biology and Biochemistry, 2017, 106: 36-50.
[34] GABY J C, BUCKLEY D H. A comprehensive evaluation of PCR primers to amplify thegene of nitrogenase. PLoS One, 2012, 7(7): e42149.
[35] FAN F, YIN C, TANG Y, LI Z, SONG A, WAKELIN S A, ZOU J, LIANG Y. Probing potential microbial coupling of carbon and nitrogen cycling during decomposition of maize residue by13C-DNA- SIP. Soil Biology and Biochemistry, 2014, 70: 12-21.
[36] DABUNDO R, LEHMANN M F, TREIBERGS L, TOBIAS C R, ALTABET M A, MOISANDER P H, GRANGER J. The contamination of commercial15N2gas stocks with15N-labeled nitrate and ammonium and consequences for nitrogen fixation measurements. PLoS One, 2014, 9(10): e110335.
[37] OHYAMA T, KUMAZAWA K. A simple method for the preparation, purification and storage of15N2gas for biological nitrogen fixation studies. Soil Science and Plant Nutrition, 1981, 27(2): 263-265.
[38] GABY J C, RISHISHWAR L, VALDERRAMA-AGUIRRE L C, GREEN S J, VALDERRAMA-AGUIRRE A, JORDAN I K, KOSTKA J E. Diazotroph community characterization via a high-throughput nifH amplicon sequencing and analysis pipeline. Applied and Environmental Microbiology, 2018, 84(4): e01512-17.
[39] HERBOLD C W, PELIKAN C, KUZYK O, HAUSMANN B, ANGEL R, BERRY D, LOY A. A flexible and economical barcoding approach for highly multiplexed amplicon sequencing of diverse target genes. Frontiers in Microbiology, 2015, 6: 731.
[40] VAITOMAA J, RANTALA A, HALINEN K, ROUHIAINEN L, TALLBERG P, MOKELKE L, SIVONEN K. Quantitative real-time PCR for determination of microcystin synthetase e copy numbers for microcystis and anabaena in lakes. Applied and Environmental Microbiology, 2003, 69(12): 7289-7297.
[41] 茍永剛, 余玲玲, 許霞, 王建武. DNA-SIP鑒定甘蔗//大豆間作土壤15N-DNA富集位置的氮循環功能基因qPCR方法. 農業環境科學學報, 2019, 38(1): 140-147.
GOU Y G, XU L L, XU X, WANG J W. Identification of15N-DNA enrichment sites in DNA-SIP to reveal functional genes by qPCR from sugarcanesoybean intercropping soil. Journal of Agro?Environment Science, 2019, 38(1): 140-147. (in Chinese)
[42] GABY J C, BUCKLEY D H. A comprehensive aligned nifH gene database: a multipurpose tool for studies of nitrogen-fixing bacteria. Database, 2014, 2014: bau001. https://doi.org/10.1093/database/bau001.
[43] WAKELIN S A, GREGG A L, SIMPSON R J, LI G D, RILEY I T, MCKAY A C. Pasture management clearly affects soil microbial community structure and N-cycling bacteria. Pedobiologia, 2009, 52(4): 237-251.
[44] TANG Y, ZHANG M, CHEN A, ZHANG W, WEI W, SHENG R. Impact of fertilization regimes on diazotroph community compositions and N2-fixation activity in paddy soil. Agriculture, Ecosystems & Environment, 2017, 247: 1-8.
[45] LIAO H, LI Y, YAO H. Fertilization with inorganic and organic nutrients changes diazotroph community composition and N-fixation rates. Journal of Soils and Sediments, 2017, 18(3): 1076-1086.
[46] SCHUTTER M, DICK R. Shifts in substrate utilization potential and structure of soil microbial communities in response to carbon substrates. Soil Biology and Biochemistry, 2001, 33(11): 1481-1491.
[47] HALSALL D M, TURNER G L, GIBSON A H. Straw and xylan utilization by pure cultures of nitrogen-fixingspp. Applied and Environmental Microbiology, 1985, 49(2): 423-428.
[48] BRANT J B, SULZMAN E W, MYROLD D D. Microbial community utilization of added carbon substrates in response to long-term carbon input manipulation. Soil Biology and Biochemistry, 2006, 38(8): 2219-2232.
[49] ANTOUN H, BEAUCHAMP C J, GOUSSARD N, CHABOT R, LALANDE R. Potential of rhizobium and bradyrhizobium species as plant growth promoting rhizobacteria on non-legumes: effect on radishes (L.). Molecular Microbial Mcology of the Soil,1998, 204: 57-67.
[50] BURGER M, JACKSON L E. Microbial immobilization of ammonium and nitrate in relation to ammonification and nitrification rates in organic and conventional cropping systems. Soil Biology and Biochemistry, 2003, 35(1): 29-36.
[51] ZHAO Y, WANG M, HU S, ZHANG X, OUYANG Z, ZHANG G, HUANG B, ZHAO S, WU J, XIE D, ZHU B, YU D, PAN X, XU S, SHI X. Economics- and policy-driven organic carbon input enhancement dominates soil organic carbon accumulation in Chinese croplands. Proceedings of the National Academy of Sciences of the USA, 2018, 115(16): 4045-4050.
Effects of Straw Addition on Soil Biological N2-Fixation Rate and Diazotroph Community Properties
LI Xu, DONG WeiLing, SONG ALin, LI YanLing, LU YuQiu, WANG EnZhao, LIU XiongDuo, WANG Meng, FAN FenLiang
Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences/Key Laboratory of Plant Nutrition and Fertilizer, Ministry of Agriculture and Rural Affairs, Beijing 100081
【】The purpose of this study was to analyze the effects of different straw additions on soil N2-fixation rate and diazotroph community structure, which was crucial for the management of crop residue and mineral fertilizer application in China.【】Using indoor incubation experiment, in addition to the control (C0: 0), a total of 5 straw addition gradients (C1: 0.2 mg·g-1; C2: 1.0 mg·g-1; C3: 2.0 mg·g-1; C4: 4.0 mg·g-1; C5: 10.0 mg·g-1), using the15N2labeling method, and soil samples were collected after 28 days of incubation in dark conditions. As a direct measure of N2-fixation,15N2gas labeling method could quantify the rate of biological N2-fixation, and destined for characterization ofgene marker and diazotroph community by using the Illumina PE250 sequencing and PCR techniques. 【】With the increase of straw addition, the content of NO3--N in soil decreased significantly, while the content of NH4+-N did not change significantly. The pH of soil decreased and the rate of biological N2-fixation increased significantly. C3, C4 and C5 treatments could reach 2.71-3.05 μg N·g-1DW during the incubation period (28 d), which was about 87-96 kg N·hm-2·a-1, compared with C0, the rate of biological N2-fixation increased by 38.1%-52.4%. The copy number ofgene ranged from 5.48×107to 9.20×107copies/(g soil) under all treatments. Compared with C0, the copy number ofgene was significantly increased under C4 and C5 treatments, and the number and activity of diazotroph were significantly increased (<0.05). However, when the amount of straw added reached 4.0 mg·g-1, increasing the amount of straw had no significant effect on the copy number ofgene of soil diazotroph. With the increase of straw addition, Shannon-Weill index of C4 and C5 levels was significantly lower than that of the other four treatments (<0.05), and the diversity of the other four treatments had no significant difference. The result of PCoA showed that diazotroph community structure was clustered into different groups depending upon the difference of straw addition. Diazotroph were divided into Proteobacteria,Cyanobacteria, Firmicutes, Actinobacteria and Spirochaetesat the phylum level. As the amount of straw added increases, the relative abundance oftends to increase first and then decrease. At the genus level, there were significant differences in the number of carbon sources among different species.was the most abundant genus. With the increase of straw addition, the relative abundance of C5 was significantly different from that of C0, C1, C2 and C3 (<0.05), increasing by 12.07%-14.13%. The relative abundance of, which was positively correlated with the rate of biological N2-fixation, gradually increases with the increase of straw addition, but decreased when straw addition reaches C5 level (<0.05). Meanwhile, PLS-PM analysis, RDA and correlation analysis revealed that the rate of biological N2-fixation and soil diazotroph community were greatly affected by straw addition and soil NO3--N concentration. 【】The rate of soil biological N2-fixation increases with the amount of straw added. The effect of straw on N2-fixation was mainly due to the reduction of NO3--N content in the soil by straw addition, which in turn promoted the diazotroph such as,andgrow. According to the calculation results of this experiment, compared with no straw, after the straw was added (4.0 mg·g-1), the rate of biological N2-fixation could be increased by 26 kg N·hm-2·a-1, which significantly reduced the fertilizer demand.
soil diazotroph; straw returning; the rate of biological N2-fixation;15N2labeling method;

10.3864/j.issn.0578-1752.2021.05.010
2020-06-21;
2020-12-16
國家重點研發計劃(2016YFD0800707,2016YFD0200109)、國家自然科學基金(41571297)、中央級公益性科研院所基本科研業務費專項(1610132019011,1610132019021)
李旭,E-mail:82101185083@caas.cn。通信作者范分良,E-mail:fanfenliang@caas.cn
(責任編輯 李云霞)

