2017-2019年四川地區(qū)豬A群輪狀病毒的分子流行病學(xué)調(diào)查
周群,陳小飛,闞蕊慈,李玉,曹慧,彭艷伶,張斌,4
2017-2019年四川地區(qū)豬A群輪狀病毒的分子流行病學(xué)調(diào)查
1西南民族大學(xué)生命科學(xué)與技術(shù)學(xué)院,成都 610041;2華南農(nóng)業(yè)大學(xué)獸醫(yī)學(xué)院,廣州 510642;3西昌市畜牧局,四川西昌 615000;4青藏高原動(dòng)物遺傳資源保護(hù)與利用教育部/四川省重點(diǎn)實(shí)驗(yàn)室,成都 610041
【】通過對(duì)四川地區(qū)規(guī)模化豬場(chǎng)A群輪狀病毒(RVA)的分子檢測(cè),從而了解RVA流行情況及分子特征,為豬RVA疫苗研制提供理論基礎(chǔ)。2017—2019年從四川省14個(gè)地區(qū)40個(gè)豬場(chǎng)采集303份仔豬腹瀉樣本,用熒光定量RT-PCR方法調(diào)查RVA的分子流行率,用RT-PCR方法對(duì)RVA陽性樣本進(jìn)行分型和VP4和VP7全基因組的擴(kuò)增,用RotaC2.0軟件確定相應(yīng)毒株的基因型,用MegAlign軟件進(jìn)行同源性分析,通過MEGA 7.0軟件用鄰近法構(gòu)建系統(tǒng)進(jìn)化樹,用SimPlot和RDP4軟件進(jìn)行重組分析。303份仔豬腹瀉樣本檢出RVA陽性樣本98份,陽性率為32.34%(98/303,95%CI=27.1%—37.9%)。從98份RVA陽性樣本中擴(kuò)增出39個(gè)VP7片段,G9為優(yōu)勢(shì)基因型(41%),G4、G5、G26和G3各占23%、28.2%、5.1%和2.7%。擴(kuò)增出的59個(gè)P型中以P[13]型為主,占40.7%,其次為P[6]、P[23]和P[1]型,分別占30.5%、23.7%和5.1%。30株毒株成功鑒定出G/P基因型,G9P[23](23.3%)為優(yōu)勢(shì)組合基因型。其他基因型為G4P[6](16.7%)、G9P[13](13.3%)、G5P[23](10%)、G5P[13](10%)、G9P[6](6.7%)、G26P[13](6.7%)、G4P[13](6.7%)、G4P[23](3.3%)和G3P[13](3.3%)。基因型G5P[23]、G4P[13]、G9P[6]、G26P[13]和G4P[23]為國(guó)內(nèi)首次鑒定。此外,重組分析表明4株毒株在VP7或VP4基因上存在重組現(xiàn)象。四川地區(qū)腹瀉仔豬糞便中RVA的流行率高且基因型復(fù)雜,優(yōu)勢(shì)組合基因型為G9P[23]。該結(jié)果豐富了四川地區(qū)RVA的流行病學(xué)資料,對(duì)四川地區(qū)豬RVA的防控提供了重要參考。
豬A群輪狀病毒;分子流行病學(xué);基因組研究;重組
0 引言
【研究意義】A群輪狀病毒(rotavirus A, RVA)為呼腸孤病毒科輪狀病毒屬成員,是引起嬰幼兒及其他多種幼齡動(dòng)物病毒性腹瀉的主要病原體之一[1]。RVA基因組分為11個(gè)基因節(jié)段,分別編碼6種結(jié)構(gòu)蛋白(VP1—VP4,VP6和VP7)和5或6種非結(jié)構(gòu)蛋白(NSP1—NSP5/6),RVA的11個(gè)基因之間均易發(fā)生重配事件[2]。根據(jù)VP6蛋白的抗原性可將RV分類為10個(gè)血清群(A—J)[3-4],A—C、E和H群RV已經(jīng)被證實(shí)可感染豬,其中感染人類和動(dòng)物最常見的為A群輪狀病毒[5-6]。RVA感染仔豬呈世界流行,各國(guó)豬場(chǎng)中RVA的陽性率為3.3%—67.3%,對(duì)世界養(yǎng)豬業(yè)產(chǎn)生了嚴(yán)重的經(jīng)濟(jì)損失[7]。研究表明豬RVA是人源RVA感染的潛在來源[8-11],因此了解豬RVA的流行情況和分子特征對(duì)RVA的防控以及防止豬RVA傳播給人類至關(guān)重要。【前人研究進(jìn)展】VP4和VP7蛋白共同組成RVA的外衣殼,二者都是重要的中和抗原,可以誘導(dǎo)機(jī)體產(chǎn)生中和抗體[12]。結(jié)構(gòu)蛋白VP4和VP7分別決定RVA的P型和G型,且G型和P型之間會(huì)產(chǎn)生多種組合,不同組合的血清型之間交叉保護(hù)性低[2]。在豬RVA中,已經(jīng)鑒定出了12個(gè)G型(G1—G6,G8—G12和G26)和16個(gè)P型(P[1]—P[8],P[13],P[19],P[23],P[26],P[27],P[28],P[32],P[34]),其中G3、G4、G5、G9和G11被認(rèn)為是最常見的G型,通常與P[5]、P[6]、P[7]、P[13]和P[28]組合在一起[13-15]。國(guó)內(nèi)的病原學(xué)檢測(cè)結(jié)果顯示RVA在我國(guó)規(guī)模化豬場(chǎng)中普遍存在,仔豬腹瀉糞便中RVA的陽性率為7.69%—28.76%[16-19]。近年來中國(guó)大陸陸續(xù)報(bào)道了G11P[13]、G9P[23]和G9P[7]等組合基因型的RVA[20-22],然而四川地區(qū)RVA的流行情況及遺傳多樣性資料相對(duì)匱乏。【本研究切入點(diǎn)】2017—2019年分別從四川省14個(gè)地區(qū)40個(gè)豬場(chǎng)采集腹瀉樣本303份,對(duì)其進(jìn)行RVA檢測(cè)及基因型的鑒定,以期了解四川地區(qū)豬群中RVA的感染情況和流行趨勢(shì)。【擬解決的關(guān)鍵問題】為研究四川地區(qū)豬RVA的遺傳進(jìn)化特征提供基礎(chǔ)研究資料,預(yù)測(cè)四川地區(qū)豬RVA的流行趨勢(shì),從而為豬RVA疫苗的研制提供理論基礎(chǔ)。
1 材料與方法
試驗(yàn)于2018年3月至2019年12月在西南民族大學(xué)生命科學(xué)與技術(shù)學(xué)院動(dòng)物醫(yī)學(xué)實(shí)驗(yàn)室進(jìn)行。
1.1 材料
1.1.1 病料采集 對(duì)四川省不同地區(qū)、不同時(shí)間和不同豬群的腹瀉樣本進(jìn)行主動(dòng)采集,2017—2019年采集了四川省綿陽、瀘州、眉山和西昌等14個(gè)地區(qū)40個(gè)豬場(chǎng)共303份仔豬腹瀉樣本,發(fā)病豬均表現(xiàn)為產(chǎn)房哺乳仔豬腹瀉、消瘦,腹瀉病死率為35%—85%。樣本置于-80℃冰箱保存?zhèn)溆谩?/p>
1.1.2 主要試劑與儀器 Trizol試劑(RNAiso Plus)、PrimeScriptTMRT試劑盒、pMD19-T Vector、MarkerⅡ和TB Green Premix ExTaqⅡ購(gòu)自寶生物工程(大連)有限公司;Quick Taq HS DyeMix購(gòu)自東洋紡(上海)生物科技有限公司;PCR產(chǎn)物純化試劑盒和膠回收試劑盒購(gòu)自O(shè)MEGA公司;DH5α購(gòu)自北京天根生化科技有限公司;LB培養(yǎng)基購(gòu)自青島海博試劑有限公司;高速離心機(jī)5804購(gòu)自Eppendor公司;普通PCR儀、核酸蛋白電泳儀、凝膠成像系統(tǒng)VersaDoc2000均購(gòu)自Bio-Rad公司。
1.1.3 引物 用西南民族大學(xué)生命科學(xué)與技術(shù)學(xué)院動(dòng)物醫(yī)學(xué)實(shí)驗(yàn)室基于RVA VP6基因建立的熒光定量PCR方法檢測(cè)303份腹瀉樣本中的RVA;RVA分型引物信息見文獻(xiàn)[23—24];用于RVA陽性樣本G型和P型全基因擴(kuò)增的引物信息見文獻(xiàn)[23—25]。以上所有引物均由上海生工生物工程技術(shù)服務(wù)有限公司合成。
1.2 方法
1.2.1 病毒核酸的提取 將適量的糞便樣本加入裝有400 μL生理鹽水的1.5 mL EP管中,根據(jù)生產(chǎn)商說明,使用RNAios Plus從400 μL糞便混懸液中提取病毒RNA。反轉(zhuǎn)錄按照PrimeScriptTMRT試劑盒說明書進(jìn)行,反轉(zhuǎn)錄產(chǎn)物于-20℃保存。
1.2.2 病料樣本的檢測(cè)分型及序列測(cè)定 以303份樣本的cDNA為模板,使用TB Green Premix ExTaqⅡ和Quick Taq HS DyeMix進(jìn)行RVA的檢測(cè)和分型,具體方法參照說明書。將PCR擴(kuò)增產(chǎn)物通過瓊脂凝膠核酸電泳及凝膠成像儀進(jìn)行檢測(cè)與分析。PCR產(chǎn)物純化后與pMD19-T載體連接,轉(zhuǎn)化到DH5α感受態(tài)細(xì)胞中,篩選陽性重組質(zhì)粒由上海生工生物有限公司雙向測(cè)序。對(duì)測(cè)序結(jié)果進(jìn)行序列拼接,并在NCBI中對(duì)拼接的基因組序列進(jìn)行比對(duì)。
1.2.3 RVA VP7和VP4基因型鑒定及序列分析 將測(cè)序獲得的RVA VP7和VP4基因的核苷酸序列使用RotaC2.0自動(dòng)基因分析軟件進(jìn)行序列分析以確定相應(yīng)毒株的基因型;應(yīng)用Lasergene中MegAlign軟件進(jìn)行同源性分析;并通過MEGA 7.0軟件用鄰近法構(gòu)建系統(tǒng)進(jìn)化樹,Bootstrap值選擇1 000重復(fù);應(yīng)用SimPlot和RDP4軟件對(duì)全基因組序列進(jìn)行重組分析。
2 結(jié)果
2.1 腹瀉樣本RVA的檢測(cè)和G/P型分型結(jié)果
303份仔豬腹瀉的樣本RVA檢測(cè)結(jié)果顯示:共檢出RVA陽性樣本98份(32.34%,95% confidence interval(CI)=27.1%—37.9%),40個(gè)豬場(chǎng)中有25個(gè)豬場(chǎng)檢出RVA陽性,檢出率為62.5%(95% CI=45.8%—77.3%)。對(duì)98份RVA陽性樣本分別測(cè)定P基因型和G基因型,共得到47株RVA VP4部分基因、30株RVA VP7部分基因、12株RVA VP4全基因組和9株RVA VP7全基因組,GenBank登錄號(hào)為MT198708—MT198805,將測(cè)序獲得的RVA VP7和VP4基因的核苷酸序列使用RotaC2.0自動(dòng)基因分析軟件進(jìn)行序列分析以確定相應(yīng)毒株的基因型。結(jié)果顯示:G型存在G9(16/39)、G5(11/39)、G4(9/39)、G3(1/39)和G26(2/39)五種型;P型存在P[13](24/59)、P[23](14/59)、P[6](18/59)和P[1](3/59)4種型。有30份樣本成功測(cè)定出G/P組合基因型,共包括10種組合,分別為:G9P[23](7/30);G4P[6](5/30);G26P[13](2/30);G9P[13](4/30);G5P[23] (3/30);G4P[23](1/30);G3P[13](1/30);G5P[13](3/30);G4P[13](2/30);G9P[6](2/30),RVA的檢測(cè)結(jié)果及詳細(xì)分布見表1。
2.2 RVA VP7 基因部分序列遺傳進(jìn)化分析
將本研究中獲得的30株RVA VP7部分基因和9株全基因組序列與其他已知G基因型的代表毒株通過MEGA 7.0軟件進(jìn)行遺傳進(jìn)化分析,結(jié)果顯示(圖1):所獲得的G3型毒株與四川豬源毒株SCQL-5-3(GenBank No. MG066590)親緣關(guān)系最近;四川地區(qū)G4型RVA分為兩個(gè)不同的分支,來自同一地區(qū)4個(gè)毒株和RVA/Pig/CHN/SCMS-69與日本豬源毒株GUB71(GenBank No. AB573647)聚為一個(gè)分支,另外4株G4型RVA毒株分別來自兩個(gè)地區(qū),在分支的上端與中國(guó)豬源和人源毒株聚為一支;在G5型RVA分支中,來自同一地區(qū)的7株毒株聚為一個(gè)分支,來自同一地區(qū)的4株G5型RVA分別與中國(guó)臺(tái)灣豬源毒株和河北人源RVA毒株聚為一支;在G9型RVA分支中,RVA/Pig/CHN/SCSN-96和RVA/Pig/CHN/SCRS-142雖來自不同地區(qū),但都與中國(guó)豬源的毒株HBHP(GenBank No. KX831114)同源性最高為98.3%,并與另外2個(gè)地方的5株毒株聚為一支,剩余來自5個(gè)地區(qū)的7株毒株與湖北豬源毒株(GenBank No. KX831100)同源性最高為95.9%—97.1%,來自內(nèi)江的2株毒株單獨(dú)聚為一支;本研究獲得的兩株來自同一地區(qū)的G26型RVA毒株與尼泊爾人源毒株親緣關(guān)系最近。RVA VP7基因同源性分析見表2。
2.3 RVA VP4 基因部分序列遺傳進(jìn)化分析
將本研究中獲得的47株RVA VP4部分基因和12株全基因組序列與其他已知P基因型的代表毒株通過MEGA 7.0軟件中鄰近法構(gòu)建系統(tǒng)進(jìn)化樹。結(jié)果顯示(圖2):3株P(guān)[1]型RVA毒株與人源、牛源和羊源的毒株聚為一個(gè)大支;15株來自同一豬場(chǎng)的P[6]型RVA毒株在進(jìn)化樹上端單獨(dú)聚為一支,其余3株均與斯里蘭卡人源毒株R1207(GenBank No. LC389888)的同源性最高為95.7%—98.6%;本研究中的P[13]型毒株RVA/Pig/CHN/SCYB/Y1單獨(dú)分為一支,其余23株分散在4個(gè)亞支中,分支Ⅰ由來自8個(gè)地區(qū)的11株毒株與四川豬源毒株(GenBank No. MK410284)和人源毒株(GenBank No. MK597985)組成;分支Ⅱ進(jìn)一步分為2個(gè)亞支,分別由RVA/Pig/CHN/SCLZ/FB與日本豬源毒株FGP36(GenBank No. AB573878)和本研究中其余2株毒株與中國(guó)豬源毒株LNCY(GenBank No. MF462324)組成;分支Ⅲ由本研究中分別來自3個(gè)地區(qū)的4株毒株與之前獲得的1株四川地區(qū)的毒株和1株日本豬源毒株(GenBank No. AB573650)組成;亞支Ⅳ中5株毒株與泰國(guó)豬源毒株CMP178(GenBank No. DQ536362)親緣關(guān)系最近。在P[23]型RVA毒株進(jìn)化樹中來自同一個(gè)豬場(chǎng)的7個(gè)毒株聚為一個(gè)小支,位于進(jìn)化樹的最上端,來自2個(gè)地區(qū)的3株毒株聚為一個(gè)小支。RVA/Pig/CHN/SCSN-96和來自同一個(gè)地區(qū)的2株毒株在進(jìn)化樹的最下端分別聚為一個(gè)小支。RVA VP4基因同源性分析見表3。
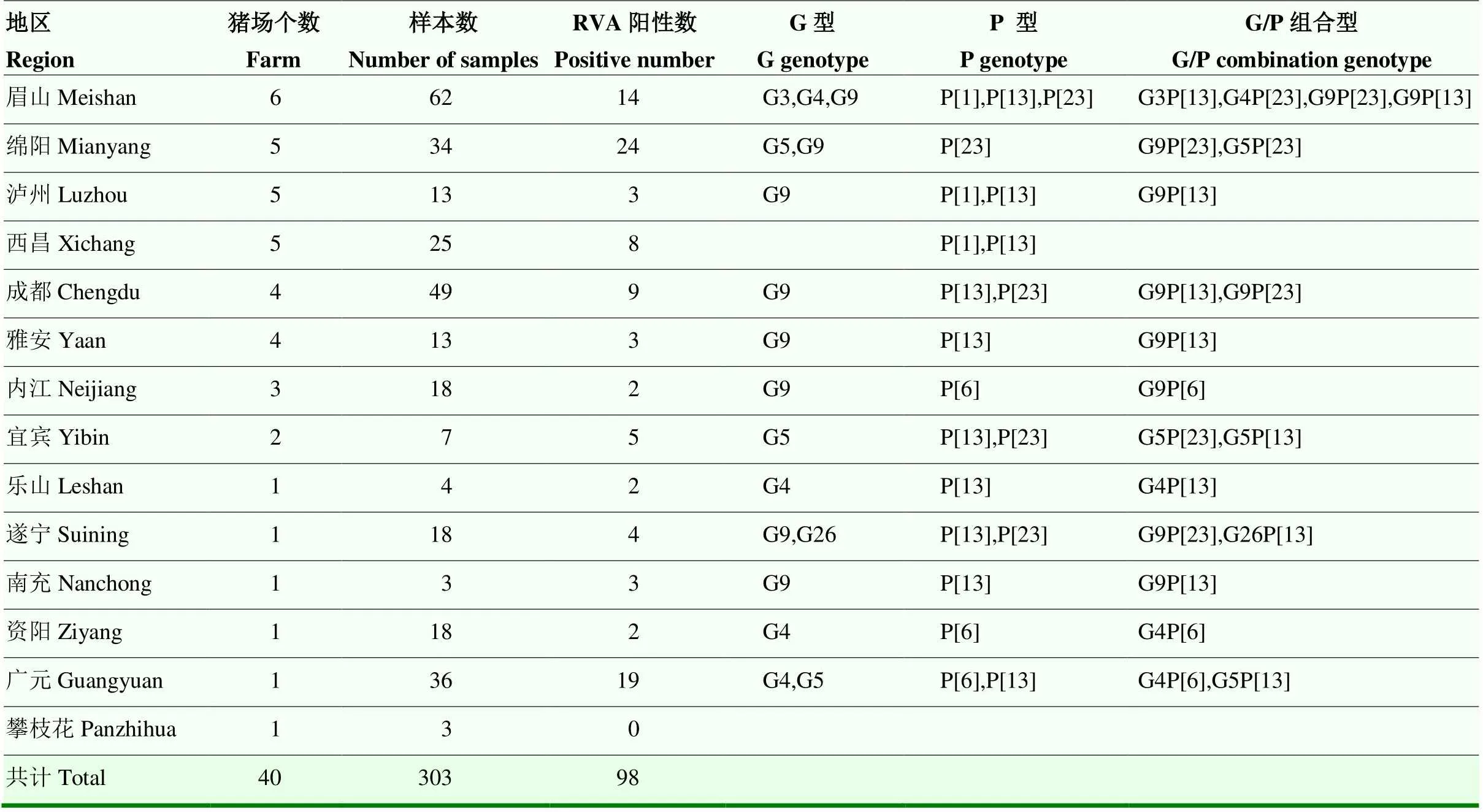
表1 四川地區(qū)豬場(chǎng)RVA感染率及基因型的分布

表2 RVA VP7 基因同源性分析
表中毒株名均為刪除毒株病毒名、宿主、地區(qū)、年份和基因型之后的簡(jiǎn)稱,括號(hào)里為GenBank號(hào)。下同
The strain names in the table are short names after deleting the strain virus name, host, region, year and genotype, the GenBank number is in parentheses. The same as below
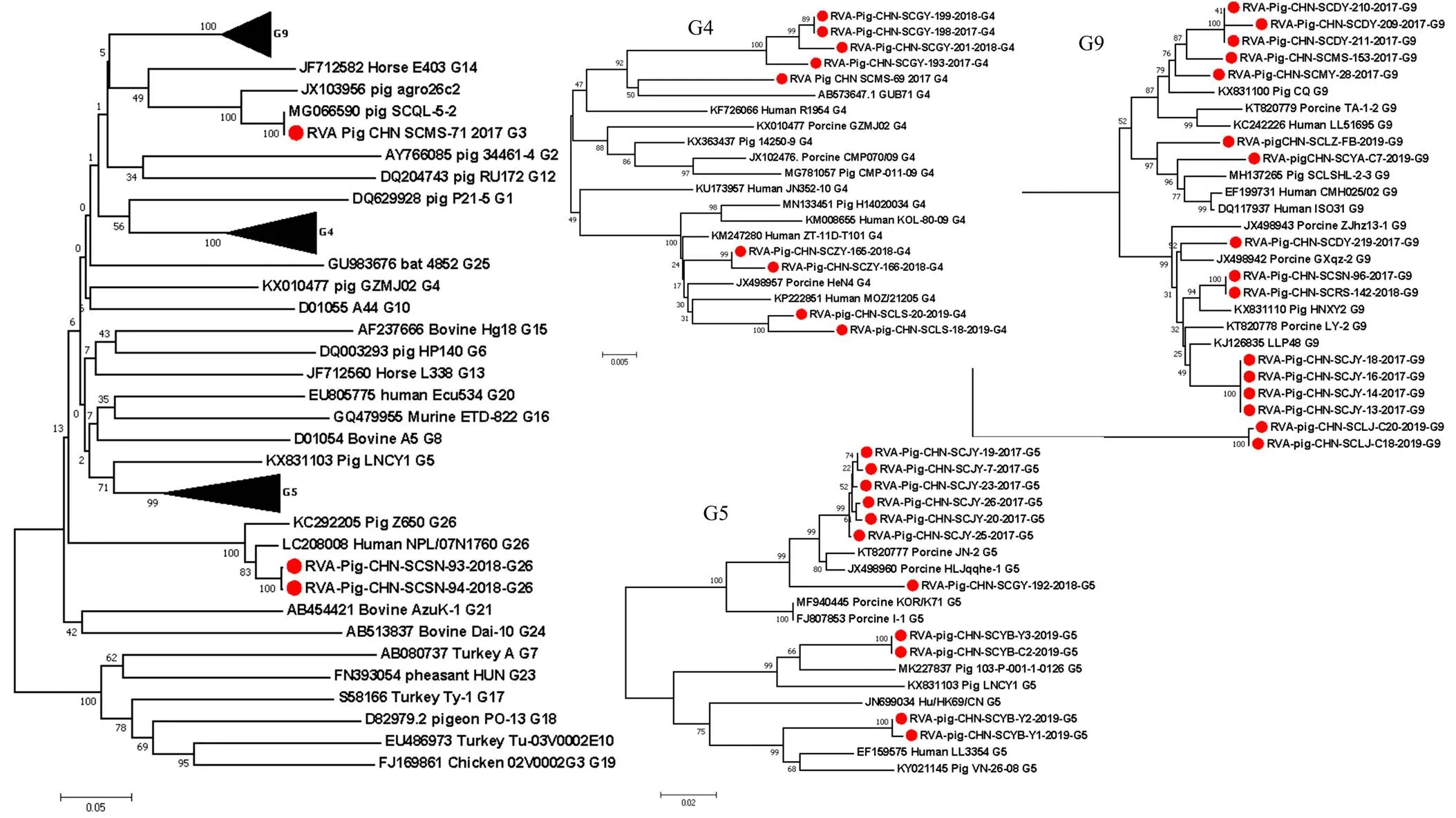
:本研究中的毒株 Strains in this study。下同 The same as below
2.4 RVA VP7基因和VP4基因重組分析
應(yīng)用SimPlot和RDP4軟件對(duì)12株RVA VP4全基因組和9株RVA VP7全基因組序列進(jìn)行重組分析。結(jié)果顯示:RVA/Pig/CHN/SCLJ/C18和RVA/Pig/CHN/ SCLJ/C20的VP7基因,RVA/Pig/CHN/SCYB/Y1和RVA/Pig/CHN/SCYB/Y2的VP4基因均發(fā)生了重組。RVA/Pig/CHN/SCLJ/C20和RVA/Pig/CHN/SCLJ/C18(圖略)均為豬源G9型YN(GenBank No. KJ466985)與人源G4型KOL-80-09(GenBank No. KM008655)的重組毒株,預(yù)測(cè)重組值為0.692和0.703,預(yù)測(cè)重組斷點(diǎn)位于253和707 bp處(圖3);RVA/Pig/CHN/ SCYB/Y1為豬源P[23]型14150-53(GenBank No. KX363351)與鼠源P[13]型SCLS-M(GenBank No. MK606442)的重組毒株,預(yù)測(cè)重組值為0.692,預(yù)測(cè)重組斷點(diǎn)位于860 bp(圖3);RVA/Pig/CHN/SCYB/Y2為豬源P[23]型14175-24(GenBank No. KX363359)與豬源P[13]型SWU-1C(GenBank No. MK410284)的重組毒株,預(yù)測(cè)重組值為0.634,預(yù)測(cè)重組斷點(diǎn)位于1 604 bp(圖略)。本研究分別對(duì)每個(gè)毒株重組斷點(diǎn)前后區(qū)域構(gòu)建了進(jìn)化樹,結(jié)果顯示毒株重組斷點(diǎn)前后均表現(xiàn)出不一致的遺傳進(jìn)化關(guān)系,進(jìn)一步證實(shí)了本研究中毒株的重組事件。

表3 RVA VP4 基因同源性分析
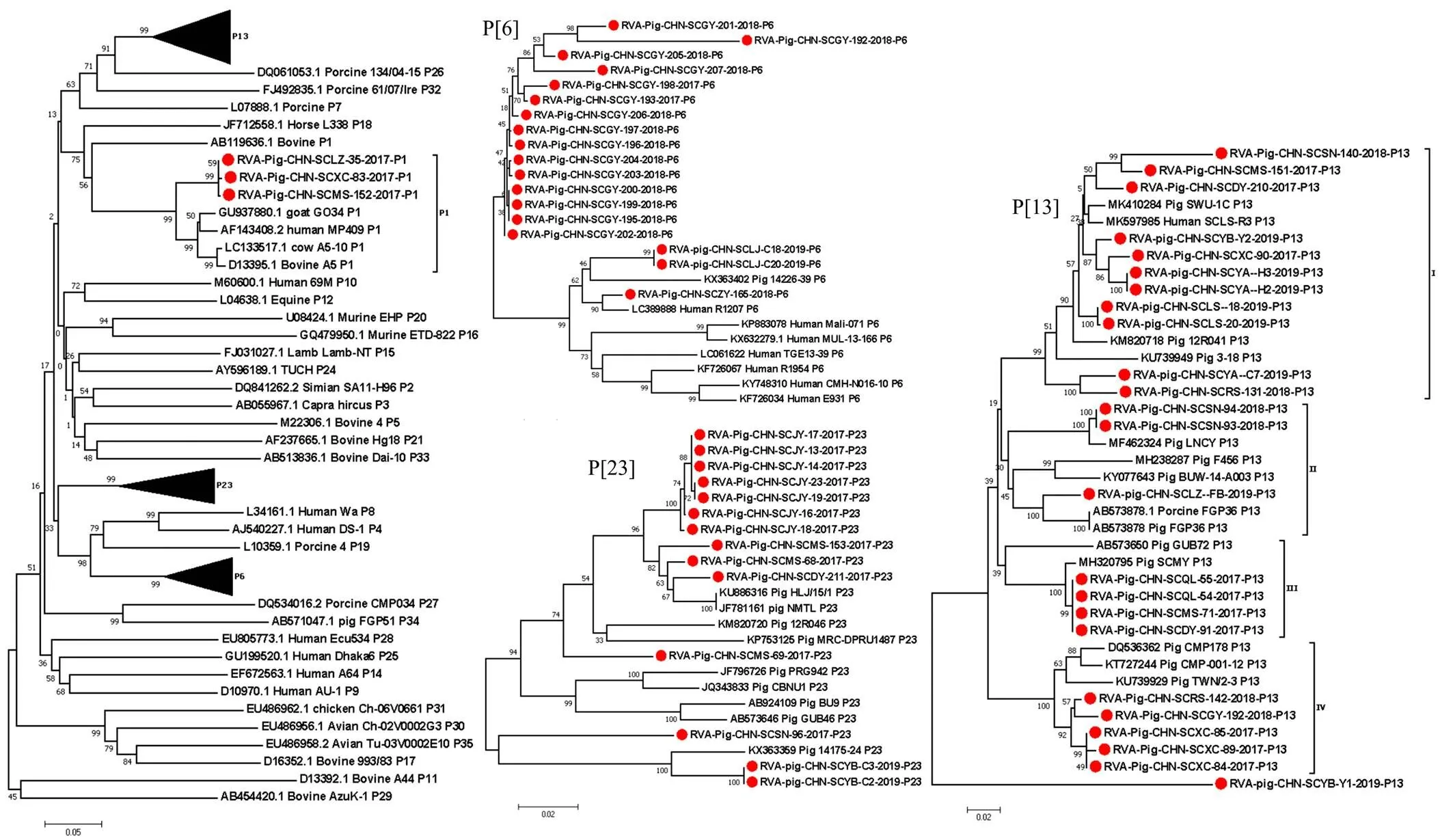
:右側(cè)P[6],P[13]和 P[23]進(jìn)化樹的縮略圖 Thumbnails of the right P[6], P[13] and P[23] phylogenetic trees
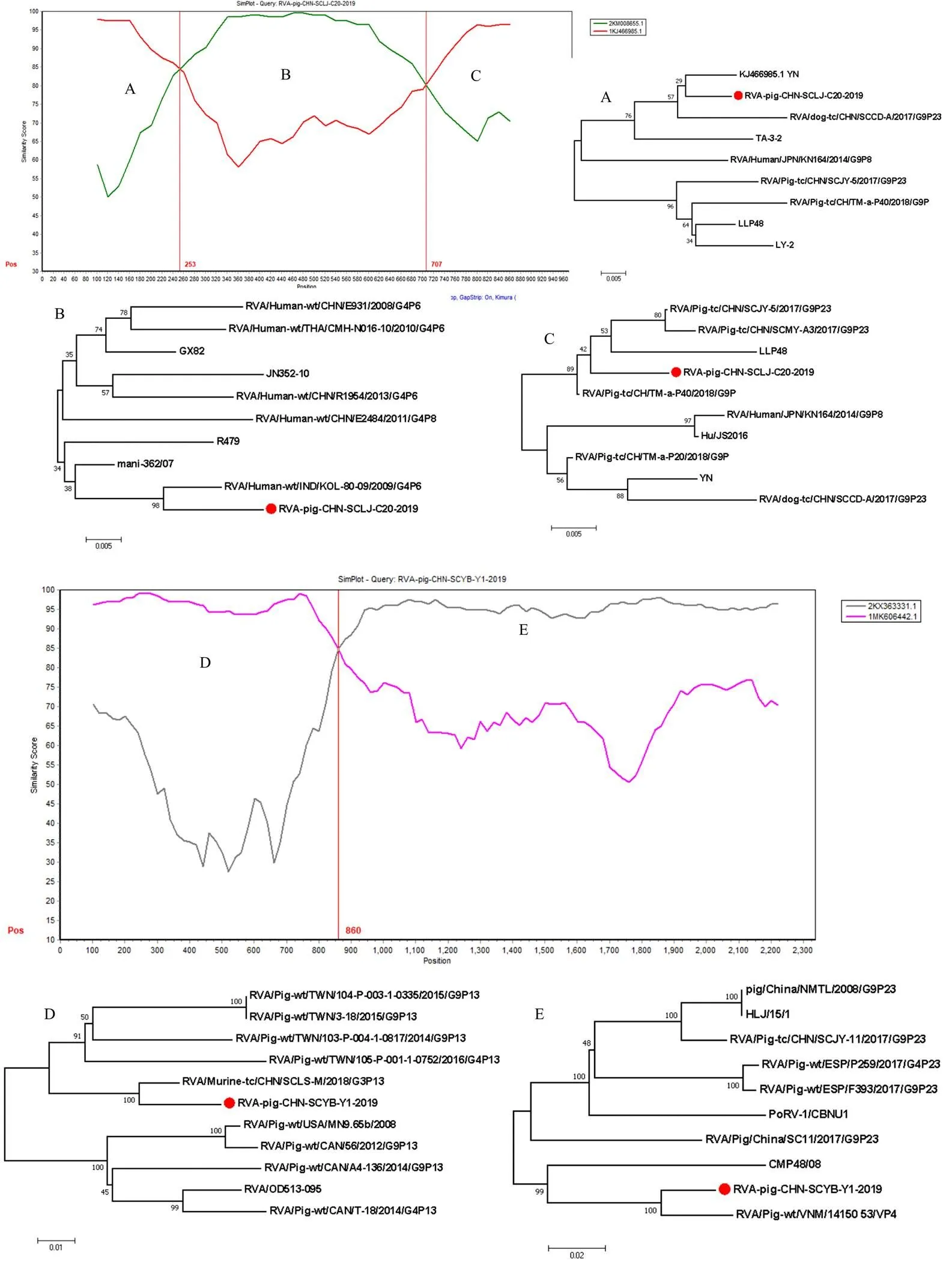
縱軸表示查詢毒株與其他參考毒株核苷酸序列的相似性(%),水平軸表示核苷酸位置。A、B、C為Simplot軟件分析毒株RVA/Pig/CHN/ SCLJ/C20/2019 VP7基因重組區(qū)域及基于A、B、C重組區(qū)域構(gòu)建的進(jìn)化樹;D、E為Simplot軟件分析毒株RVA/Pig/CHN/SCYB/Y1/2019 VP4基因重組區(qū)域及基于D、E重組區(qū)域構(gòu)建的進(jìn)化樹
3 討論
RVA是引起嬰幼兒以及多種幼齡動(dòng)物急性腸胃炎的重要病原[26-28],對(duì)養(yǎng)殖業(yè)造成重大的經(jīng)濟(jì)損失。國(guó)內(nèi)病原學(xué)檢測(cè)結(jié)果顯示RVA在我國(guó)規(guī)模化豬場(chǎng)中普遍存在,仔豬腹瀉糞便中RVA的陽性率為7.69%—28.76%[16-19]。本研究采用熒光定量RT-PCR的方法對(duì)2017—2019年四川遂寧、宜賓、資陽、西昌和眉山等14個(gè)地區(qū)共40個(gè)規(guī)模化豬場(chǎng)的303份仔豬腹瀉糞便樣本進(jìn)行了RVA的檢測(cè),結(jié)果顯示豬場(chǎng)RVA陽性率為62.5%(25/40),RVA個(gè)體陽性率為32.34%(98/303),較2014—2016年四川地區(qū)RVA的陽性率(7.69%—26.7%)明顯增高[16-17]。由于不同豬場(chǎng)的衛(wèi)生條件和地理位置不同,不同豬場(chǎng)中RVA陽性率區(qū)別較大,在四川不同地區(qū)的豬場(chǎng)中RVA個(gè)體陽性率也有區(qū)別,綿陽、宜賓和廣元地區(qū)的RVA陽性率較高,均超過了50%,而內(nèi)江和資陽等地的RVA陽性率相對(duì)較低,為10%左右。本研究表明RVA在四川地區(qū)豬場(chǎng)中感染嚴(yán)重且分布廣泛。因此,有必要加強(qiáng)對(duì)四川地區(qū)RVA的監(jiān)測(cè),本研究結(jié)果對(duì)四川地區(qū)RVA的防控提供了重要的科學(xué)依據(jù)。
VP7和VP4分別決定RVA的G型和P型,且G型與P型之間會(huì)產(chǎn)生不同的組合,不同組合型的RVA毒株誘導(dǎo)的交叉保護(hù)性低[2,12]。因此,加強(qiáng)對(duì)RVA不同G/P型的監(jiān)測(cè)和研究對(duì)了解RVA的遺傳進(jìn)化和疫苗研究非常重要。在本研究中,四川地區(qū)RVA中G9型、G5型和G4型為最為流行的G型,分別占分型毒株的41%、28.2%和23%;P[13]型、P[6]型和P[23]型為最為流行的P型,分別占分型毒株的40.7%、30.5%和23.7%,而其中P[13]型RVA最具多樣性和復(fù)雜性;優(yōu)勢(shì)G/P基因型為G9P[23],占分型樣本的23.3%,其中眉山地區(qū)的組合基因型最為復(fù)雜,存在3種不同的基因組合型(G3P[13]、G4P[23]和G9P[23])(表1)。本研究還在四川地區(qū)仔豬中檢測(cè)出了G4P[23]、G4P[13]、G9P[6]、G26P[13]和G5P[23] 5種首次在國(guó)內(nèi)出現(xiàn)的組合基因型。此外,對(duì)39株RVA VP7基因片段和59株RVA VP4基因片段同源性分析表明(表2、表3),本研究所獲毒株與東南亞地區(qū)的豬源和人源毒株具有高度同源性。在30株成功鑒定出G/P組合基因型的毒株中,有13株毒株存在豬RVA與人RVA基因重配現(xiàn)象,推測(cè)在我國(guó)和東南亞地區(qū)豬RVA與人RVA存在交叉?zhèn)鞑ィ掖嬖诖罅康幕蛑嘏涠局辍1狙芯拷Y(jié)果對(duì)四川地區(qū)豬RVA的防控提供了重要參考,其中首次報(bào)道的在國(guó)內(nèi)新出現(xiàn)的RVA組合基因型豐富了國(guó)內(nèi)RVA的資料,有利于對(duì)國(guó)內(nèi)RVA的監(jiān)測(cè)。對(duì)了解四川地區(qū)豬RVA的遺傳多樣性提供了科學(xué)依據(jù),豐富了四川地區(qū)RVA的流行病學(xué)資料。
研究表明豬RVA與人RVA具有高度的相似性,且常發(fā)生重組和重配事件[1,29-30]。近年來,四川地區(qū)RVA重組事件陸續(xù)被報(bào)道[21,31],本研究中獲得的12株RVA VP4全基因組和9株RVA VP7全基因組中分別存在2株RVA VP4和2株RVA VP7重組毒株。其中G型重組毒株為G4型和G9型重組,P型重組毒株為P[13]型與P[23]型重組,表明在四川地區(qū)RVA感染率升高的同時(shí),RVA流行基因型之間重組頻率也正在逐漸增高,提示應(yīng)加強(qiáng)對(duì)四川地區(qū)RVA分子流行病學(xué)的監(jiān)測(cè)和對(duì)豬RVA的綜合防控。兩株P(guān)型重組毒株來自同一豬場(chǎng),均為豬源毒株與豬源毒株發(fā)生重組,但兩株毒株預(yù)測(cè)的重組斷點(diǎn)和親本株存在差異。兩株G型重組毒株來自內(nèi)江某豬場(chǎng),為人源毒株與豬源毒株重組,但兩株毒株預(yù)測(cè)的重組斷點(diǎn)相近,并且親本株一致。推測(cè)兩株P(guān)型重組毒株所在場(chǎng)內(nèi)豬群存在多種豬RVA毒株混合感染,而兩株G型重組毒株所在場(chǎng)內(nèi)豬群可能存在跨種間傳播,但該場(chǎng)內(nèi)具體的傳播途徑還需要根據(jù)具體情況進(jìn)行進(jìn)一步調(diào)查研究。
4 結(jié)論
通過對(duì)2017—2019年間在四川省不同地區(qū)采集的豬腹瀉樣本進(jìn)行豬RVA的檢測(cè)和分型鑒定,揭示了近年來四川省豬A群輪狀病毒的主要流行毒株,G9型和P[13]型為分別為優(yōu)勢(shì)G基因型和P基因型,G9P[23]為優(yōu)勢(shì)組合基因型。總體看來,A群輪狀病毒在四川地區(qū)豬群中的分布廣泛且基因型多樣,與人源毒株關(guān)系密切,并且個(gè)別毒株存在基因重組現(xiàn)象。
[1] Theingi W M, Hlaing M T, Ye M K, Khin M A, Mo M W, Htin L, Thin T S, Win M, Khin K O, Kyaw Z T. Sentinel surveillance for rotavirus in children <5 years of age admitted for Diarrheal illness to Yangon Children's Hospital, Myanmar, 2009-2014. Vaccine, 2018, 36(51): 7832-7835. doi:10.1016/j.vaccine.2017.11.002.
[2] Hoshino Y, Sereno M M, Midthun K, Flores J, Kapikian A Z, Chanock R M. Independent segregation of two antigenic specificities (VP3 and VP7) involved in neutralization of rotavirus infectivity. Proceedings of the National Academy of Sciences of the United States of America, 1985, 82(24): 8701-8704. doi:10.1073/pnas.82.24.8701.
[3] Mihalov K E, Gellért á, Marton S, Farkas S L, Fehér E, Oldal M, Jakab F, Martella V, Bányai K. Candidate new rotavirus species in sheltered dogs, Hungary. Emerging Infectious Diseases, 2015, 21(4): 660-663. doi:10.3201/eid2104.141370.
[4] Matthijnssens J, Otto P H, Ciarlet M, Desselberger U, Van R M, Johne R. VP6-sequence-based cutoff values as a criterion for rotavirus species demarcation. Archives of Virology, 2012, 157(6): 1177-1182. doi:10.1007/s00705-012-1273-3.
[5] Tonietti P O, Hora A S, Silva F D F, Ruiz V L A, Gregori F. Phylogenetic analyses of the VP4 and VP7 genes of porcine group A rotaviruses in Sao Paulo State, Brazil: first identification of G5P[23] in piglets. Journal of Clinical Microbiology, 2013, 51(8): 2750-2753. doi:10.1128/JCM.01175-13.
[6] Vlasova A N, Amimo J O, Saif L J. Porcine Rotaviruses: Epidemiology, immune responses and control strategies.Viruses, 2017, 9(3): 48. doi:10.3390/v9030048.
[7] Kozyra I, Kozyra J, Dors A, Rze?utka A. Molecular characterisation of porcine group A rotaviruses: Studies on the age-related occurrence and spatial distribution of circulating virus genotypes in Poland. Veterinary Microbiology, 2019, 232: 105-113. doi:10.1016/j.vetmic.2019.03.026.
[8] Wakuda M, Ide T, Sasaki J, Komoto S, Ishii J, Sanekata T, Taniguchi K. Porcine rotavirus closely related to novel group of human rotaviruses. Emerging Infectious Diseases, 2011, 17(8): 1491-1493. doi:10.3201/eid1708.101466.
[9] Malasao R, Khamrin P, Kumthip K, Ushijima H, Maneekarn N. Complete genome sequence analysis of rare G4P[6] rotavirus strains from human and pig reveals the evidence for interspecies transmission. Infection, Genetics and Evolution, 2018, 65: 357-368. doi:10.1016/j.meegid.2018.08.019.
[10] Ghosh S, Varghese V, Samajdar S, Bhattacharya S K, Kobayashi N, Naik T N. Evidence for independent segregation of the VP6- and NSP4- encoding genes in porcine group A rotavirus G6P[13] strains. Archives of Virology, 2007, 152(2): 423-429. doi:10.1007/s00705-006-0848-2.
[11] Agbemabiese C A, Nakagomi T, Gauchan P, Sherchand J B, Pandey B D, Cunliffe N A, Nakagomi O. Whole genome characterisation of a porcine-like human reassortant G26P[19] Rotavirus A strain detected in a child hospitalised for diarrhoea in Nepal, 2007. Infection, Genetics and Evolution, 2017, 54: 164-169. doi:10.1016/j.meegid.2017.06.026.
[12] Greenberg H, McAuliffe V, Valdesuso J, Wyatt R, Flores J, Kalica A, Hoshino Y, Singh N. Serological analysis of the subgroup protein of rotavirus, using monoclonal antibodies. Infection and Immunity, 1983, 39(1): 91-99. doi: 10.1128/ IAI.39.1.91-99.
[13] Papp H, László B, Jakab F, Ganesh B, De G S, Matthijnssens J, Ciarlet M, Martella V, Bányai K. Review of group A rotavirus strains reported in swine and cattle. Veterinary Microbiology, 2013, 165: 190-199. doi:10.1016/j.vetmic. 2013.03.020.
[14] MATTHIJNSSENS J, CIARLET M, MCDONALD S M, ATTOUI H, BáNYAI K, BRISTER J R, BUESA J, ESONA M D, ESTES M K, GENTSCH J R, et al. Uniformity of rotavirus strain nomenclature proposed by the Rotavirus Classification Working Group (RCWG). Archives of Virology, 2011,156(8): 1397-1413.doi:10.1007/s00705- 011-1006-z.
[15] Jing Z, Zhang X, Shi H, Chen J, Shi D, Dong H, Feng L. A G3P[13] porcine group A rotavirus emerging in China is a reassortant and a natural recombinant in the VP4 gene. Transboundary and Emerging Diseases, 2018, 65(2): e317-e328. doi:10.1111/tbed.12756.
[16] 曹恭貌, 張斌, 岳華, 費(fèi)磊, 任玉鵬. 四川部分豬場(chǎng)PEDV、TGEV、GARV和PKV感染狀況調(diào)查. 動(dòng)物醫(yī)學(xué)進(jìn)展, 2016, 37(1): 118-122.
CAO G M, ZHANG B, YUE H, FEI L, REN Y P. Investigation of PEDV, TGEV, GARV and PKV infection in some pig farms in Sichuan Province. Progress in Veterinary Medicine, 2016, 37(1): 118-122. (in Chinese)
[17] 楊文宇, 周遠(yuǎn)成, 韓燕, 陳蕾, 廖春燕, 付夢(mèng)瑾, 季洪偉, 蔡雨涵, 朱玲, 徐志文, 郭萬柱.豬A群輪狀病毒和C群輪狀病毒以及豬星狀病毒多重RT-PCR同時(shí)檢測(cè)方法的建立及應(yīng)用. 中國(guó)獸醫(yī)科學(xué), 2014, 44(4): 394-400.
YANG W Y, ZHOU Y C, HAN Y, CHEN L, LIAO C Y, FU M J, JI H W, CAI Y H, ZHU L, XU Z W, GUO W Z. Establishment and clinical application of a multiplex reverse transcription-PCR for simultaneous detection of porcine group A rotrvirus, porcine group C rotavirus and porcine astrovirus. Chinese Veterinary Science, 2014, 44(4): 394-400. (in Chinese)
[18] Xue R, Tian Y, Zhang Y, Zhang M, Li Z, Chen S, Liu Q. Diversity of group A?rotavirus of porcine rotavirus in Shandong province China. Acta Virologica, 2018, 62(3): 229-234. doi:10.4149/ av_2018_216.
[19] 周玲, 陳桂華, 伍子?jì)? 麥凱杰, 李迪, 王勝陽, 馬靜云, 張祥斌. 廣東地區(qū)2016-2017年規(guī)模化豬場(chǎng)腹瀉病原調(diào)查分析. 中國(guó)獸醫(yī)雜志, 2017, 53(10): 3-5+9+49.
ZHOU L, CHEN G H, WU Z X, MAI K J, LI D, WANG S Y, MA J Y, ZHANG X B. Investigation on porcine diarrhea pathogens in Guangdong province form 2016 to 2017. Chinese Journal of Veterinary Medicine, 2017,53(10):3-5+9+49. (in Chinese)
[20] 庫(kù)旭鋼, 張坤, 劉羽茜, 何啟蓋. 豬A群輪狀病毒的分離與鑒定. 畜牧獸醫(yī)學(xué)報(bào), 2012, 43(2):275-281.
KU X G, ZHANG K, LIU X X, HE Q G. Isolation and identification of group A porcine rotavirus. Acta Veterinaria et Zootechnica Sinica, 2012, 43(2): 275-281. (in Chinese)
[21] 李玉, 窮達(dá), 張敏, 闞蕊慈, 湯承, 岳華, 張斌. 豬A群輪狀病毒RVA/Pig-tc/CHN/SWU-1C/2018/G9P[13]株的分離與鑒定. 中國(guó)預(yù)防獸醫(yī)學(xué)報(bào), 2019, 41(11): 1170-1173.
LI Y, QIONG D, ZHANG M, KAN R C, TANG C, YUE H, ZHANG B. Isolation and identification of the porcine group A rotavirus strain of RVA/Pig-tc/CHN/SWU-1C/2018/G9P[13]. Chinese Journal of Preventive Veterinary Medicine, 2019, 41(11): 1170-1173. (in Chinese)
[22] Zhang H, Zhang Z, Wang Y F, Wang X, Xia M Q, Wu H. Isolation, molecular characterization and evaluation of the pathogenicity of a porcine rotavirus isolated from Jiangsu Province, China. Archives of Virology, 2015, 160(5): 1333-1338. doi:10.1007/s00705-015- 2347-9.
[23] Amimo J O, Vlasova A N, Saif L J. Detection and genetic diversity of porcine group A rotaviruses in historic (2004) and recent (2011 and 2012) swine fecal samples in Ohio: Predominance of the G9P[13] genotype in nursing piglets. Journal of Clinical Microbiology, 2013, 51(4), 1142-1151. doi:10.1128/JCM.03193-12.
[24] DiStefano D J, Kraiouchkine N, Mallette L, Maliga M, Kulnis G, Keller P M, Clark H F, Shaw A R. Novel rotavirus VP7 typing assay using a one-step reverse transcriptase PCR protocol and product sequencing and utility of the assay for epidemiological studies and strain characterization, including serotype subgroup analysis. Journal of Clinical Microbiology, 2005, 43(12): 5876-5880. doi:10.1128/JCM.43.12.5876-5880.
[25] Yan N, Tang C, Kan R C, Feng F, Yue H. Genome analysis of a G9P[23] group A rotavirus isolated from a dog with diarrhea in China. Infection, Genetics and Evolution, 2019, 70: 67-71. doi:10.1016/j. meegid.2019.02.020.
[26] Wang Y H, Pang B B, Zhou X, Ghosh S, Tang W F, Peng J S, Hu Q, Zhou D J, Kobayashi N. Complex evolutionary patterns of two rare human G3P[9] rotavirus strains possessing a feline/canine-like H6 genotype on an AU-1-like genotype constellation. Infection, Genetics and Evolution2013, 1: 103-112. doi:10.1016/j. meegid.2013.01.016.
[27] Timurkan M ?, Alkan F. Identification of rotavirus A strains in small ruminants: first detection of G8P[1] genotypes in sheep in Turkey.Archives of Virology2020, 165(2): 425-431. doi:10.1007/ s00705-019-04476-7.
[28] Mishra N, Reslan L, El-Husseini M, Raoof H, Finianos M, Guo C, Thakkar R, Inati A, Dbaibo G, Lipkin W I, Zaraket H. Full genome characterization of human G3P[6] and G3P[9] rotavirus strains in Lebanon. Infection, Genetics and Evolution2020, 78: 104-133. doi:10.1016/j.meegid.2019.104133.
[29] Li D D, Duan Z J, Zhang Q, Liu N, Xie Z P, Jiang B M, Steele D, Jiang X, Wang Z S, Fang Z Y. Molecular characterization of unusual human G5P[6] rotaviruses identified in China. Journal of Clinical Virology, 2008, 42(2): 141-148. doi:10. 1016/j.jcv.2007.12.013.
[30] Ramani S, Iturriza G M, Jana A K, Kuruvilla K A, Gray J J, Brown D W, Kang G. Whole genome characterization of reassortant G10P[11] strain (N155) from a neonate with symptomatic rotavirus infection: Identification of genes of human and animal rotavirus origin. Journal of Clinical Virology, 2009, 45(3): 237-244. doi:10.1016/j.jcv.2009.05.003.
[31] Chen D Y, Zhou L, Tian Y M, Wu X, Feng L, Zhang X P, Liu Z H, Pang S R, Kang R M, Yu J F, Ye Y G, Wang H N, Yang X. Genetic characterization of a novel G9P[23] rotavirus A strain identified in southwestern China with evidence of a reassortment event between human and porcine strains. Archives of Virology, 2019, 164(4): 1229-1232. doi:10.1007/s00705-019-04188-y.
Molecular Epidemiological Investigation of Porcine Group A Rotavirus in Sichuan from 2017 to 2019

1College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041;2College of Veterinary Medicine, South China Agricultural University, Guangzhou 510642;3Animal Husbandry Bureau of Xichang City, Xichang 615000, Sichuan;4Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization of Ministry of Education/Sichuan Province, Chengdu 610041
【】The aim of this study was to investigate the prevalence and molecular characterization of porcine group A rotavirus (RVA) in large-scale pig farms in Sichuan, to provid a theoretical basis for the development for porcine RVA vaccine. 【】From 2017 to 2019, the 303 samples were collected from 40 pig farms in 14 regions of Sichuan province. Prevalence of RVA was detected by real-time RT-PCR method, and RVA positive samples were typed by RT-PCR. At the same time, the whole genomes of RVA VP4 and VP7 gene were amplified from some positive samples. The genotypes of the corresponding strains were determined by RotaC2.0classification tool. Sequence homology was analyzed by MegAlign. Phylogenetic tree was constructed by Neighbor-Joining method through MEGA 7.0. SimPlot and RDP4 softwares were applied for recombination analysis. 【】Of the 303 samples examined, 32.34% (98/303, 95%CI=27.1%-37.9%) were positive for RVA. Among the 39 G types, G9 (41%) was the dominant genotype, while G4, G5, G26, and G3 were detected in 23%, 28.2%, 5.1% and 2.7%, respectively. The P[13] genotype (40.7%) was dominant among the 59 P types, followed by P[6], P[23] and P[1] in 30.5%, 23.7% and 5.1%, respectively. Furthermore, the 30 strains successfully identified the G/P combination genotype, and the dominant combination genotype was G9P[23] (23.3%), the other combinations were G4P[6] (16.7%), G9P[13] (13.3%), G5P[23] (10%), G5P[13] (10%), G9P[6] (6.7%), G26P[13] (6.7%), G4P[13] (6.7%), G4P[23] (3.3%) and G3P[13] (3.3%). Notably, the G5P[23], G4P[13], G9P[6], G26P[13] and G4P[23] were first identified in China. In addition, the recombination analysis showed that four strains had recombination on VP7 or VP4 genes. 【】The results demonstrated that the prevalence of RVA in diarrhea piglet feces was high and the genotypes were complex in Sichuan. The dominant genotype of RVAs was G9P[23]. The results of this study enriched the epidemiological data of RVA and provided an important reference for the prevention and control of porcine RVA in Sichuan province.
porcine group A rotavirus; molecular epidemiology; genomic research; recombination

10.3864/j.issn.0578-1752.2021.05.017
2020-04-13;
2020-07-29
國(guó)家自然科學(xué)基金(31772766)、四川應(yīng)用基礎(chǔ)研究計(jì)劃(2020YJ0247)、西南民族大學(xué)中央高校基本科研業(yè)務(wù)費(fèi)專項(xiàng)資金(2020NYB21)
周群,E-mail:2297248747@qq.com。陳小飛,E-mail:chenxf-1@163.com。周群與陳小飛為同等貢獻(xiàn)作者。通信作者張斌,E-mail:binovy@sina.com
(責(zé)任編輯 林鑒非)

