熟地黃多糖對骨關節炎軟骨細胞增殖、凋亡及炎性因子的影響及其機制
張明煥 毛文 劉雷 祁福 李北 鄭一舟
(武漢市第三醫院骨科,湖北 武漢 430000)
骨關節炎(OA)是一種常見的關節退行性疾病,其主要病理特征為關節軟骨細胞凋亡和細胞外基質的進行性降解〔1〕。近年來研究發現,中藥在OA的臨床治療中治療效果更佳,中藥復方劑對阻斷或延緩軟骨細胞凋亡有一定作用〔2,3〕。熟地黃多糖(RGP)是中藥熟地黃的主要成分,具有增強免疫、抗氧化、抗突變等作用〔4〕。此外,熟地黃在治療類風濕關節炎的方劑中發揮輔助作用,且含熟地黃的中藥配方對膝骨關節炎有良好的療效〔5,6〕。熟地黃多糖還能有效誘導H22荷瘤小鼠腫瘤細胞發生凋亡〔7〕。微小RNA(miRNA)是一類單鏈非編碼的小分子RNA,與OA軟骨基質降解過程中的炎性介質及各種細胞因子密切相關〔8〕。研究發現miR-140在OA組織中表達顯著減少,且參與軟骨細胞的重塑修復過程,與OA的發生發展密切相關〔9〕。但熟地黃多糖對OA軟骨細胞增殖、凋亡及炎性因子的影響及熟地黃多糖影響OA的機制是否與miR-140相關還尚未清楚,本實驗旨在研究熟地黃多糖對OA軟骨細胞增殖、凋亡及炎性因子的影響及其作用機制,為OA臨床診斷和治療提供新的方向。
1 材料與方法
1.1材料與試劑 胎牛血清、DEME培養基均購自美國Gibco公司;RNA提取試劑盒、反轉錄試劑盒和qRT-PCR試劑盒購自日本Takara公司;LipofectamineTM 2000轉染試劑盒購自美國Invitrogen公司;酶聯免疫吸附試驗(ELISA)試劑盒、CCK-8試劑盒、蛋白提取試劑盒、BCA試劑盒、膜聯蛋白V-異硫氰酸熒光素(Annexin V-FITC)和碘化丙錠(PI)試劑盒購自碧云天生物技術研究所;抗體購自上海煊翎生物科技有限公司。
1.2人OA軟骨細胞的分離培養 OA軟骨組織由當地骨科醫院提供,無菌條件下切碎OA軟骨組織,用0.15%的膠原酶充分消化,加入含10%胎牛血清的DEME的培養基終止反應,用22目細胞篩選過濾除渣后再以1 000 r/min的轉速離心5 min,去上清。加入無血清的DEME培養液重懸,37℃培養,2~3 d換代一次。
1.3熟地黃多糖的制備 稱取適量熟地黃,加6倍量水煎煮1 h;殘渣再煎煮2次,每次加3倍量水煮1 h,合并3次煎液,過濾后濃縮至每1 ml含原生藥0.2 g,-20℃保存,使用時按所需濃度稀釋。
1.4細胞分組和轉染 取常規培養的OA軟骨細胞消化后接種于96孔板中,培養到細胞貼壁后換成終濃度分別為0.0 μg/ml、12.5 μg/ml、25.0 μg/ml、50.0 μg/ml的熟地黃多糖再培養48 h,分別記為RGP 0.0 μg/ml組、RGP 12.5 μg/ml組、RGP 25.0 μg/ml組、RGP 50.0 μg/ml組;以不添熟地黃多糖培養的細胞作為對照(Control)組,以50.0 μg/ml熟地黃多糖培養的細胞為RGP組。OA軟骨細胞用無血清培養基培養12 h后進行轉染,將anti-miR-con、anti-miR-140質粒轉染至OA軟骨細胞中,再用50 μg/ml的熟地黃多糖處理后記為RGP+anti-miR-con組和RGP+anti-miR-140組;轉染按照LipofectamineTM 2000試劑盒進行操作。
1.5qRT-PCR分析miR-140的表達水平 按照Trizol說明書提取總RNA,用反轉錄試劑盒逆轉錄成cDNA,按照TaKaRa 熒光定量試劑盒使用說明配制反應體系,以β-actin為內參進行PCR擴增,每個樣品重復3次,循環條件為95℃ 30 s,60℃ 30 s;72℃ 30 s,共40個循環;60℃延長5 min。相對表達量采用2-△△Ct法計算。
1.6CCK-8法測定細胞增殖 分別在各組細胞培養至48 h時,每孔加入10 μl CCK-8試劑繼續孵育2 h。酶標儀測定各孔490 nm波長處吸光度A值,每組3個復孔取平均值。
1.7流式細胞術檢測細胞凋亡 用不含乙二胺四乙酸(EDTA)的胰酶消化各組細胞,離心收集各組細胞,磷酸鹽緩沖液(PBS)漂洗2次,加結合緩沖液重懸細胞。依據試劑盒說明書,先后加入Annexin V-FITC和PI避光孵育。流式細胞儀檢測激發波長488 nm和發射波長530 nm處的熒光強度。實驗重復3次。
1.8ELISA檢測白細胞介素(IL)-1β和腫瘤壞死因子(TNF)-α的表達水平 取各組細胞,離心取上清,按ELISA試劑盒說明書進行檢測。
1.9統計學分析 采用SPSS20.00軟件進行t檢驗、單因素方差分析。
2 結 果
2.1熟地黃多糖對OA軟骨細胞增殖的影響 相較于RGP 0.0 μg/ml組,RGP 25.0 μg/ml組和RGP 50.0 μg/ml組OA軟骨細胞的吸光度值顯著升高(0.64±0.05、0.94±0.05、1.18±0.07;P<0.05),RGP 12.5 μg/ml組吸光度值(0.78±0.06)無顯著變化。可見,一定濃度的熟地黃多糖可促進OA軟骨細胞增殖。選用濃度為50 μg/ml的熟地黃多糖做后續實驗。
2.2熟地黃多糖對OA軟骨細胞凋亡的影響 與對照組相比,RGP組OA軟骨細胞的凋亡率顯著降低〔(7.51±0.82)%vs (3.50±0.36)%;P<0.05〕。見圖1。
2.3熟地黃多糖對OA軟骨細胞炎性因子表達的影響 與對照組相比,RGP組OA軟骨細胞中IL-1β和TNF-α的表達水平顯著降低(P<0.05)。見圖2、表1。
2.4熟地黃多糖對OA軟骨細胞miR-140表達的影響 與對照組相比,RGP組OA軟骨細胞中miR-140表達水平顯著升高(P<0.05)。見表1。
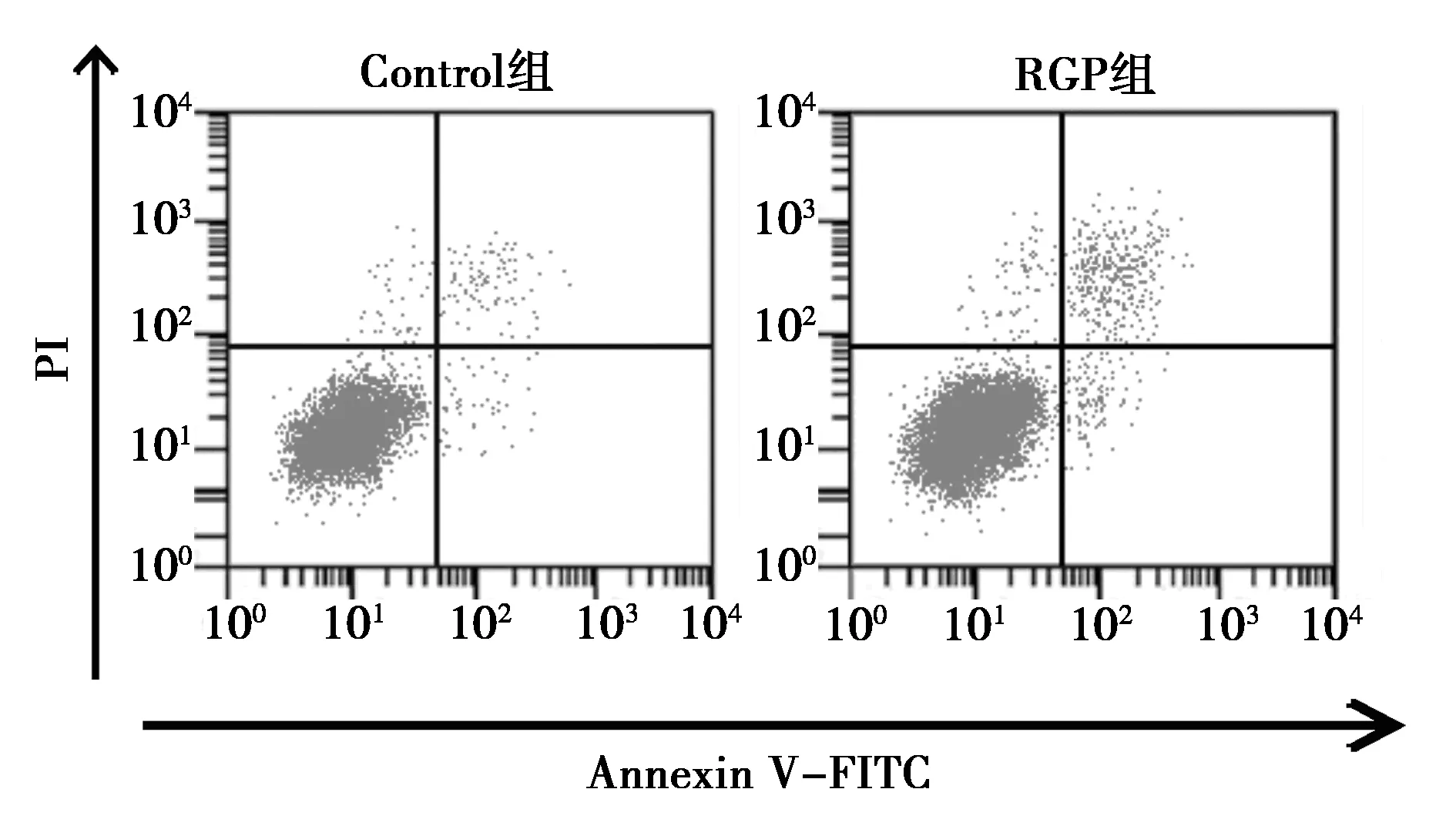
圖1 熟地黃多糖對OA軟骨細胞凋亡的影響
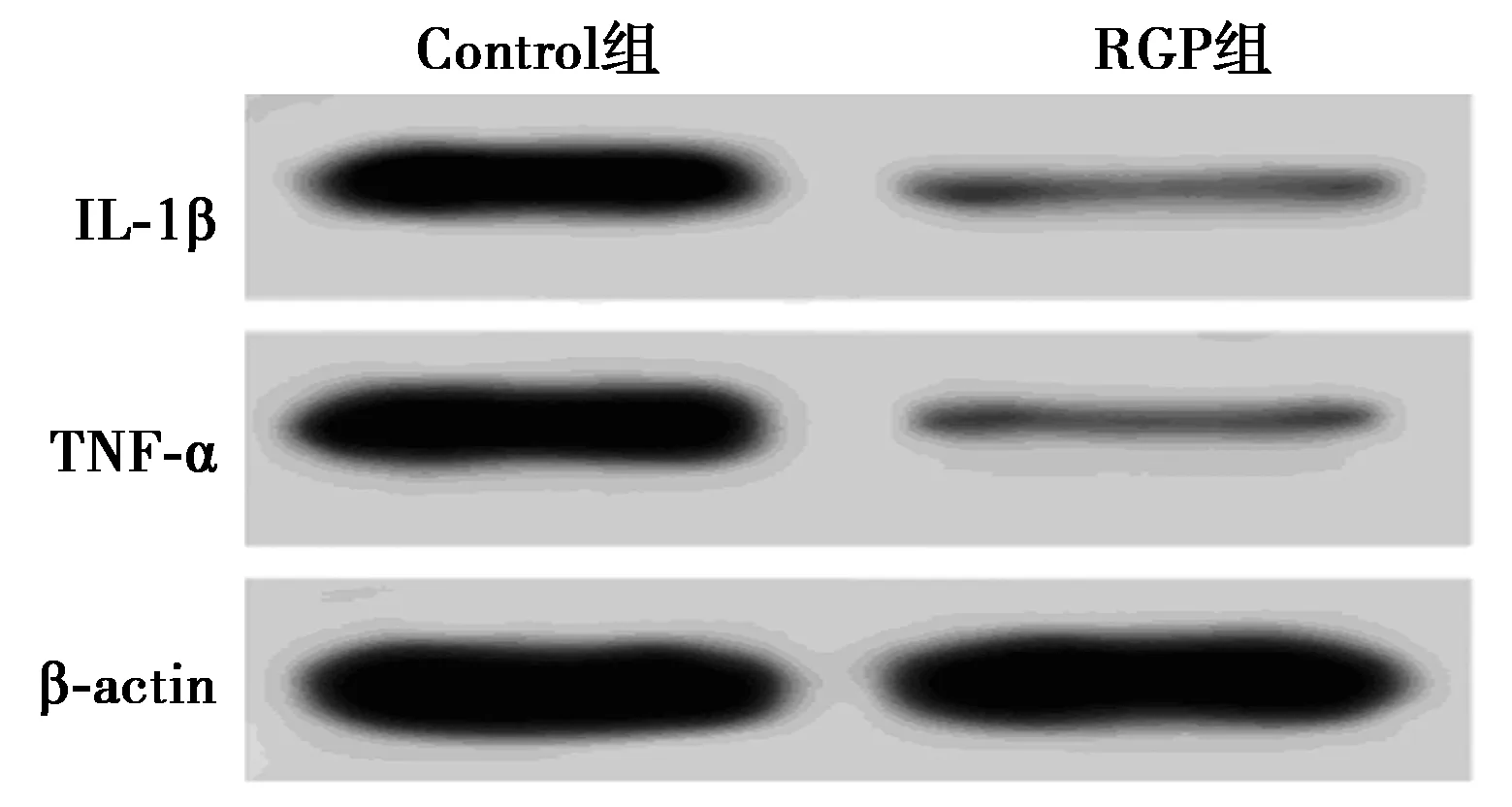
圖2 熟地黃多糖對OA軟骨細胞炎性因子表達的影響
表1 熟地黃多糖對OA軟骨細胞炎性因子表達及miR-140表達的影響
2.5熟地黃多糖通過上調miR-140的表達促進OA軟骨細胞的增殖并抑制其凋亡 與RGP+anti-miR-con組相比,RGP+anti-miR-140組OA軟骨細胞中miR-140表達水平、吸光度值顯著降低(P<0.05),細胞凋亡率顯著升高(P<0.05)。見表2。
表2 抑制miR-140的表達逆轉了熟地黃多糖對OA軟骨細胞增殖的促進作用和凋亡的抑制作用
2.6熟地黃多糖通過上調miR-140的表達抑制OA軟骨細胞炎性因子的表達 與RGP+anti-miR-con組相比,RGP+anti-miR-140組OA軟骨細胞中IL-1β和TNF-α表達水平顯著升高(P<0.05)。見圖3、表3。

1~4:Control組、RGP組、RGP+anti-miR-con組、RGP+anti-140組圖3 Western印跡檢測OA細胞炎性因子的表達
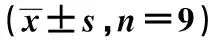
表3 抑制miR-140的表達逆轉熟地黃多糖對骨關節炎軟骨細胞炎性因子表達的抑制作用
3 討 論
在OA的病理進程中,炎癥可促進形成滑膜炎及破壞軟骨,而軟骨細胞的異常凋亡對OA的發生發展至關重要〔10,11〕。中醫藥治療OA療效明確,可以改善滑膜炎癥、降低炎癥因子水平、抑制氧自由基損傷、抑制軟骨細胞凋亡等〔12〕。熟地黃多糖是中藥熟地黃的一種提取物,據報道熟地黃多糖對阿霉素所致的白細胞減少導致的免疫功能損傷有一定的預防和保護作用〔13〕;熟地黃多糖還可通過TNF-α、信號轉導及轉錄活化因子(STAT)3和酪氨酸激酶(JAK)的表達抑制鼻咽癌增殖轉移,且具有一定的時間和劑量依賴性〔14〕。熟地黃具有免疫增強作用,增強T淋巴細胞Th1和Th2細胞因子的表達〔15〕。本實驗研究結果表明熟地黃多糖可以促進OA軟骨細胞增殖,抑制凋亡。即熟地黃多糖可有效治療OA。
研究顯示miRNA可通過調控軟骨組織的降解、軟骨細胞凋亡從而參與OA的發生發展〔16〕。miR-140在OA軟骨中顯著下調,在軟骨細胞增殖分化和關節炎的發病機制中起重要作用〔17〕。miR-140參與調控人類軟骨形成和發育,并促進骨髓間充質干細胞向軟骨細胞分化,IL-1β是軟骨退化和關節反應中的重要介質,用IL-1β刺激軟骨細胞可抑制miR-140表達〔18〕。本實驗中抑制miR-140表達可促進炎性因子IL-1β的表達。miR-140基因敲除能導致小鼠軟骨內成骨的生長缺陷〔19〕;miR-140可能通過胰島素樣生長因子結合蛋白(IGFBP)-5引起軟骨細胞合成減少,引起OA樣變〔20〕。以上研究結果均顯示miR-140對OA的發生發展具有重要的調控作用,本實驗研究結果說明抑制miR-140表達可抑制細胞增殖,促進細胞凋亡;抑制miR-140表達逆轉了熟地黃多糖對OA軟骨細胞增殖促進、凋亡抑制作用,此外,熟地黃多糖可上調miR-140的表達。說明熟地黃多糖可能通過調控miR-140影響OA軟骨細胞的增殖和凋亡。
OA軟骨中IL-1β和TNF-α mRNA表達上調〔21〕;IL-1β可誘導OA軟骨細胞的炎癥反應,TNF-α可刺激OA軟骨細胞凋亡,TNF-α還能誘導IL-1β的產生,而IL-1β能提高TNF-α的活性,兩者具有協同作用,介導對關節組織的破壞〔22〕。本實驗說明抑制miR-140表達促進炎性因子的表達,抑制miR-140表達逆轉了熟地黃多糖對IL-1β和TNF-α的抑制作用。
綜上所述,熟地黃多糖抑制IL-1β和TNF-α的表達,促進OA軟骨細胞的增殖,抑制凋亡,其機制可能與調控miR-140及炎性因子的表達有關;可為OA的治療提供新的研究思路和理論依據。

